Ku蛋白质在急、慢性骨髓系白血病的表达及其意义
王苏亮,包晓琳,魏金龙,曲颖,曲延章
齐齐哈尔医学院附属第二医院血液风湿内科四病区,黑龙江齐齐哈尔 161000
急性髓细胞白血病(acute myelocytic leukemia,AML)、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和慢性骨髓系白血病(chronic myelogenous leukemia,CML)属于恶性肿瘤,目前的救治措施除了骨髓移植外,各种放化疗治疗方案并不具有十分有效的效果[1-2]。治疗血液恶性肿瘤最常见且最困难的问题就是治疗失败,原因有很多,但最主要的是治疗方法与药物无法有杀死将癌细胞。许多研究都希望能解决或改善这种情形,以提高白血病的治愈率[3-4]。Ku蛋白质能够保护DNA双链,调控细胞周期。Ku蛋白缺乏会产生多种肿瘤;Ku蛋白活性改变,能够增强肿瘤放化疗敏感性。但急慢性白血病的Ku蛋白表达以及与抗白血病治疗之间的关系尚鲜见报道[5-7]。本研究选取2020年3月—2021年3月齐齐哈尔医学院附属第二医院门诊及住院治疗的35例急性白血患者,对照组选取12名健康人,CML患者6例。分析35例急性白血病患者的临床资料,探讨Ku蛋白在AML、ALL与CML患者中的表达,并揭示Ku蛋白与白血病治疗效果之间的关系,将对急慢性白血病的诊断及治疗提供有利的实际应用价值。采用有针对性的个性化治疗方案,提高患者的生存质量。现报道如下。
1 资料与方法
1.1 一般资料
收集35例急性白血病患者周边血液与骨髓穿刺液,其中AML19例,成人17例,儿童2例;16例ALL,成人10例,儿童6例。另外,筛选BCR-ABL(+)CML患者6例。对照组为12名正常人的周边血或骨髓穿刺液。所有参与项目的受试者采血和骨髓穿刺液都通过医学伦理委员会的审议并获得患者的知情同意。
1.2 细胞系收集
K562、HL-60、NB4人类急、慢性骨髓系白血病细胞购买自美国ATCC公司,本实验室具有保存的细胞株。
1.3 方法
(1)将获取的急慢性白血病患者外周血、骨髓穿刺液样本,分别在入院时,利用实时定量PCR、流式细胞术鉴定Ku蛋白的基因表达;通过ELISA方法和Western blotting方法检测急慢性白血病中Ku蛋白的表达定位以及表达含量情况。
(2)利用P65质粒,向K562、HL-60、NB4细胞内转染Ku基因,利用流式细胞术、Western blotting、ELISA进行检测转染的Ku蛋白表达情况[8]。MTT实验检测转染前后3种细胞的增殖变化情况;Western blotting、ELISA等实验观察转染Ku基因前后的3种白血病细胞的凋亡、自噬等变化;细胞迁移实验检测急慢性白血病细胞的迁移变化。
(3)实时定量PCR的关键参数如下。
①Ku蛋白引物序列。正义:5’TGT CAG GGT GGG AGT CAT ATT AC;反义 : 5’ TCG TTT TGC ACC TGG ATT ATC C。
②反应条件。10×缓冲液3.0 μl,1.5 mM氯化镁1.8 μl,0.25 mM dNTP 浓度 3.0 μl,0.2 μM 正义引物0.3 μl,0.2 μM反义引物0.3 μl,5 U/mL AmpliTag Gold 0.3 μl,dd H2O19.3 μl,cDNA2.0 μl。
③PCR条件。96℃,9 min(96℃,30 s,50℃,30 s,72℃,1 min)×40 cycles;72℃,10 s;保持4℃。
(4)Western blotting:急性白血病患者周边血液与骨髓穿刺液、6×105K562、HL-60、NB4人类急、慢性骨髓系白血病细胞,根据实验设计原理和方法,添加不同环境和不同药物或不容干扰条件,再将细胞培养12 h。培养足够合格的细胞中加入100 μl蛋白裂解液,完成细胞总蛋白的提取。每孔电泳槽中加入蛋白量约60 μg,250 mA电量转膜2 h。PVDF膜置入TBS-T缓冲液中完成漂洗后,再封闭液中放入脱脂奶粉,室温下振荡1 h。PVDF膜放入1∶200稀释的小鼠抗人Caspase 8、Ku、LC3蛋白抗体中,4℃过夜后,TBS-T液洗膜3次,添加1∶2 000稀释羊抗小鼠IgG的HRP标记,ECL试剂混均后,完成实验操作,观察成像结果。
(5)Annexin V-FITC 细胞凋亡实验:细胞凋亡试剂盒本实验采用 Annexin V-FITC试剂盒完成检测。将K562、HL-60、NB4人类急、慢性骨髓系白血病细胞5×105个,分别按要求种于6孔细胞培养板中,37℃,5%CO2培养12 h,根据本实验设计好的分组情况,继续培养6 h后,收集各个组的培养细胞,以0.01 mmol/L PBS缓冲液冲洗细胞,0.25%胰蛋白酶-EDTA溶液消化细胞2 min,消化细胞和细胞上清液放入4℃箱内,l 200 rpm,离心5 min后,再将上层的上清液去掉后,以100 μl PBS缓冲液充分混悬,然后加入 5 μl Annexin Ⅴ-FITC 与 2 μl碘丙啶(propidium iodine, PI),室温避光静置15 min后,加入400 μl PBS缓冲液后,即检测细胞凋亡率(%)以FACSAria Ⅱ流式细胞分选仪完成。
(6)MTT细胞增殖实验:在96孔细胞培养板中培养1×104cells/well细胞。按照实验分组情况,分别添加100 ng/mL米托司汀、2 μmol/L SB203580,在缺氧环境下培养12 h后,加入10 mL, 5 mg/mL MTT溶液,继续培养4 h,使用Emax 50酶标仪,震荡15 s,在490 nm波长检测细胞增殖的吸光度值(OD值)。
2 结果
将收治的35例急性白血病患者,实验分组比较结果。进行Western blotting分析Ku70,Ku80的表达,分析了AML和ALL的关联性。正常对照组其中2名的Ku70与Ku80蛋白质表现,量均低至无法侦测;但却表现出另一约86 kDa大小的蛋白质,见图1。在AML与ALL检查,Ku70与Ku80蛋白质表现量上升情形,亦表现出另一约69 kDa大小的蛋白质,见图2、图3。Ku70与Ku80在所有急性白血病患者,AML、ALL患者的表现情形及相关性,差异有统计学意义(P=0.001、0.036、0.046),见图 4、图5、图6。

图1 Western blotting检测正常对照组的Ku70和Ku 80

图2 Western blotting检测AML组的Ku70和Ku 80

图3 Western blotting检测ALL组的Ku70和Ku 80
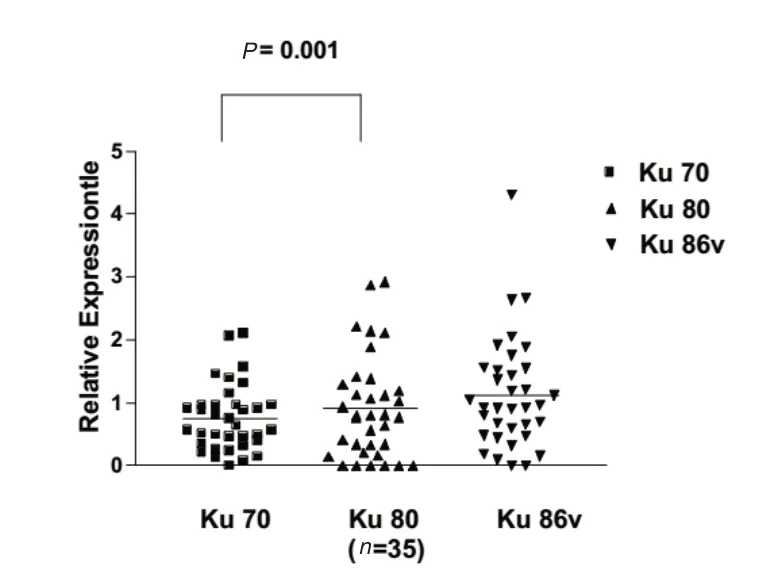
图4 急性白血病中Ku蛋白的相对表达
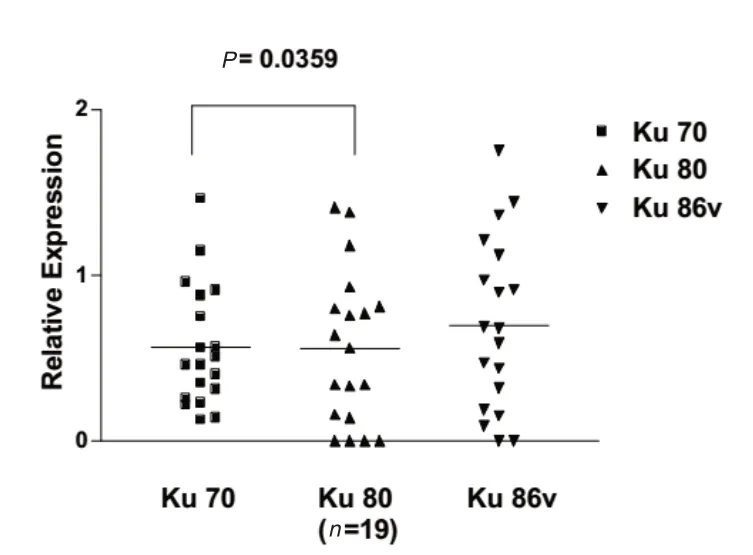
图5 AML白血病中Ku蛋白的相对表达

图6 ALL白血病中Ku蛋白的相对表达
3 讨论
白血病为恶性肿瘤中的一种,而肿瘤是密切相关的一系列基因突变引起的健康机体内细胞不能正常代谢,细胞的分化、生长和凋亡出现紊乱现象而导致的疾病。多基因紊乱性疾病是由于一系列的基因改变导致不能控制细胞生长、细胞分化、细胞凋亡的多基因紊乱性疾病。DNA修复机制和端粒结构维持机体基因组的稳定在抑制肿瘤的发生和发展方面起重要作用,在染色体结构中Ku蛋白扮演至关重要的作用,同样Ku蛋白也维持端粒结构的稳定性,因此,以往学者认为Ku蛋白可能是一个肿瘤的抑癌基因[9-10]。此外,由于Ku蛋白在DNA修复中起到核心作用,肿瘤细胞自身也具备修复、分化、增生能力,对治疗产生拮抗作用,增加治疗难点。肿瘤的发生和进展与DNA修复和端粒结构的稳定性方面存在密切关系,在维持染色体结构稳定中Ku蛋白起到关键性作用,故此研究者认为Ku蛋白可能为肿瘤抑制蛋白[11-12]。Ku蛋白质为多功能蛋白质,亦是多种基因家族的重要成员,近来有关于Ku蛋白质与DNA形成的复合物与细胞株、癌症相关性的报导,但是Ku蛋白与染色体、DNA等细胞结构的关系与急慢性白血病发病机制的关系还不清楚,通过调控Ku蛋白活性而控制急慢性白血病诊断和治疗,需进一步研究探索[13-14]。
研究显示这种多发性骨髓瘤中Ku蛋白降低了与DNA末端的结合能力,不能结合和激活DNA,该项目结果还发现Ku蛋白自身活性降低,对放射线、博来霉素、丝裂霉素的敏感性较正常Ku86的多发性骨髓瘤或正常骨髓细胞高[15]。大量研究专家和学者发现通过各种方法抑制Ku80蛋白和Ku70蛋白来增加肿瘤细胞敏感性,使肿瘤细胞放化疗的特异性和靶向基因治疗的效果得到提高[16]。Ku蛋白即为DNA修复蛋白,在修复DNA过程中发挥不可或缺的重要作用[17],Ku蛋白活性减弱和缺失不足都与肿瘤进展关系十分密切;另外,肿瘤对放化疗反应机制中肿瘤细胞Ku蛋白活性的改变具有重要意义[18]。本研究通过Western blotting分析Ku70,Ku80的表达,分析了AML和ALL的关联性。Ku70与Ku80在所有急性白血病患者,AML、ALL患者的表现情形及相关性,差异有统计学意义(P=0.001、0.036、0.046)。陈沛帅等[19]Western Blot印迹法检测Ku70、Ku80蛋白的表达,Ku70与Ku80在所有急性白血病患者,AML、ALL患者的表现情形及相关性,差异有统计学意义(P=0.002、0.001、0.001)。本研究结果与陈沛帅的研究结论具有一致性,以此证实为延缓慢性白血病的发生、维护染色体结构完整性、防治染色体损伤而提供科学依据,为防治阻止DNA突变提供切实可行的分子诊断手段;同时对扩展急慢性白血病的放化疗治疗方案,制订个体化治疗措施具有重要意义。最近几年,随着对白血病患病中Ku蛋白各种功能及其肿瘤作用机制的不断研究,有理由相信高效地抑制白血病细胞中Ku蛋白的活性,可为个体化抗白血病治疗的新靶点提供可靠证据。

