蛋白激酶C在瑞芬太尼诱发痛觉过敏大鼠脊髓背角中的表达及意义
刘 超 王 芳 李继峰 武 强 李志国 金黛丽 靳 菲
1 河南省鹤壁市人民医院麻醉科 458000; 2 济宁中西医结合医院呼吸消化内科
瑞芬太尼是一种短效的μ型阿片受体激动剂,在临床中应用广泛,尤其是急性、慢性疼痛的治疗及全身麻醉的维持[1]。瑞芬太尼痛觉过敏(Remifentanil-induced hyperalgesia,RIH)是指应用瑞芬太尼所导致的机体对伤害性刺激的反应增强现象,主要表现为痛阈降低、痛感增强或痛觉异常[2]。研究表明RIH的分子机制可能包括MOR表达水平的下调和功能改变、中枢N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)激活、脊髓胶质细胞的活化等多方面,但具体机制尚不明确[3-4]。蛋白激酶C(Protein kinase C,PKC)已被证实参与多种疼痛调节信号通路,在神经损伤后脊髓PKC表达水平显著增加,且抑制PKC表达后可抑制NMDA受体的磷酸化,延缓痛觉过敏的发生[5-6],但目前关于PKC在RIH中是否存在异常表达及是否参与RIH的发生尚不够明确。因此,本研究通过建立RIH切口痛模型并检测PKC在RIH大鼠脊髓背角中的表达情况,分析PKC表达与RIH发生可能的相关性,以期为瑞芬太尼诱导痛觉过敏的机制研究提供基础。
1 材料与方法
1.1 材料及试剂 30只6周龄SD雄性大鼠,体重(200±15)g,均购自河南省实验动物中心,动物检疫许可证号SYXK(豫)-2017-0001。注射用盐酸瑞芬太尼(宜昌人福药业有限责任公司,国药准字H20030198);PKC抑制剂Go6983(MedChemExpress公司);PKC兔抗大鼠多克隆一抗(武汉三鹰生物技术有限公司),兔抗大鼠NMDA受体NR1、NR2A及NR2B亚基一抗(美国Cell Signaling Technology公司)。
1.2 方法
1.2.1 动物分组与处理:将30只大鼠随机分为对照组、瑞芬太尼组(R组)、切口痛模型组(M组)、瑞芬太尼+切口痛模型组(RM组)和PKC抑制剂组(Inhibitor组),每组6只。所有大鼠均经七氟醚麻醉(3%诱导,1%保持)后,尾静脉置管,R组、RM组及PKC抑制剂组以1.0μg/(kg·min)的速度静脉输注瑞芬太尼,对照组及M组输注同体积的0.9%NaCl溶液;5min后对M组、RM组和PKC抑制剂组建立Brennan切口痛模型,PKC抑制剂组大鼠在切口造模完成后背部剃毛、皮肤消毒,在L4~5处穿刺将 Go6983(5μl)注射入脊髓鞘内。对照组和R组仅仰卧固定于手术台相同时间。
Brennan切口痛建模方法[7]:在无菌的环境下,建立SD大鼠左后足切口痛模型。其操作步骤如下:(1)取大鼠仰卧位,侧头固定于手术台上,充分暴露左后足并用碘伏消毒;(2)用已消毒的11号刀片从足跟0.5cm处纵向延伸切开足面皮肤,切口长度约1cm,切口深至浅层筋膜;(3)在保持肌肉起止完整、不伤及周围神经和血管的情况下,用眼科镊分离足骨膜与跖屈肌。术后继续输注瑞芬太尼(或0.9%NaCl),25min后停止输注并撤下尾静脉留置软管,同时消毒处理。在大鼠苏醒后置于室温、干燥、安静的环境中单只分笼饲养。
1.2.2 痛觉行为学检测:分别于建模前24h(T-1)以及造模后2h(T1)、6h(T2)、24h(T3)、48h(T4)测定大鼠的热刺激缩足潜伏期(Paw withdrawal thermal latency,PWL)和机械刺激缩足阈值(Paw withdrawal mechanical threshold,PWT),每次测定前大鼠置于测定环境中适应性活动10min。采用热刺痛仪(XR-YLS-22A,Xmaze)测定大鼠PWL,von Frey纤维丝(美国stoelting)测定PWT,测定间隔时间均为10min,测量3次取平均值。其中,PWL以秒(s)记录,PWT以克(g)记录。
PWL测定操作:基础温度设定为50°C,记录大鼠从左后足接触热板至出现缩足、垫脚、嘶叫、挣扎、舔舐等阳性反应的时间即为PWL,超过30s者计为30;PWT测定操作:将大鼠放置在悬空金属笼中,采用von Frey纤维丝垂直刺激左后足第2、3脚趾间,距切口约1cm,记录出现阳性反应时的刺激压力值,上限为60g。
1.2.3 Western Blot:行为学检测完成后,将大鼠立即乙醚麻醉,而后颈椎脱臼处死。迅速纵向剪开椎弓根,充分暴露脊髓组织,取左侧L4~6脊髓背角组织并保存于-80℃冰箱中。采用Western blot检测脊髓背角PKC的表达水平:将已解冻的脊髓背角组织置于培养皿中,加入细胞裂解液后磨成匀浆,12 000r/min离心10min,取上清;采用总蛋白提取试剂盒(Solarbio)提取总蛋白,BCA法测定蛋白浓度;而后经SDS-PAGE、转膜、封闭1h后,分别加入PKC(1∶2 000)、NR1、NR2A、NR2B(1∶1 000)一抗,4 ℃孵育过夜;次日PBS清洗3次后,加入二抗羊抗兔IgG,室温孵育2h;PBS清洗3次后进行ECL化学发光显影,用Image J计算灰度值比(以β-actin为内参)。
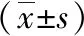
2 结果
2.1 痛觉行为学检测 痛觉行为学检测结果显示,建模前(T-1)各组PWL及PWT均无显著差异(P>0.05);T1~T4时,与对照组相比,其余各组的PWL和PWT均显著降低(P<0.05);与M组及R组相比,RM组和Inhibitor组PWL和PWT均显著降低(P<0.05);与RM组相比,Inhibitor组PWL和 PWT显著升高(P<0.05)。见表1。

表1 各组SD大鼠不同时间点的PWL及PWT比较
2.2 各组PKC的相对表达情况 Western Blot检测各组PKC的相对表达量结果显示,与对照组(0.65±0.04)相比,R组(1.36±0.08)、M组(1.52±0.10)和RM组(2.57±0.12)的PKC表达均显著升高,且RM组显著高于R组和M组(P<0.05);与RM组相比,Inhibitor组PKC表达(1.02±0.10)显著降低(P<0.05)。见图1。

图1 各组PKC蛋白表达情况
2.3 各组NMDA受体蛋白表达比较 Western Blot检测各组NMDA受体亚基的相对表达量,结果显示,与对照组相比,其余各组NR1、NR2B的表达水平及NR2A/NR2B比值均升高,且RM组和Inhibitor组显著高于R组和M组(P<0.05);与RM组相比,Inhibitor组NR1、NR2B表达及NR2A/NR2B比值均降低(P<0.05)。见图2和表2。

表2 各组脊髓背角总蛋白中NR1、NR2A、NR2B表达水平比较

图2 各组NMDA受体蛋白表达比较
3 讨论
疼痛是实际或潜在组织损伤所引起的不愉快感觉和情感体验,由于个体化差异每个人的痛觉敏感度不同。医学上的痛觉过敏是指病理性的疼痛反应过敏感,主要表现为机体对正常疼痛刺激的敏感性增加、疼痛忍耐阈值降低[8]。近年来,随着瑞芬太尼在临床的广泛应用,其引起的术后痛觉过敏现象被越来越多的医患和学者关注。据报道,与其他阿片类镇痛药物相比,瑞芬太尼引发痛觉过敏的发生率显著更高,达16%以上,且一般于术后24~48h的达到痛敏高峰,而后逐渐衰弱并趋于正常[9-11]。因此,本研究检测了各组大鼠术后2~48h的痛觉行为学指标,结果显示,与对照组相比,R组在不同时间点的 PWL和PWT均显著降低,RM组显著低于M组,且在术后48h时PWL和PWT达到最低,与现有研究结果基本一致。
而随着人类对痛觉敏感认知和手术质量要求的提高,RIH发生机制的研究被越来越多的学者关注,现有研究认为其可能涉及NMDA受体激活、离子通道、信号通路及细胞因子等多个方面,但仍缺乏具体和全面的机制研究结论[2,12]。PKC是重要的磷脂依赖性蛋白激酶,由多种同工酶组成,按其结构和功能可分为钙依赖型PKC(α、β1、β2、γ亚类)、钙不敏感型PKC(δ、ε、η、θ、μ亚类)和非典型PKC(λ、ζ亚类),其中,PKCγ是神经系统特有的亚型,主要分布于中枢神经系统中,在脊髓组织中,PKC仅表达于脊髓背角LaminaⅡ层内侧的中间神经元中[13]。据报道,PKC参与细胞凋亡、骨架蛋白重塑以及离子通道调节等多种生物学效应过程,并在中枢神经系统传导通路中充当第二信使的角色,通过调节离子通道和受体参与诱导和维持中枢痛觉敏感化过程,但其具体机制尚不清楚[14]。有文献报道PKC参与痛觉过敏过程,其作用机制可能是通过激活NMDA受体开启Ca2+通道,导致Ca2+内流聚集,激活PKC,活化后的PKC进一步作用于NMDA受体,使得Ca2+内流进一步加剧,形成反馈性恶性循环,导致伤害性感受信号持续传入和增加,即引发痛觉过敏[15]。研究表明,PKC在慢性坐骨神经压迫疼痛和炎性疼痛模型中表达上调,而PKC抑制剂可降低脊髓中星型胶质细胞的激活程度,缓解大鼠机械痛敏[16-17];Yuan Y等[18]的研究表明RIH大鼠脊髓背角中存在PKC异常高表达,而干扰NMDA-PKC-Ca2+/CaMKⅡ通路可预防瑞芬太尼诱导的痛觉过敏;于萍等[19]研究结果显示在RIH术后24h后,大鼠的PWL和PWT值显著降低,脊髓背角神经元中PKC表达显著上调,注射PKC抑制剂后可缓解大鼠痛觉过敏情况。本研究结果显示,术后48h时RM组PWL和PWT值达到最低,其脊髓背角中PKC的表达水平最高,显著高于M组和R组,提示PCK的表达水平与RIH大鼠痛觉过敏有关;而与RM组相比,PKC抑制剂组PWL和PWT值均升高,PKC表达也显著降低,提示抑制PKC的表达在一定程度上可以抑制痛觉过敏,与现有研究结论基本一致。痛觉过敏产生的机制之一是NMDA受体的激活和传递神经兴奋性神经递质,其可以通过调节Ca2+内流等促使痛觉信号的传递。NR1是NMDA受体的亚基之一,其磷酸化是NMDA受体激活的标志,目前研究多采用NR1表达水平及NR2A/NR2B比值来代表NMDA受体的激活程度和痛觉敏感度的评估标准。本研究同时检测了脊髓背角中NMDA受体的表达,结果显示,RM组NR1、NR2B的表达水平及NR2A/NR2B比值显著高于R组及M组,抑制剂组显著低于RM组,提示抑制PKC的表达可能通过抑制NMDA受体的激活来抑制痛觉过敏的发生。
综上所述,本研究表明PKC在RIH大鼠脊髓背角中高表达,可能参与RIH的发生过程。抑制PKC的表达可能通过抑制NMDA受体的激活从而抑制痛觉过敏的发生。本研究为瑞芬太尼诱导痛觉过敏的机制研究和靶向治疗提供了新的思路。

