儿童主动脉瓣二叶畸形的超声心动图特征分析
杨 娇 孙 妍 张红菊 李静雅 刘国文 马 宁
主动脉瓣二叶畸形(bicuspid aortic valve,BAV)是最常见的先天性心脏病,其发病率约0.5%~2.0%,男女比例约3∶1[1]。大多BAV患者因出现并发症确诊或因合并其他先天性心脏病行超声心动图检查时被偶然发现。有研究[2-3]表明BAV患者发生主动脉瘤及主动脉夹层的风险增加8~9倍,约50%的BAV患者最终需要接受手术治疗。但临床及超声医师对BAV的认识存在很大差异[4],目前关于BAV的研究主要集中在成人,关于儿童BAV的研究报道较少,且评价BAV对成人尤其是老年患者心脏及主动脉结构和功能影响的混杂因素较多,难以区分是退行性变还是BAV引起的改变。本研究通过回顾性分析我院儿童BAV患者的临床及超声心动图资料,总结分析其超声心动图特征及其对心脏和主动脉的影响,旨在提高对儿童BAV的认识。
资料与方法
一、临床资料
回顾性分析2015年1月至2017年12月我院收治的143例BAV患儿的临床资料,其中男105例,女38例,年龄2 d~16岁11个月,中位年龄3.17岁。入选标准:①均于我院接受经胸超声心动图检查并确诊为BAV;②图像清晰,能够清楚显示主动脉瓣情况。排除标准:①合并马凡综合征、大动脉炎等累及主动脉瓣及主动脉的疾病;②图像质量差,不能清晰显示主动脉瓣瓣叶结构。本研究经我院医学伦理委员会批准,入选者监护人均知情同意。
二、仪器与方法
1.超声心动图检查:使用Philips iE 33、iE Elite彩色多普勒超声诊断仪,S8-3及S5-1探头,频率3.5~7.5 MHz。患儿取仰卧位,于平静状态下按照美国超声心动图学会推荐的规范化指南[5]进行详细的经胸超声心动图检查,观测主动脉瓣瓣叶形态、主动脉瓣功能损害的类型(主动脉瓣狭窄、关闭不全、狭窄合并关闭不全)、主动脉窦部及升主动脉内径,以及有无合并其他心血管畸形。于标准胸骨旁左室长轴切面将取样线分别置于垂直于左房前后壁水平及二尖瓣瓣下腱索水平,获得左房及左室M型超声图像,测量左房前后径、室间隔厚度、左室舒张末期内径、左室收缩末期内径、左室后壁厚度,仪器自动计算左室射血分数、左室短轴缩短率、左室心肌质量及左室心肌质量指数,所有参数均测量3次取平均值。
2.BAV分型标准:按照Sievers等[6]提出的BAV分类方法,根据瓣叶融合产生的融合嵴数量分为3种类型,即Type 0型(无融合嵴)、Type 1型(1个融合嵴)、Type 2型(2个融合嵴)。其中Type 0型根据瓣叶的空间位置关系分为ap型(前后型)和lat型(左右型);Type 1型根据融合嵴的空间位置分为R-L型(融合嵴位于左、右冠瓣之间)、R-N型(融合嵴位于右冠瓣与无冠瓣之间)和N-L型(融合嵴位于左冠瓣与无冠瓣之间);Type 2型定义为R-L/R-N型(2个融合嵴分别位于左冠瓣、右冠瓣与无冠瓣之间)。
3.并发症判断标准[7-11]:应用二维及多普勒超声心动图评估主动脉瓣受损情况及主动脉窦部、升主动脉受累情况。①主动脉瓣狭窄(AS)。根据频谱多普勒测得的主动脉瓣正向最大血流速度及跨瓣压差进行分级:轻度,峰值流速(Vmax)为2.0~2.9 m/s,平均跨瓣压差<20 mm Hg(1 mm Hg=0.133 kPa);中度,Vmax为3.0~3.9 m/s,平均跨瓣压差为20~39 mm Hg;重度,Vmax≥4.0 m/s,平均跨瓣压差≥40 mm Hg;极重度,Vmax≥5.0 m/s,平均跨瓣压差≥60 mm Hg。②主动脉瓣反流(AR)。参考美国及欧洲超声心动图学会推荐的超声心动图评估瓣膜反流的方法,对AR进行定性及定量评估。③主动脉受累。根据体表面积的回归方程计算主动脉窦部及升主动脉Z值:Z值2~3为增宽,Z值>3为扩张[2,10];根据主动脉根部及升主动脉内径情况分为3型[2]:Ⅰ型为窦部扩张;Ⅱ型为升主动脉扩张;Ⅲ型为联合扩张,即窦部、窦管交界及升主动脉均扩张。
4.一般资料收集:通过查阅患儿门诊及住院病例收集性别、年龄、体表面积等一般临床资料。比较单纯BAV患儿中有并发症者与无并发症者临床资料和超声心动图参数的差异。
三、统计学处理
结 果
一、BAV分型情况
本研究共纳入143例BAV患儿,其分型情况见表1。其中最多见的类型为Type 1,L-R型(74例),其次为Type 0,lat型(32例)。见图1,2。
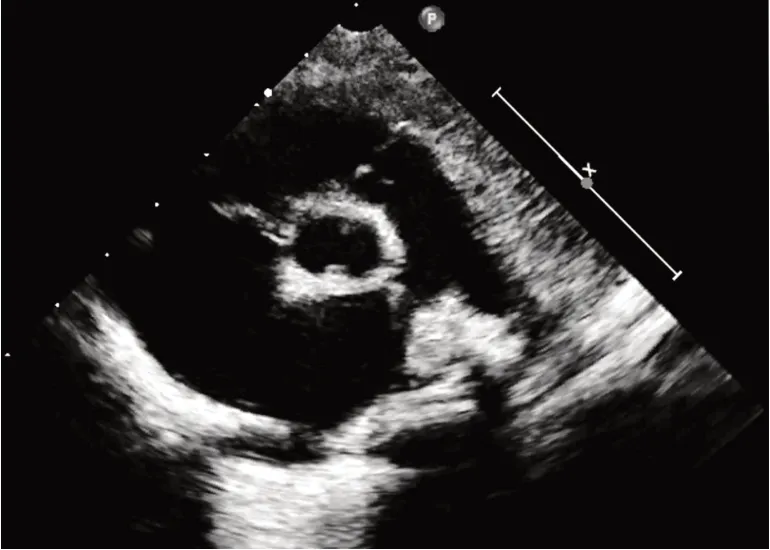
图1 Type0,lat型BAV超声图像

表1 BAV分型情况
二、BAV及其并发症情况
1.BAV合并其他先天性心血管畸形:143例BAV患儿中,合并其他先天性心血管畸形64例(44.8%),其中合并主动脉弓部异常及复合畸形21例,室间隔缺损20例,动脉导管未闭11例,房间隔缺损5例,Williams综合征和Shone综合征各3例,肺动脉瓣狭窄1例。3例合并Williams综合征患儿均表现为主动脉瓣上(窦管交界处)狭窄,肺动脉瓣上和或肺动脉分支狭窄,狭窄程度从轻度到重度不等。
2.单纯BAV:79例单纯BAV患儿中,50例出现并发症,其中38例为瓣膜损害,多以轻度为主;12例为主动脉受累,主要表现为主动脉内径增宽。见表2,3。
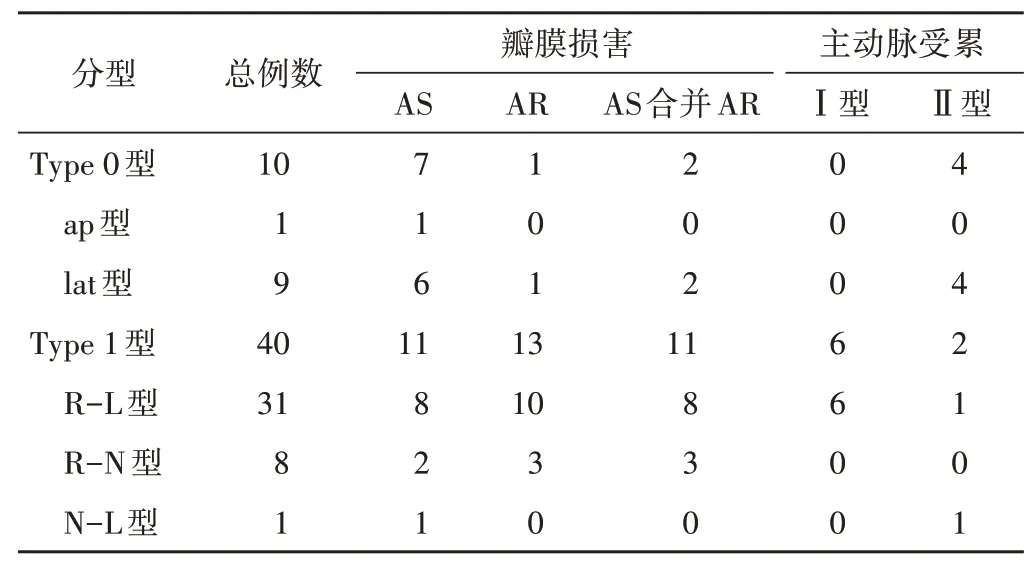
表2 不同类型单纯BAV患儿的并发症分布情况 例
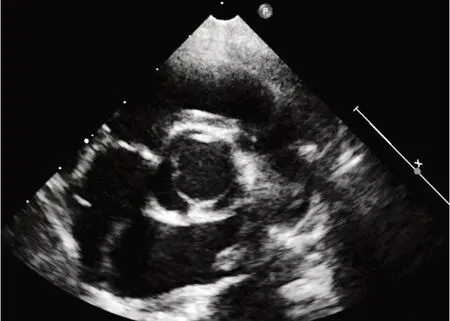
图2 Type 1,R-N型BAV超声图像
3.单纯BAV患儿有并发症者临床资料及超声心动图参数比较:单纯BAV患儿中,有并发症者与无并发症者在性别比、左室收缩末期内径、左室射血分数及左室短轴缩短率比较,差异均无统计学意义;在年龄、体表面积、左房前后径、室间隔厚度、左室舒张末期内径、左室后壁厚度、左室心肌质量及左室心肌质量指数比较,差异均有统计学意义(均P<0.05)。见表4。
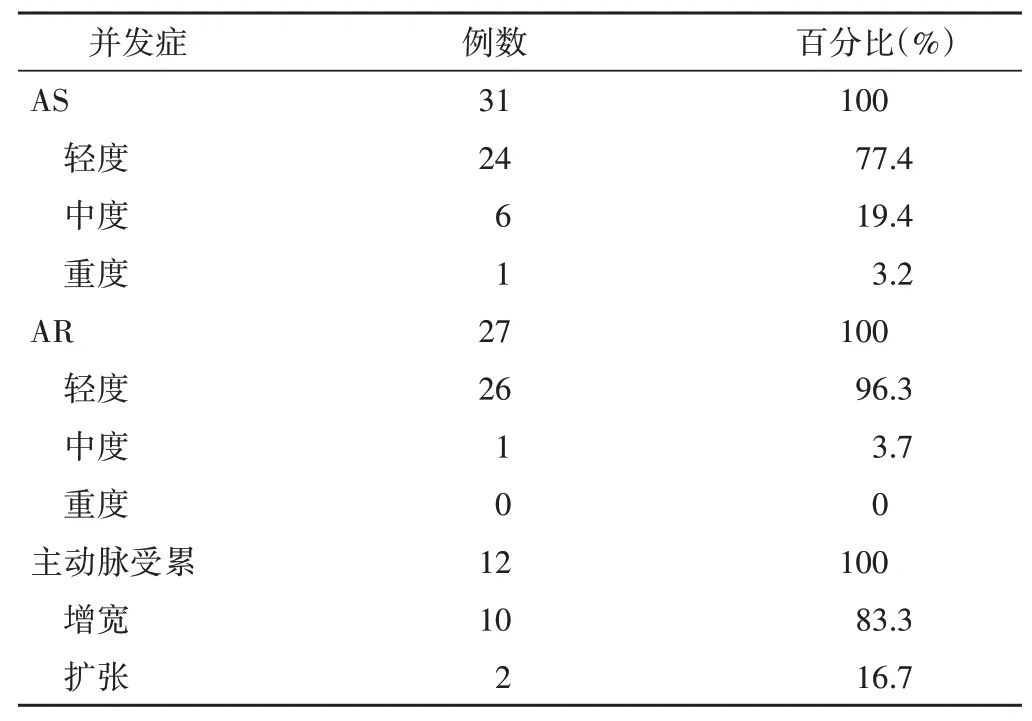
表3 单纯BAV患儿的并发症严重程度分布
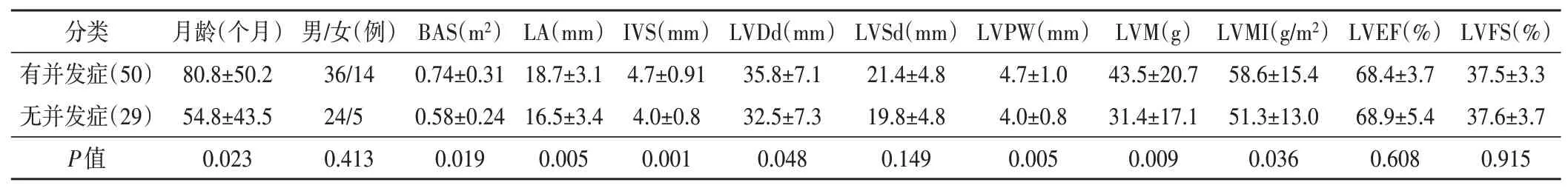
表4 单纯BAV患儿有并发症者与无并发症者临床资料及超声心动图参数比较
讨 论
BAV是最常见的先天性心脏病,是由于胚胎发育过程中动脉干的内膜隆起发育不良,导致瓣膜发育异常,进而引起的瓣膜先天性畸形。BAV分型的方法多种[6],主要根据有无融合嵴、融合瓣叶的大小及瓣膜的空间位置信息等进行分型。本研究按照Sievers等[6]提出的BAV分类方法进行分型,结果显示儿童BAV以Type 1,R-L型最多见,与Sievers等[6]的术中病理分型研究结果一致。
BAV成人患者多因出现瓣膜狭窄或关闭不全、主动脉瘤、感染性心内膜炎等并发症时检查发现[2],BAV儿童患者则多因其他先天性心血管畸形或体检听诊发现杂音从而发现主动脉瓣病变。本研究中约44.8%患儿合并其他先天性心血管畸形,其中以主动脉弓部异常及复合畸形(包括主动脉弓缩窄、主动脉弓离断、主动脉弓发育不良合并或不合并动脉导管未闭、室间隔缺损)最多见,其次为室间隔缺损和动脉导管未闭。这与国内外研究[12-13]认为BAV易合并主动脉发育异常的结论一致。分析原因可能与主动脉瓣、主动脉胚胎发育及血流动力学变化有关:①主动脉瓣及主动脉均由心球和动脉干内出现心内膜下的组织增厚而形成,这种胚胎发育的同源性可以解释主动脉缩窄易合并主动脉瓣畸形,BAV易合并主动脉弓缩窄的原因;②胎儿期BAV可以引起左室流出道血流受阻,使左心压力增高,卵圆孔右向左分流减少,一方面致左心血流量减少,使流入主动脉内的血流减少,另一方面致右心血量增加,流入肺动脉内血流量增加,从而使通过动脉导管向主动脉内分流的血量增加,增加了对主动脉后壁的冲击,最终导致主动脉弓缩窄。因此,当超声心动图检查发现BAV时应仔细探查主动脉弓降部,同理,当发现主动脉弓缩窄时也应仔细探查主动脉瓣膜情况。
BAV患者容易出现瓣膜损害,且出现瓣膜损害的时间较早,由于病情进展较快,患者行手术治疗时间通常需提前10年左右[14]。主动脉瓣功能损害的类型与BAV分型密切相关,但国内外不同研究结果并不一致。Sievers等[6]发现AS患者主要为Type 1,R-L型BAV;但Kang等[15]研究表明Type 1,R-N型和Type 1,N-L型BAV患者更易出现AS,而Type 1,R-L型BAV患者易出现主动脉瓣关闭不全;我国阜外医院一项研究[14]结果与Kang等[15]研究结果一致。本研究中Type 1型BAV患儿更易出现瓣膜损害,主要表现为AR,以R-L型为主;而Type 0型BAV患儿更易出现AS,且其功能损害以轻度为主。BAV除能够导致主动脉瓣损害外,还可引起主动脉扩张。研究[1-2]报道BAV患者主动脉夹层的发病率是正常人群的8~9倍,近50%的BAV患者伴有主动脉扩张,故BAV不是单纯的瓣膜病变,而是一种瓣膜-主动脉复合病变,且主动脉形态学改变与BAV分型有一定的相关性。本研究中Type 1,R-L型BAV患儿主动脉易出现Ⅰ型扩张,而Type 0,lat型BAV患儿易出现Ⅱ型扩张,与以往研究[14-15]结果一致,表明不同BAV分型合并的升主动脉扩张类型不同,可能与BAV患者主动脉管壁的组织结构及其引起主动脉内血流动力学改变有关。研究[15]发现eNOS基因、ACTA2基因、基质金属蛋白酶等均会引起BAV患者主动脉壁组织结构发生改变。心脏MRI的相关研究[16]亦显示不同BAV分型患者的主动脉瓣跨瓣血流速度及血流角度存在差异。这两方面的原因可能导致升主动脉不同部位的扩张。
本研究单纯BAV患儿中,虽然有并发症者与无并发症者的左室射血分数及左室短轴缩短率等反映左室收缩功能的参数比较差异均无统计学意义,但有并发症者的左室心肌质量指数较无并发症者增加,提示该类患儿已经出现左室心肌重构。因此,儿童BAV行超声心动图检查时除需注意瓣膜功能情况及主动脉有无扩张之外,还应注意左室心肌情况,为临床制定治疗方案提供更多的超声参数。
综上所述,儿童BAV可以合并其他心血管畸形,其中以主动脉弓部异常及复合畸形最常见。未合并其他先天性心脏病的BAV患者在儿童期即可出现并发症及心肌重构,表现为轻度的瓣膜功能损害、主动脉扩张及左室心肌质量指数增加。

