低强度脉冲超声联合脂肪间充质干细胞源性外泌体促进内皮细胞血管生成的实验研究
刘珺碧 蒋日月 王 浩 邓 倾 周 青
脂肪间充质干细胞(adipose mesenchymal stem cells,ADSCs)源性外泌体(ADSCs derived exosomes,ADSCs-Exos)富含蛋白质、信使RNA和微小RNA(miRNA)等细胞特异性分子,介导细胞间通讯,在再生医学领域具有重要价值。然而其提取过程繁琐,产量低,导致促进血管生成的效果不理想。低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)可在显著降低热效应对机体伤害的同时,将机械刺激信号传导至生物体内转变为生物学信号,发挥多种生物学效应。既往研究[1]证实LIPUS治疗可促进缺血心肌的血管生成,减轻心肌组织纤维化程度。基于此,本实验拟使用LIPUS联合ADSCs-Exos作用于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),观察二者联合对血管生成能力的影响,进而为缺血性疾病的治疗提供研究基础。
材料与方法
一、实验动物及主要实验材料、仪器
1.实验动物:SPF级SD雄性大鼠10只,体质量234~256 g,由武汉大学人民医院动物实验中心提供,伦理批准文号:WDRM动(福)第20210210号。
2.主要实验材料:HUVECs、胎牛血清(FBS,美国Sciencell公司);DMEM低糖培养基(美国Hyclone公司);CD29-PE、CD34-PE、CD45-PE、CD90-PE直标抗体(美国eBioscience公司);CD9、Tsg101、GAPDH、Calnexin单克隆抗体(美国Proteintech公司);CCK-8试剂盒(日本同仁公司);Matrixgel基质胶(美国BD公司);血管生成载玻片(81506,德国ibidi公司)。
3.主要实验仪器:流式细胞仪(FASCCalibur,美国BD公司);聚丙烯酰胺(SDS-PAGE)电泳槽(MINI,美国BIO-RAD公司);透射电子显微镜(HT7700,日本日立公司);纳米颗粒跟踪分析仪(Zeta View PMX 110,德国Particle Metrix公司);倒置显微镜(IX51,日本Olympus公司);超速低温离心机(Coulter XPN-100,美国Beckman公司);酶联免疫检测仪(EnSight,美国Perkin Elmer公司);多通道超声辐照仪(RS232,重庆医科大学超声影像学研究所)。
二、实验方法
1.ADSCs的培养、分离及鉴定:无菌条件下取SD大鼠双侧腹股沟脂肪,PBS漂洗、剪碎,加入适量0.1%Ⅰ型胶原酶在37℃下消化40 min,然后加入等量含有10%FBS的DMEM低糖培养基中和胶原酶,1300r/min离心10min,再加入DMEM低糖培养基重悬细胞,以105个/cm2的密度接种于培养瓶中,放置于培养箱中培养,每3 d换液一次,至贴壁细胞长满瓶底后消化,传代接种。取第3~6代ADSCs,使用倒置显微镜观察细胞形态,流式细胞仪检测细胞表面蛋白CD29、CD34、CD45、CD90。
2.ADSCs-Exos的提取及鉴定:取第3代ADSCs进行常规培养,待细胞生长汇合达80%左右时更换为无血清的DMEM低糖培养基培养2 d,收集上清液,利用超速离心法提取ADSCs-Exos,并用PBS重悬沉淀后,于-80℃冻存备用。取ADSCs-Exos混悬液滴加于载样铜网上,室温静置1 min,用滤纸轻轻吸去铜网边缘残余液体,滴加磷钨酸进行负染,使用透射电子显微镜观察ADSCs-Exos形态。将ADSCs-Exos用适量PBS稀释,使用纳米颗粒跟踪分析仪检测其粒径。取适量ADSCs-Exos,用细胞裂解液裂解后,通过SDS-PAGE凝胶电泳检测标志性蛋白CD9和Tsg101的表达。
3.LIPUS辐照:使用多通道超声辐照仪,参照既往研究[2]设置辐照参数,即超声频率1.5 MHz,输出声强0.1 W/cm²,调制频率1.0 kHz,占空比20%,辐照时间40 min。辐照时将超声探头用铁架台固定,置于细胞培养板下方,仔细涂抹耦合剂使探头与板充分接触,保证探头面积充分覆盖细胞培养板面积。
4.CCK-8实验检测HUVECs增殖能力:取对数生长期HUVECs,根据处理方法不同将其分为对照组、LIPUS组、外泌体组及LIPUS+外泌体组。其中外泌体组和LIPUS+外泌体组加入10μl浓度为100μg/ml ADSCs-Exos后分别进行假辐照和辐照处理;LIPUS组和对照组均加入等量PBS后分别进行辐照和假辐照处理,各组HUVECs培养24 h后,以每孔5000个的密度接种于96孔板,待细胞贴壁后吸出旧培养液,加入10%的CCK-8培养液110μl,培养箱内孵育4 h后,使用酶联免疫检测仪对HUVECs在波长450 nm处的吸光度值(OD值)进行检测。
5.细胞划痕实验检测HUVECs迁移能力:取对数生长期HUVECs,以每孔5×105个的密度接种于6孔板,待细胞完全贴壁后弃取旧培养液,更换为无FBS的培养液饥饿过夜后,用200μl移液枪进行划痕,PBS洗涤脱落细胞后,按CCK-8实验分组方法将细胞分为4组分别进行处理,细胞培养箱中继续培养24 h后于倒置显微镜下拍照,应用Image J软件测量划痕面积,计算HUVECs的迁移率,公式为:迁移率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%[3]。
6.小管形成实验检测HUVECs成管能力:取对数生长期HUVECs,接种于3.5 cm²培养皿上,待细胞贴壁后吸出旧培养液,更换为无FBS的培养液继续培养过夜,按CCK-8实验分组方法将细胞分为4组分别进行处理,将细胞消化接种于血管生成载玻片上,培养4~8 h后于倒置显微镜下拍照,应用Image J软件测量管腔周长并进行统计分析。
三、统计学处理
结 果
一、ADSCs和ADSCs-Exos的特征
倒置显微镜下见ADSCs形态呈梭形(图1);流式细胞仪测得ADSCs细胞表面蛋白CD34和CD45为阴性,CD29、CD90为阳性。透射电子显微镜下见ADSCs-Exos呈双层膜结构的茶托样囊泡;纳米颗粒跟踪分析仪测得粒径97.8%集中在(118.8±80.8)nm;蛋白免疫印迹法测得ADSCs-Exos表达标志性蛋白CD9、Tsg101。见图2。

图1 倒置显微镜下观察第3代ADSCs形态(×100)

图2 ADSCs-Exos的形态、粒径及标志性蛋白表达检测
二、各组HUVECs增殖能力比较
CCK-8实验显示,外泌体组、LIPUS组及LIPUS+外泌体组OD值分别为0.646±0.034、0.631±0.027及1.882±0.138,均高于对照组0.462±0.036,差异均有统计学意义(均P<0.05);其中LIPUS+外泌体组OD值最高,与其余各组比较,差异均有统计学意义(均P<0.05)。
三、各组HUVECs迁移能力比较
细胞划痕实验显示,0 h时各组划痕面积基本保持一致;24 h时外泌体组、LIPUS组及LIPUS+外泌体组细胞迁移率分别为(43.0±5.1)%、(34.7±2.3)%、(87.7±4.5)%,均高于对照组(25.1±2.0)%,差异均有统计学意义(均P<0.05);其中LIPUS+外泌体组细胞迁移率最高,与其余各组比较,差异均有统计学意义(均P<0.05)。见图3。

图3 细胞划痕实验检测各组不同时间细胞迁移能力
四、各组HUVECs成管能力比较
小管形成实验显示,对照组形成管腔的能力有限,外泌体组、LIPSU组及LIPUS+外泌体组形成管腔的数量明显增多,且管腔周长也变大,与对照组比较差异均有统计学意义(均P<0.05);其中LIPUS+外泌体组形成管腔数量最多,管腔周长最大,结构更复杂,与外泌体组、LIPUS组比较差异均有统计学意义(均P<0.05)。见表1和图4。
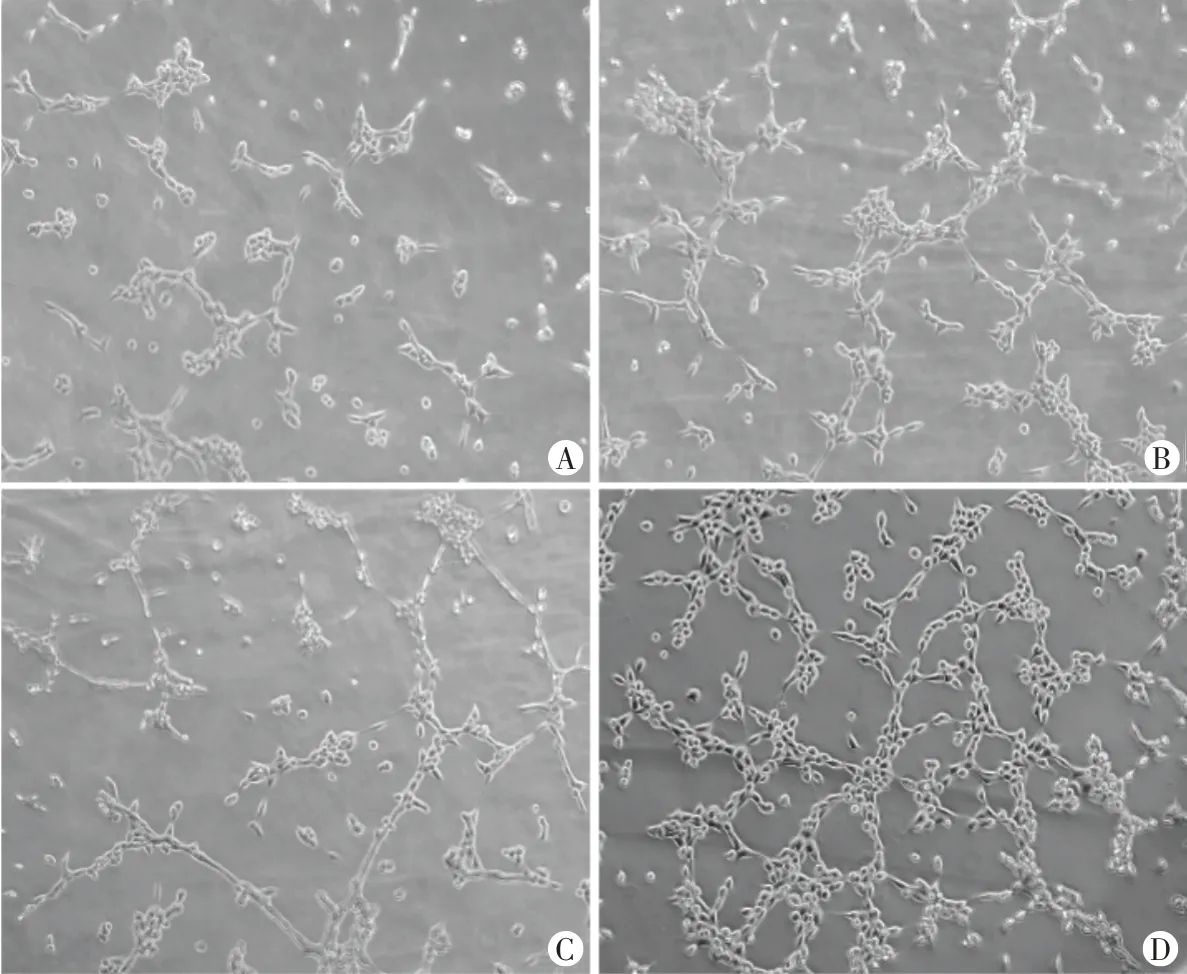
图4 小管形成实验检测各组细胞成管能力
表1 各组HUVECs成管能力比较(±s)
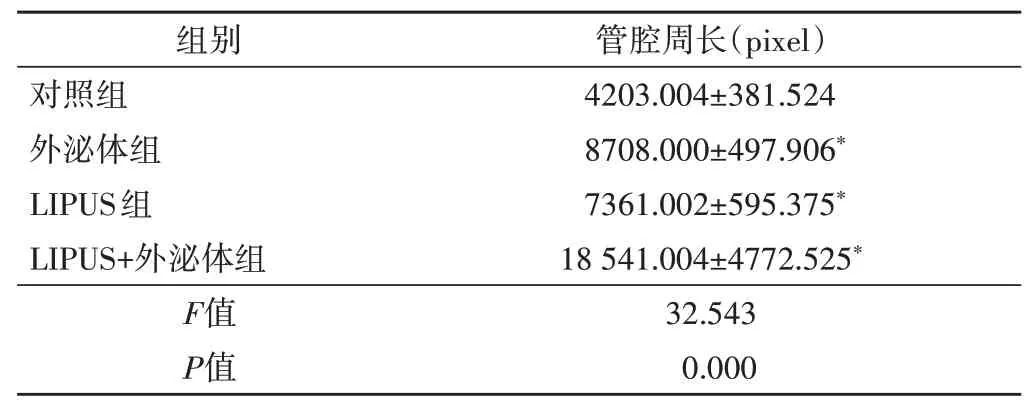
表1 各组HUVECs成管能力比较(±s)
与对照组比较,*P<0.05
?
讨 论
间充质干细胞介导治疗性血管生成是目前缺血性疾病治疗领域的研究热点,研究者对其改善组织血供、促进器官功能恢复的潜能寄予厚望[4]。然而动物实验及临床实践均显示间充质干细胞移植后存活率低下,促血管生成的疗效不显著,极大地限制了其在临床的应用[5]。近期研究[6-8]发现干细胞的治疗效应主要通过旁分泌效应介导,而外泌体正是干细胞旁分泌效应的关键功能物质,其是一种单层膜结构的细胞外小囊泡,直径约30~150 nm。ADSCs-Exos的治疗效应与干细胞相当,且避免了干细胞植入机体后存活率低及免疫相关的问题,有望为治疗性血管生成提供一条“非细胞治疗”的新途径。虽然ADSCs-Exos展示了较好的促血管生成潜力,但提取过程繁琐,产量较低,成本高昂。而LIPUS治疗可促进缺血心肌的血管生成,减轻心肌组织纤维化程度。因此本实验引入LIPUS作为提高ADSCs-Exos疗效的一种辅助方法,旨在寻求促进血管新生的有效方法。
ADSCs较骨髓间充质干细胞具有更高的增殖分化能力,其分泌的外泌体可能更高效。此外,自体干细胞来源的外泌体可有效避免体内实验过程中发生免疫相关的问题。基于此,本实验从大鼠腹股沟区提取ADSCs,通过体外培养后,成功提取ADSCs-Exos。本实验结果显示,与对照组比较,外泌体组HUVECs的增殖、迁移能力均明显提高,成管能力提高2倍左右,差异均有统计学意义(均P<0.01),说明ADSCs-Exos可增强内皮细胞的血管生成。目前,干细胞源性外泌体促血管生成的机制尚不十分明确,大多研究[9-11]认为与干细胞来源的外泌体内富含多种促血管生成的生物活性物质相关,如miRNA-21、miRNA-210、miRNA-132等,可促进下游通路中血管内皮细胞生长因子(VEGF)、基质衍生因子、血小板衍生生长因子等蛋白质的表达,从而促进血管生成。ADSCs-Exos通过膜融合的方式将上述生物活性物质带入HUVECs的细胞质内,在一定程度上促进了细胞增殖、迁移及成管的能力。
LIPUS作为一种强度较低的机械能,可以在保持声能向靶组织传递的同时,尽可能地降低热效应对机体的损害。既往研究[12]显示,LIPUS能够增加细胞内一氧化氮(NO)合酶活性,通过提高NO水平,上调VEGF基因的表达,从而达到生成血管的目的。亦有研究[13]认为这种积极作用是LIPUS通过激活促使血管生成的PI3K/Akt关键信号通路所实现。本实验结果也显示,输出声强为0.1 W/cm²、辐照时间为40 min的LIPUS辐照对于促进血管生成有一定的积极作用,可将HUVECs的成管能力提高1.8倍。基于LIPUS和ADSCs-Exos的生物学效应,本实验将二者联合应用,发现其促血管生成的能力有了显著提高,且高于单独ADSCs-Exos和LIPUS的生物效应之和。初步推测原因为LIPUS联合ADSCs-Exos应用后可能存在协同作用机制,从而实现促血管生成效应。LIPUS可通过增加HUVECs内NO合酶的活性,提高NO水平,而NO作为VEGF基因启动子的激活剂,可增强外泌体中VEGF的功能表达,从而促进血管内皮细胞增殖和迁移。此外,研究[14]证实LIPUS作用于细胞时所产生的空化效应可促使细胞膜表面出现可逆性小孔,从而使细胞膜的通透性增强,LIPUS在细胞周围形成的微激流也可以增加外泌体与细胞的接触,这些均有利于HUVECs摄入更多外泌体,从而进一步提高血管生成的能力。
本实验的局限性:作为体外实验,未考虑外泌体输入生物体后可能会诱导其他器官血管生成的问题,后期本课题组将进行动物实验,探索一种能将外泌体靶向递送至缺血器官的方法。
综上所述,本实验通过体外模拟血管生成的过程,发现单独使用LIPUS或ADSCs-Exos均可一定程度增强血管内皮细胞的增殖、迁移及成管能力,二者联合应用可显著提高血管生成的能力,有望为缺血性疾病的治疗提供一种新思路。

