鲢鱼骨蛋白水解物对肌原纤维蛋白凝胶特性的影响
王鹏,穆雅慧,何思宁,王璐,归艳,马松艳,郭丽
(绥化学院食品与制药工程学院,黑龙江 绥化 152061)
鲢鱼(Hypophthalmichthys molitrix)是我国淡水养殖的主要鱼类之一,2018年养殖产量为385.864万t,占淡水鱼养殖量的15.17%[1]。鲢鱼价格低、肉质鲜嫩,是生产鱼糜等加工制品的常用蛋白质资源。但与传统的海水鱼类相比,淡水鱼凝胶形成能力弱,同时在鱼糜制品生产过程中易发生蛋白质氧化,因此需要添加外源物质减少蛋白质氧化降解,增强其凝胶品质[2-3]。
有研究发现,骨蛋白水解物能够抑制鲤鱼鱼糜的蛋白和脂肪氧化变性,浓度越高效果越明显[4]。酶法制备的具有抗氧化活性的鱼糜加工副产物水解物,可明显改善鱼糜产品凝胶性质和保水能力[5]。试验利用中性蛋白酶制备鱼骨蛋白水解物,研究鱼骨蛋白水解物对鲢鱼肌原纤维蛋白凝胶性质及抗氧化活性的影响,以期为鱼糜制品的工业应用提供理论参考。
1 材料与方法
1.1 材料与仪器
鲜活鲢鱼,购于大润发超市;中性蛋白酶(60 000 U/g),北京奥博星生物技术责任有限公司提供;8-苯氨基-1-萘磺酸铵盐(ANS),深圳市美凯特科技有限公司提供;1,1-二苯基-2-三硝基苯肼(DPPH),南京奥多福尼生物科技有限公司提供;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),北京酷尔化学科技有限公司提供;乙二胺四乙酸(EDTA),天津中和盛泰化工有限公司提供;十二烷基硫酸钠(SDS),天津市大茂化学试剂厂提供;5,5-二硫代二硝基苯甲酸盐(DNTB),阿拉丁控股集团有限公司提供。
JJ-2B型组织捣碎机,江苏省金坛市荣华仪器制造有限公司产品;CR-400型色差仪,日本柯尼卡美能达公司产品;GL-16G-II型高速冷冻离心机,上海市安亭科学仪器厂产品;TA-XT.puls型质构仪,英国Stable Micro System公司产品;Hitachi S-3400N型扫描电子显微镜,日本日立公司产品。
1.2 试验方法
1.2.1 鱼骨蛋白水解物的制备
参考张宝林[6]的方法制备鲢鱼骨蛋白水解物,并略作修改。将鲢鱼骨洗净,在50℃水中蒸煮1~2 h,以除去鱼骨上的残肉,将鱼骨剪成1~2 cm的小段,采用正丁醇除去鱼骨中油脂,将脱脂后鱼骨用水清洗3次,再用0.6 mol/L的盐酸为溶剂,料液比为1∶9,进行超声脱钙处理,脱钙时间为60 min,功率为504 W。脱钙后吸去鱼骨表面的水分,称重记录质量,用组织捣碎机将鱼骨绞碎。以0.02 mol/L磷酸缓冲溶液为溶剂,用中性蛋白酶进行水解。提取条件为pH值7.0,酶底比600 U/g,酶解时间6 h,酶解温度50~55℃,料液比为1∶20。酶解完成后用沸水灭酶10 min,以转速4 000 r/min离心15 min,上清液即为水解液。然后将所得水解液冷冻、干燥,并在4℃下储存使用。
1.2.2 鲢鱼肌原纤维蛋白的制备
将新鲜鲢鱼除去内脏、皮、头和尾部,取靠近背部的肉150 g,放入组织捣碎机捣碎,加入5倍体积pH值7.5的0.02 mol/L磷酸盐缓冲溶液搅拌均匀,肌肉匀浆液在4℃条件下以转速4 300 r/min离心15 min后,弃去上清液,取出沉淀,在相同条件下用上述5倍体积磷酸盐缓冲溶液洗涤所得沉淀2次,所得沉淀用5倍体积0.1 mol/L的NaCl溶液在相同的条件下洗涤2次,最后一次离心前抽滤,除去匀浆液中的结缔组织,抽滤结束后在4℃条件下以转速4 300 r/min离心15 min,得到的沉淀即为肌原纤维蛋白[7]。
1.2.3 鱼骨蛋白水解物-肌原纤维蛋白悬浮液制备
取肌原纤维蛋白,加入内含0.6 mol/L NaCl的pH值6.5的0.02 mol/L磷酸盐缓冲液溶解,配制蛋白质最终质量浓度为40 mg/mL的肌原纤维蛋白悬浮液。再向肌原纤维蛋白悬浮液中分别加入1%,2%,4%,6%,8%的鱼骨蛋白水解物(W/肌原纤维蛋白湿重),未添加鱼骨蛋白水解物为对照,在4℃下静置稳定12 h。
1.2.4 凝胶制备
肌原纤维蛋白凝胶制备方法采用二次加热法[7]。将得到肌原纤维蛋白添加不同浓度鱼骨蛋白水解物,在40℃水浴条件下加热30 min后,再放入90℃水浴下加热20 min,加热完毕后在冰水中冷却,最后将得到凝胶放入4℃条件下平衡24 h。
1.3 测定方法
1.3.1 肌原纤维蛋白含量的测定
向试管中分别加入质量浓度为10 mg/mL的牛血清白蛋白标准溶液0,0.1,0.2,0.3,0.4,0.5 mL,再用水补足至1 mL,加入4 mL双缩脲试剂,摇匀后室温放置30 min,于波长540 nm处测定吸光度。未加牛血清白蛋白溶液做空白对照,以蛋白质含量为横坐标,得到的吸光度为纵坐标做标准曲线。准确量取肌原纤维蛋白稀释液1 mL加双缩脲试剂4 mL,室温反应30 min后,于波长540 nm处测定吸光度,根据标准曲线计算出蛋白含量[8]。得到的标准曲线为:Y=0.260 3X+0.001 1,R2=0.999 8。
1.3.2 肌原纤维蛋白总巯基和活性巯基的测定
参照吴满刚[9]方法,取3 mL肌原纤维蛋白稀释液于比色管中,加入pH值7.0的0.1 mol/L磷酸盐缓冲溶液3 mL(内含1 mmol/L EDTA、8 mol/L尿素、1% SDS),再加入1%的DNTB溶液0.1 mL,以不加DNTB为空白,剧烈振荡摇匀后,在25℃水浴中放置1 h,然后以转速3 000 r/min离心15 min。然后于波长412 nm处测上清液的吸光度,计算总巯基的含量。测活性巯基含量时用的是pH值7.0的磷酸盐缓冲溶液(内含1 mmol/L EDTA、1% SDS),其他步骤同上,计算活性巯基的含量。
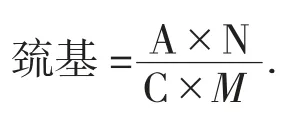
式中:A——吸光度;
N——稀释倍数;
C——分子吸光系数13 600 M-1cm-1;
M——肌原纤维蛋白含量,mg/mL。
1.3.3 表面疏水性的测定
配制成pH值7.0的0.1 mol/L磷酸缓冲液(PBS),再称取0.120 g ANS,用pH值7.0的0.1 mol/L PBS溶解并定容至50 mL。取4 mL蛋白液加入20 μL预先配置的ANS溶液,振荡混匀。使用荧光分光光度计测定样品荧光强度,激发波长374 nm,发射波长485 nm。以蛋白浓度为横坐标,荧光强度为纵坐标作图,计算线性回归方程曲线斜率,肌原纤维蛋白表面疏水性用SoANS表示[10]。
1.3.4 白度的测定
用手握住色差仪,将色差仪垂直放置于凝胶表面,测定完毕后,记录好数据并用擦镜纸擦干色差仪的镜头表面,每次放置力度保持均匀,记录L*(亮度),a*(红/绿度)和b*(黄色/蓝),平行测定3次。
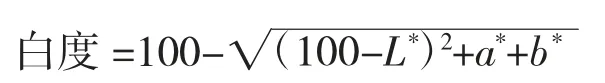
式中:L*——亮度值;
a*——红/绿度值;
b*——黄/蓝度值。
1.3.5保水性的测定
参照Foegeding E A[11]方法,稍作改动。取2 g凝胶样品放入离心管中称重,在转速10 000 r/min,温度4℃条件下离心时间3 min,完成后倒掉离心出来的水,再称离心管和凝胶的质量,通过以下公式计算凝胶保水性,平行测3次。
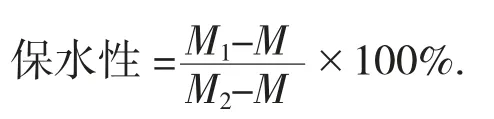
式中:M——离心管质量,g;
M1——离心管与离心后除去水的凝胶总质量,g;
M2——离心前离心管与凝胶总质量,g。
1.3.6 持油性的测定
称取1 g凝胶样品于离心管中,称得凝胶与离心管重并记录,加入5 mL大豆油剧烈振动5 min后,在25℃条件下放置30 min,以转速4 000 r/min离心20 min,离心后移去上层大豆油,并称重,平行测定3次。
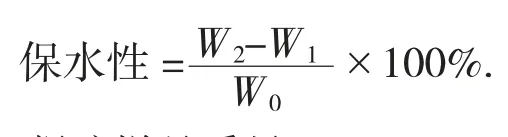
式中:W0——凝胶样品质量,g;
W1——凝胶与离心管的质量,g;
W2——凝胶、离心管与色拉油的质量,g
1.3.7 凝胶强度的测定
凝胶样品置于4℃稳定12 h后,去除凝胶表面的液体,室温下放置10 min后进行质构分析。选用直径10 mm的圆柱状探头(P/0.5S),设定测试前速度1 mm/s,测试中速度0.5 mm/s,测试后速度10 mm/s,穿刺距离10 mm,触发力10 g,数据速度100(每秒钟取点数),通过软件对数据进行分析[12]。
1.3.8 微观结构的测定
将肌原纤维蛋白凝胶样品切成小切条(5 mm×5 mm×5 mm),用2.5%的戊二醛在4℃固定24 h。用pH值7.0的0.1 mol/L磷酸盐缓冲液洗涤肌原纤维蛋白凝胶条3次,除去戊二醛流体,每次持续10 min。将除去戊二醛的肌原纤维蛋白凝胶条依次在50%,70%,80%,90%,100%乙醇中脱水10 min,重复3次。肌原纤维蛋白凝胶条用100%乙醇∶叔丁醇(1∶1)和叔丁醇置换15 min后,将肌原纤维蛋白凝胶条冷冻干燥36 h。使用扫描电子显微镜测定肌原纤维蛋白凝胶的微观结构[13]。
1.3.9 抗氧化性的测定
(1)ABTS自由基清除能力。配制7 mmol/LABTS溶液,将ABTS与2.45 mmol/L的过硫酸钾溶液混合,将混合溶液置于25℃环境下避光存放12~16 h,从而得到ABTS储备液。用pH值4.5、浓度20 mmol/L乙酸钠溶液稀释至波长734 nm处的吸光度为0.7±0.02。取3 mL该溶液与20 μL试样液混合后放置6 min,于波长734 nm处测定吸光度。
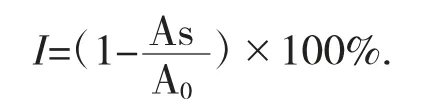
式中:I——ABTS自由基清除率,%;
A0——对照的吸光度;
As——样品的吸光度。
(2)DPPH自由基清除能力。样品组Ai用2 mL稀释后待测溶液与DPPH溶液2 mL均匀混合;空白组Aj是用2 mL稀释后待测溶液与2 mL乙醇均匀混合;对照组Ac为2 mL纯净水与DPPH溶液2 mL均匀混合。
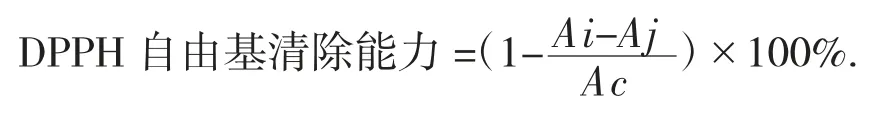
(3)羟自由基清除能力。在试管中加入pH值7.4的0.2 mol/L磷酸盐缓冲液2 mL,去离子水1.0 mL,将上述液体摇匀;继续加入0.75 mol/L FeSO4溶液1.0 mL,充分混匀;加入0.01%H2O21.0 mL,振荡1 min,加入1.5 mmol/L邻二氮菲无水乙醇溶液1.0 mL,将混合液在37℃水浴45 min,于波长536 nm处检测反应体系吸光度Ap,以去离子水1.0 mL代替H2O21.0 mL,其余条件相同,测其吸光度A,以样液1.0 mL代替去离子水,其余条件相同,测其吸光度值As。
2 结果与分析
2.1 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白疏水性的影响
鲢鱼骨蛋白水解物添加量对肌原纤维蛋白疏水性的影响见图1。
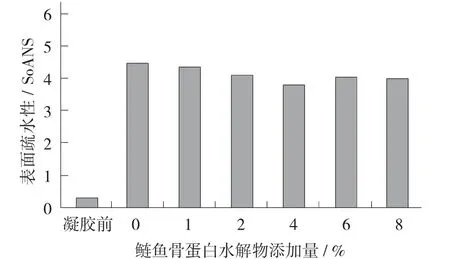
图1 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白疏水性的影响
由图1可知,与形成凝胶前相比,鲢鱼肉肌原纤维蛋白形成凝胶后,表面疏水性明显增加,增加至凝胶形成前的15.5倍,因为蛋白加热形成凝胶,高温破坏了蛋白质的空间结构,让更多的疏水性氨基酸暴露出来,导致凝胶的表面疏水性增大。
随着鲢鱼骨蛋白水解物添加量增加,肌原纤维蛋白凝胶表面疏水性总体呈下降趋势,由于外露的疏水性基团增加到一定程度时,部分蛋白质分子通过疏水相互作用形成蛋白质聚集,使暴露在蛋白分子表面的疏水基团又被包埋[14],从而导致表面疏水性下降。
2.2 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白总巯基和活性巯基的影响
鲢鱼骨蛋白水解物添加量对肌原纤维蛋白总巯基和活性巯基的影响见图2。
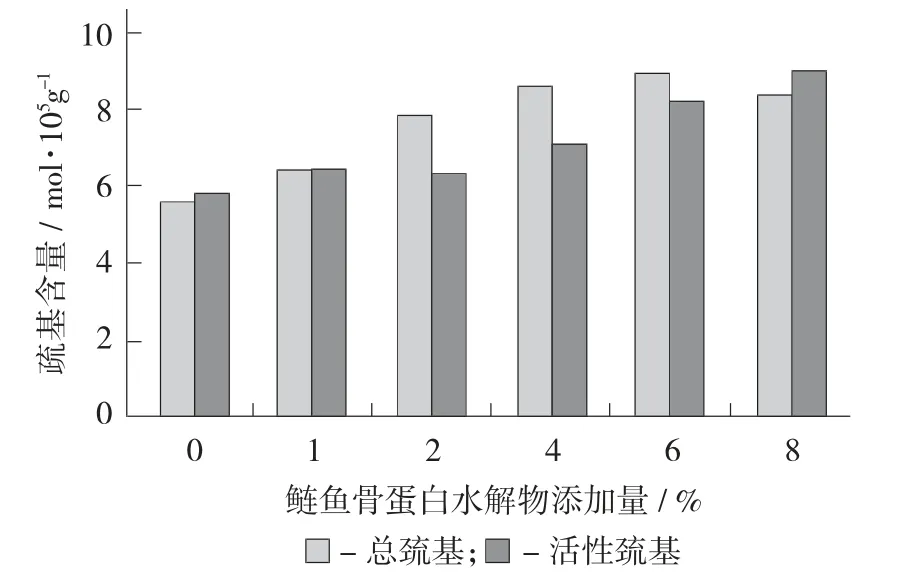
图2 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白总巯基和活性巯基的影响
由图2可知,当添加鲢鱼骨蛋白水解物后,总巯基含量、活性巯基的含量呈现逐渐上升趋势,可能是随着鲢鱼骨蛋白水解物添加量的增加,使得肌原纤维蛋白结构部分展开,从而使蛋白结构中的二硫键变化形成巯基,使总巯基含量得以升高。而蛋白溶解度提高,会使包埋于分子内部的巯基暴露出来,进而使得活性巯基的含量逐渐增加[15]。
2.3 鲢鱼骨蛋白水解物添加量对肌原纤维蛋凝胶白度的影响
鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶白度的影响见图3。
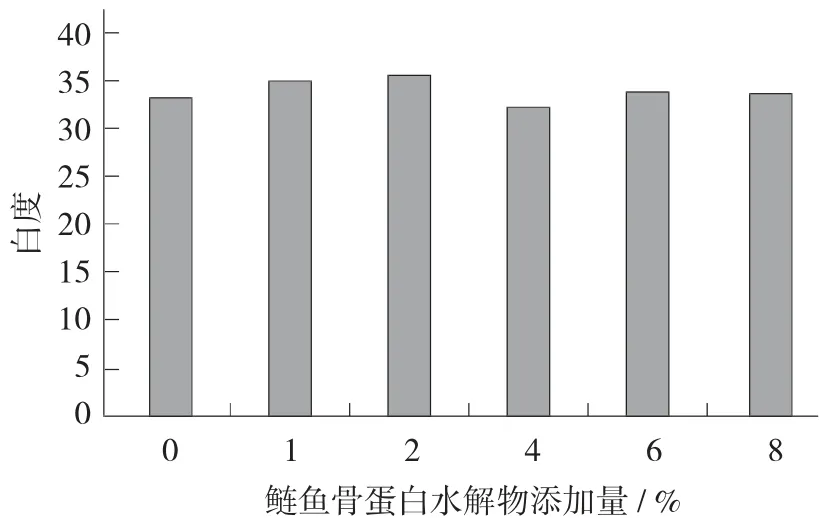
图3 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶白度的影响
由图3可知,当添加量为1%~2%时,添加鲢鱼骨蛋白水解物的肌原纤维蛋白凝胶白度明显高于空白对照,当添加量为2%时,凝胶的白度达到最大,为35.80。鲢鱼骨蛋白水解物本身呈白色,使凝胶的白度值有所增加。凝胶的白度变化大小取决于蛋白质变性的程度,白度值越小说明蛋白质变性程度越严重。当添加量大于4%时,白度值有所下降,可能是由于水解物添加量较大,搅拌溶解时间增加,进而导致肌原纤维蛋白在空气中暴露时间较长,从而导致凝胶白度降低[16]。
2.4 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶保水性的影响
鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶保水性的影响见图4。
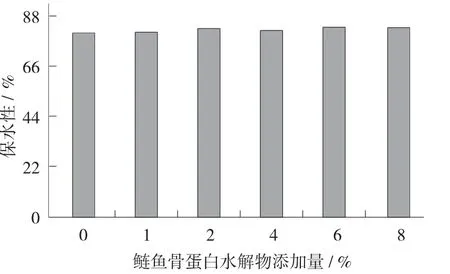
图4 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶保水性的影响
随着鲢鱼骨蛋白水解物添加量的增多,肌原纤维蛋白凝胶的保水性呈上升趋势,鲢鱼骨蛋白水解物添加量为6%以上时,与未添加鲢鱼骨蛋白水解物凝胶相比保水性提高了5%。鲢鱼骨蛋白质经过水解后产生小分子肽,当其添加到鱼糜凝胶中时,自身可能会填充到鱼糜凝胶的网络结构中,使凝胶更加致密,从而提高鱼糜制品的保水性[17]。
2.5 鲢鱼骨蛋白水解物添加量对肌原纤维蛋凝胶持油性的影响
鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶持油性的影响见图5。
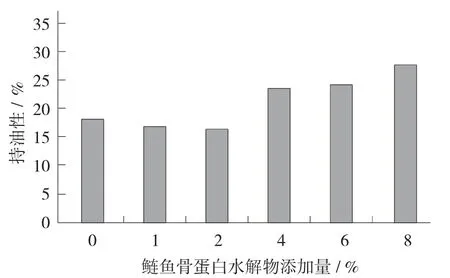
图5 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶持油性的影响
随着鲢鱼骨蛋白水解物添加量的增加,肌原纤维蛋白凝胶持油性呈现先降低后升高的趋势。与未添加鲢鱼骨蛋白水解物的凝胶相比,鲢鱼骨蛋白水解物添加量为1%,2%时,凝胶持油性降低了5.70%,2.99%,可能是添加少量鲢鱼骨蛋白水解物在一定程度上破坏了蛋白质的网络结构,物理截留油粒的能力降低,故持油性降低[18]。当添加量为4%,6%,8%时,凝胶持油性提高了0.88%,1.05%,5.26%,可能是大量的鲢鱼骨蛋白水解物与肌原纤维蛋白分子结构间产生相互作用,使亲脂基团大量暴露,从而提高了凝胶的持油性[19]。
2.6 鲢鱼骨蛋白水解物添加量对肌原纤维蛋凝胶强度的影响
鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶强度的影响见图6。
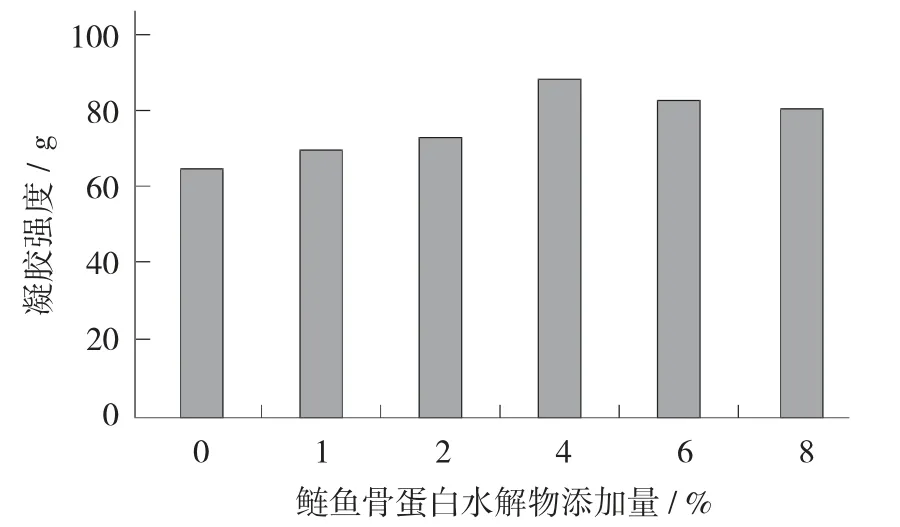
图6 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶强度的影响
随着鲢鱼骨蛋白水解物添加量的增大,肌原纤维蛋白凝胶强度呈先增加后下降趋势。未添加鲢鱼骨蛋白水解物的凝胶强度为64.59 g,当鲢鱼骨蛋白水解物添加量为4%时,凝胶强度达到最大,为88.33 g,与空白对照组相比上升了36.74%,部分鲢鱼骨蛋白水解物填充在蛋白质的空隙间,使得蛋白质凝胶强度一定程度上有所升高。随着鲢鱼骨蛋白水解物添加量的增加,凝胶强度有所下降,可能是由于过多的鲢鱼骨蛋白水解物破坏了凝胶的结构,导致凝胶强度的下降。
2.7 微观结构观察
不同鱼骨蛋白水解物的肌原纤维蛋白凝胶电镜图见图7。

图7 不同鱼骨蛋白水解物的肌原纤维蛋白凝胶电镜图
随着鲢鱼骨蛋白水解物添加量的增加,凝胶结构变得光滑平整,由图7可知,未添加量鲢鱼骨蛋白水解物时,凝胶有明显的断层现象,粗糙且有较大蜂窝状空洞,当添加量为1%时,凝胶中有不规则空洞且有蛋白质聚集;当继续增加添加量时,凝胶的断层逐渐变小,这与添加鲢鱼骨蛋白水解物后凝胶强度的变化相一致,蛋白凝胶特性的好坏取决于蛋白质分子伸展和交联的相对速率,当蛋白质伸展速率高于交联速率时,蛋白质分子得以充分伸展,从而彼此相互作用形成有序的凝胶结构;反之则形成粗糙的凝胶网络[20]。当添加量为4%时,凝胶的结构平整光滑,三维网状结构紧密,有利于凝胶对水的束缚能力。当添加量大于4%,凝胶的结构又开始松散,出现断层,三维网状结构松散,这与李学鹏等人[21]研究添加微细鲽鱼鱼骨泥对金线鱼鱼糜凝胶品质的影响结果相近。
2.8 鲢鱼骨蛋白水解物添加量对肌原纤维蛋白凝胶抗氧化性的影响
添加鲢鱼骨蛋白水解物的肌原纤维蛋白对自由基清除率的影响见图8。

图8 添加鲢鱼骨蛋白水解物的肌原纤维蛋白对自由基清除率的影响
试验研究鲢鱼骨蛋白水解物的肌原纤维蛋白添加量清除ABTS自由基、DPPH自由基和羟自由基的影响。当鲢鱼骨蛋白水解物添加量大于4%时,对ABTS自由基和DPPH自由基清除率达到最大,清除率分别为27.2%,88.4%。鲢鱼骨蛋白经酶解后结构被破坏,形成的水解物含有抗氧化性氨基酸的肽段,增强了其抗氧化能力[22]。也可能是由于蛋白水解后,反应位点增多,能提供更多活泼质子与自由基结合成稳定的物质,因而提高了抗氧化活性。
3 结论
研究了鱼骨蛋白水解物对肌原纤维蛋白巯基、表面疏水性、凝胶性能、微观结构及抗氧化作用的影响。肌原纤维蛋白表面疏水性、总巯基和活性巯基含量随鱼骨蛋白水解物添加量增大而增加。添加量为4%鱼骨蛋白水解物可保持使凝胶具有较高的凝胶强度和保水力,扫描电镜观察也同样显现出致密的微观结构。4%鱼骨蛋白水解物-肌原纤维蛋白复合物清除DPPH自由基达到最高,清除率为88.4%。

