应用24个微卫星标记分析SD和Wistar大鼠的遗传多样性*
李 欢 魏 杰 左 琴 王 洪 周佳琪 光姣娜 范 涛 付 瑞 刘佐民 岳秉飞
(中国食品药品检定研究院,北京 102629)
实验动物是现代生物医学发展的重要基础,其质量直接影响着相关科研应用的发展水平。按遗传学控制方法,根据基因纯合程度可将实验动物分为近交系、突变系、杂交群和封闭群四类。Wiatar 大鼠和SD大鼠是我国引进最早、使用最广泛封闭群大鼠品系,具有较好的基因杂合性,比近交系具备生活力和生育力强、繁殖率高的优点,自引入后就得到了大量生产以及在生物制品和化学药品的检定中广泛应用。
随着应用需求不断发展,对封闭群大鼠的遗传质量控制也提出了更高要求。一方面需要进行科学的饲育管理,同时也需要进行定期遗传监测反馈与生产应用,从而保障群体相对稳定的基因异质性,避免近交分化。在GB 14923—2010哺乳类实验动物的遗传质量控制国家标准实施之前,对于封闭群遗传质量检测缺乏明确的要求,这就使得封闭群大鼠的遗传质量长期处于“失控”状态,不利于其良性发展。
微卫星DNA标记是由2~6 bp核苷酸单位组成的多次串联重复序列,又称短串联重复序列(short tandem repeats,STRs)或简单重复序列(simple sequence repeat,SSR),具有分布广泛、多态性丰富、稳定性和重复性好的特点。作为群体遗传的理想分子标记,也被GB 14923—2010作为封闭群遗传检测的推荐方法。本研究采用了微卫星标记法,选取了覆盖大鼠21条染色体的24个微卫星位点对本单位SD和Wistar大鼠封闭群进行遗传结构分析,从而为SD大鼠和Wistar大鼠封闭群的群体质量控制和应用提供基础数据。
1 材料和方法
1.1 实验动物
随机从本单位选取SPF动物SD和Wistar大鼠各24只,雌雄各半,单雄性鼠体质量在500~600 g,雌性在280~400 g,30周龄。SD大鼠和Wistar大鼠生产许可证号【SCXK(京)2017-0005】。
1.2 实验试剂及仪器
1.2.1仪器:ABI Veriti96 PCR仪(ABI)、Bio-Rad BASIC(Bio-Rad)、GelLogic 212Pro(柯达)、微量分光光度计 Implen NanoPhotometer N50(Implen)。
1.2.2试剂:TAE缓冲液(生工Sangon Biotech)、100 bp DNA marker(TaKaRa)、Taq酶(TaKaRa)、ddH2O、Ex Red核酸染料(北京庄盟)、蛋白酶K(TaKaRa)。
1.3 引物选择
微卫星位点选自文献《实验小鼠、大鼠微卫星 DNA 检测法标准的编制》[1],该标准中微卫星位点经过严格筛选及优化并经多家单位验证后具有较好的重复性和可行性,可成为国家标准GB/T 14927.1—2008 的补充。位点信息见表1,由北京擎科新业生物技术有限公司合成并进行荧光染料标记。

表1 本研究采用的24个微卫星位点标记信息
1.4 实验方法
1.4.1样本DNA提取:剪取鼠尾组织0.5 cm置于EP管中,经水浴锅中过夜消化后,利用三氯甲烷/异戊醇抽提法进行DNA的提取,然后通过琼脂糖凝胶电泳和微量分光光度计测量DNA的完整性、纯度、浓度。当样本DNA A260/280在1.8~2.0为合格,并将纯度稀释到40~80 ng/μL,在-20°条件下保存备用。
1.4.2PCR反应体系及扩增条件:总体系为20 μL,ddH2O 13.3 μL,10×PCR缓冲液2 μL,dNTP 1.2 μL,TaqE酶0.5 μL,上、下游引物各1 μL,样品DNA 1 μL。PCR扩增反应条件为95 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个扩增循环,72 ℃延伸8 min,4 ℃保存。
1.4.3基因测序:所得PCR扩增结果由北京擎科新业生物技术有限公司进行二代测序。
1.5 数据分析
采用Popgen32软件处理二代测序数据,分别分析两群体的等位基因数、有效等位基因数、平均杂合度等遗传结构参数,使用Little Programe软件计算微卫星位点的多态性信息含量,并通过网络在线工具GenePop进行Hardy-Weinberg 平衡及杂合子缺失检验。
2 结果
2.1 SD和Wistar群体遗传多样性分析
通过Popgen32软件对二代测序数据处理后得到两群体遗传结构参数。SD遗传结构参数结果见表2,SD群体的平均等位基因数为3,平均杂合度为0.434 4,平均多态信息含量为0.38,D1Rat345、D8Rat14、D10Wox12、AGT呈单态位点。Wistar遗传结构参数见表3,Wistar群体中的平均杂合度为0.426 1,平均等位基因数为2.95,平均多态信息含量为0.37,D6Mit1、D11 Mgh3、MBPA、PRPS2呈单态。总体来看,SD群体遗传多样性比Wistar群体遗传多样性丰富。

表2 SD大鼠遗传结构参数
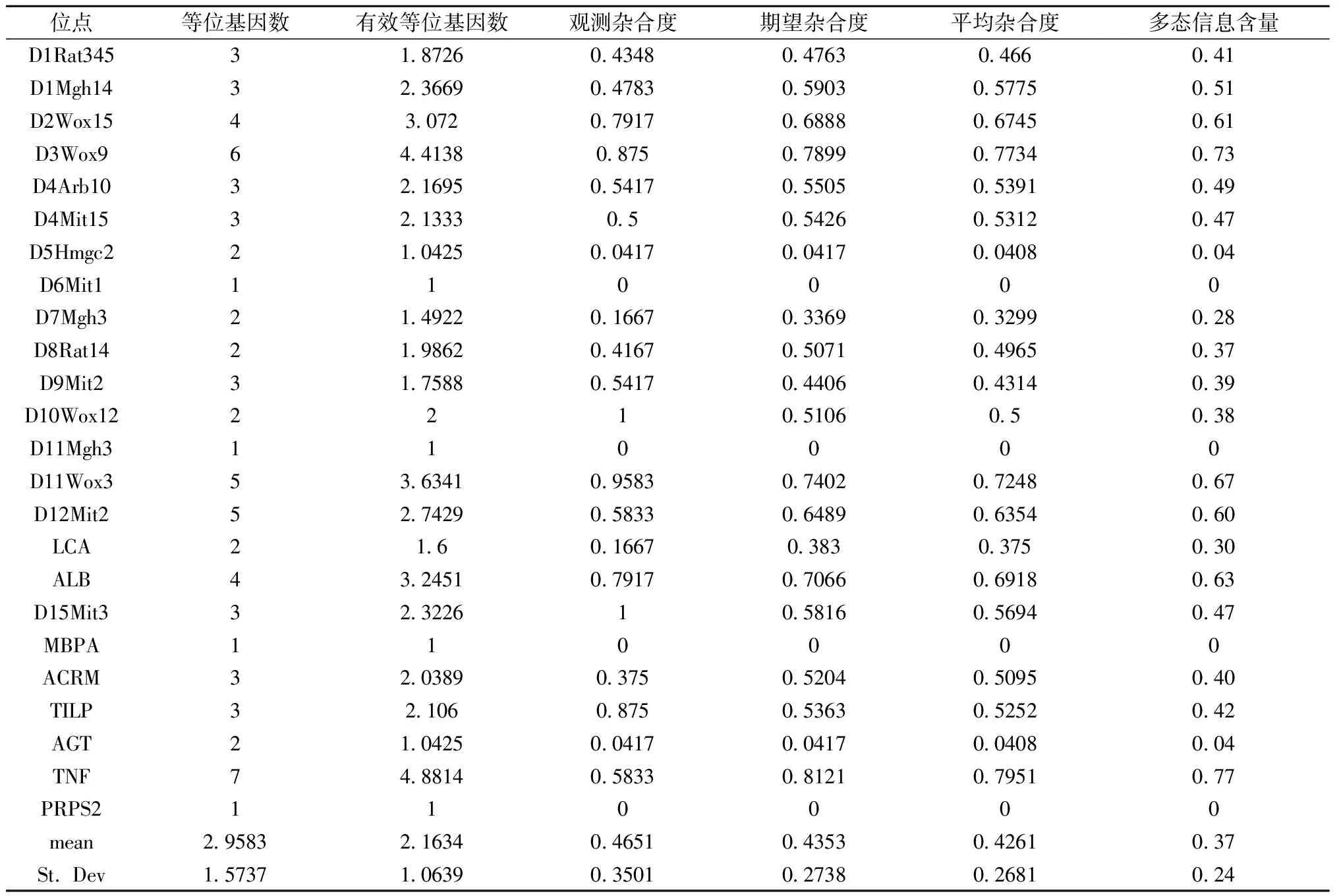
表3 Wistar大鼠遗传结构参数
2.2 两群体的Hardy-Weinberg平衡检验
利用在线网络Genepop通过Markov chain(MC)精确检验方法对两只大鼠群体进行Hardy-Weinberg平衡检测,并进行杂合子缺失检验。结果见表4,在SD群体中D1Mgh14、D3Wox9、D5Hmgc2、D7Mgh3、D9Mit2、LCA、D15Mit3、MBPA、TNF、PRPS2 共计10个微卫星位点偏离Hardy-Weinberg平衡(P<0.05),其中D1Mgh14、D7Mgh3、D9Mit2、LCA、MBPA、TNF、PRPS2位点表现为杂合子缺失(Fis>0);Wistar群体中D3Wox9、D7Mgh3、D10Wox12、D11Wox3、D12Mit2、LCA、D15Mit3、TILP、TNF共计9个微卫星位点偏离Hardy-Weinberg平衡(P<0.05),其中D7Mgh3、LCA、TNF、D12Mit2位点表现为杂合子缺失(Fis>0)。
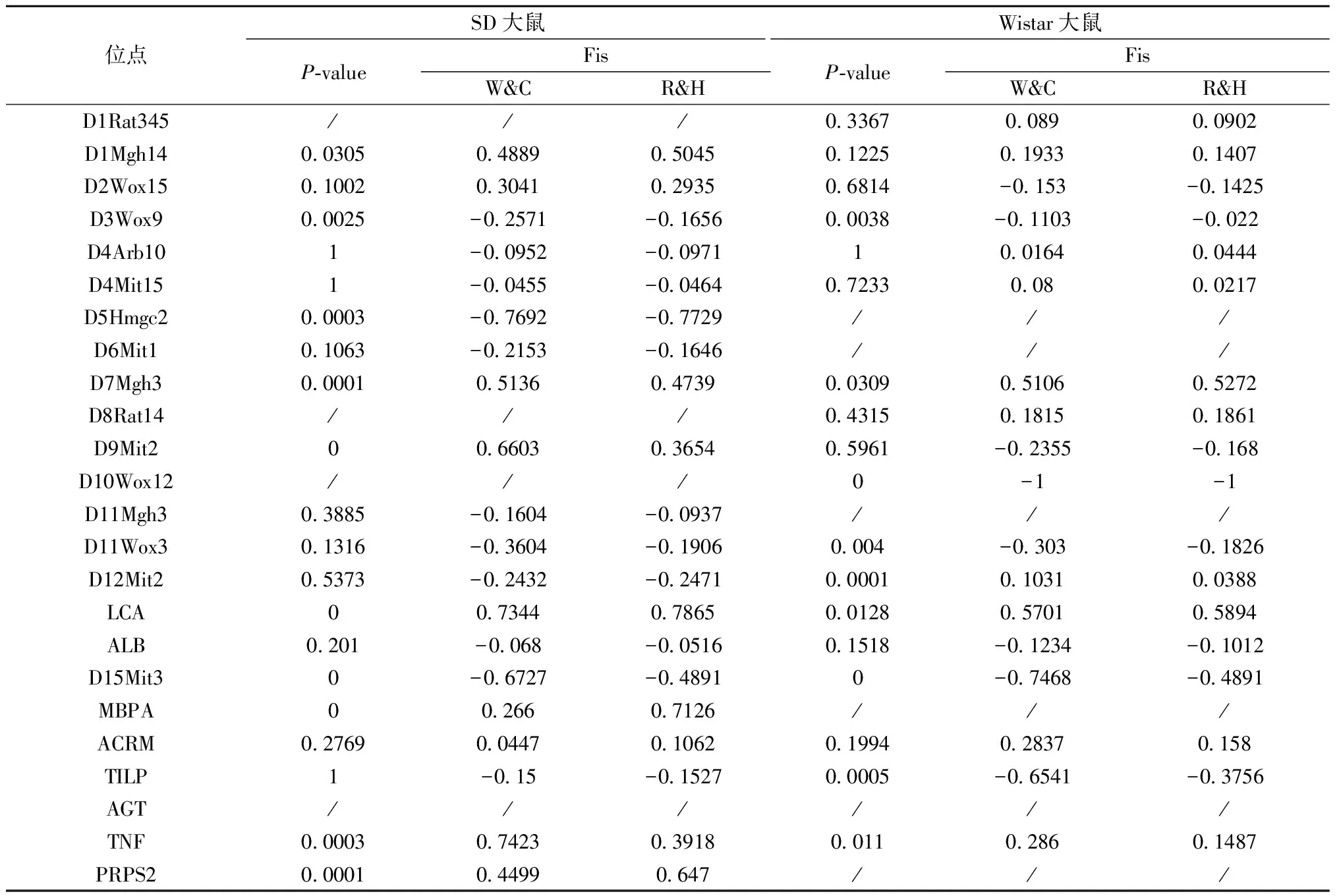
表4 SD和Wistar的Hardy-Weinberg 平衡及杂合子缺失检测
3 讨论
3.1 标记位点的多态性分析
据报道,在国际上一些实验动物生产机构,如Jackson Lab、Charles River、Taconic、Harlan虽提出遗传检测标准,如Charles River 采用6~9个STR位点进行近交系检测,Taconic采用2个STR区分有差别的近交系,但是他们在进行小鼠、大鼠遗传质量微卫星检测时采用的位点及数量并不相同[2]。我国发行的T/CALAS 21-2017团体标准中明确规定了对实验动物大、小鼠进行微卫星检测时选取微卫星位点要尽量覆盖小鼠的20条染色体和大鼠的21条染色体[3]。本文所选取的24个微卫星位点覆盖了大鼠的21条染色体,相比传统生化标记检测,该检测覆盖了封闭群大鼠全部染色体,从而可以较为全面客观体现大鼠的遗传概貌。
多态信息含量(PIC)可以用来评定一个遗传标记在群体检测多态性时的价值。PIC值大小取决于标记位点的等位基因数目及其频率分布。有研究指出PIC>0.5的标记位点为高度多态座位,即可以提供较高的遗传信息;0.25 从分子水平看遗传多样性指的是某一品系或品种内个体间DNA水平的差异,遗传多样性降低,有价值的基因可能丢失,进而品种的质量和育种的潜能下降[8]。因此对实验动物的遗传多样性进行分析,有助于掌握实验动物的遗传背景,从而对其质量进行检测及控制。本研究应用24个微卫星标记在SD大鼠群体中检测到平均等位基因数为3个,最多位点的等位基因有6个,最低的有1个。Wistar群体中平均每个基因座位有2.958个等位基因,最多位点的等位基因有7个,最低的有1个。有效等位基因数是指在理想的群体中,一个基因座位产生与实际群体中相同纯合度所需要的等位基因数[9]。有效等位基因数与实际所检测到的等位基因数越接近,表明在群体中的等位基因分布越均匀。本研究中SD和Wistar群体的平均有效等位基因数分别为2.118 4、2.163 4个,实际检测到平均等位基因数分别为3、2.958 3个。平均有效等位基因数与实际检测到的基因数有一定差距,表明所选取的24个微卫星位点的等位基因在SD和Wistar群体分布不均匀。 杂合度是反映群体多个基因座位遗传变异程度的指数,即杂合度越高,遗传变异程度越大,群体遗传多样性也越高。本研究得到SD和Wistar两群体的平均杂合度分别为0.434 4、0.426 1。有研究选取6个多态性较好的微卫星位点对Wistar和SD遗传背景进行分析[10],最后得到SD群体和Wistar群体平均杂合度分别为0.585 9、0.598 2,要高于本研究所得到的平均杂合度参数。其原因可能是:第一,实验选取的微卫星数量及种类不一样;第二,所选种群非同一群体,且封闭群封闭管理,保种时间长,在后代繁殖过程中发生了遗传漂变。而发生遗传漂变程度与群体大小密切相关,群体越小,漂变速度越快[11]。本实验所检测实验动物来自40对基础群体,虽然采用循环交配方式进行繁育,但其有效群体含量相对较小,故受到的遗传漂变影响较大。因此后期要加强对基础种群的建设,定期对实验动物进行遗传质量检测。 目前,常用的Hardy-Weinberg遗传平衡检验方法主要有卡方检验、精确检验。对于STR遗传标记,由于检测样本含量相对较少而等位基因相对过多,使得众多的低频率基因型无法被观察到,为此使用Hardy-Weinberg平衡精确检验更为合适[12]。固定指数Fis又称近交系数,用来衡量群体杂合子频率与Hardy-Weinberg平衡群体预期的杂合子频率的差异。当Fis>0为杂合子缺失,表明群体有近交分化;Fis<0为杂合子过量,表明群体避免了近交分化或者存在杂合子优势[13]。在GenePop中对于Fis估算主要有Weir&Cockerham(1984)即W&C和Robertson&Hill(1984)即R&H两种[14]。通过Hardy-Weinberg平衡及杂合子缺失检测,SD群体中有10个位点偏离平衡(P<0.05),其中有7个位点表现为杂合子缺失。Wistar群体中有9个位点偏离平衡(P<0.05),其中有5个位点表现为杂合子缺失。两个群体中偏离Hardy-Weinberg平衡的位点均含有中高度多态性信息含量,总体来看,SD群体的遗传多样性要比Wistar遗传多样性高。封闭群实验动物繁育过程会受到人工因素影响,因此某些位点偏离Hardy-Weinberg平衡也较为常见[15]。对于偏离Hardy-Weinberg遗传平衡的位点,很有可能是实验动物在封闭繁育的时候并未实现随机交配而导致群体产生近交现象。因此后期在进行封闭群繁育管理中,要定期进行遗传监测。只有通过定期的遗传检测,才可以发现实验动物群体所存在的问题,进而根据结果采取相应的对策。3.2 SD和Wistar大鼠群体遗传多样性分析
3.3 Hardy-Weinberg遗传平衡及杂合子缺失检验

