Smyd2基因敲除加重压力超负荷诱导的病理性心肌肥厚*
李 威 石红杰 周 妍 胡宇峰 夏 豪
(1.武汉大学人民医院心血管内科,武汉 430060)(2.武汉大学模式动物研究所,武汉 430071)
病理性心肌肥厚是多种心血管疾病的重要临床阶段,其主要原因为机械性或体液性因素导致的压力负荷持续性增大,造成心肌细胞肥大以及心肌间质纤维化,最终导致心脏功能严重受损,以及不可逆转的病理性心脏重构和心力衰竭[1]。在病理性心脏重构过程中,多种基因及信号传导通路参与调控心肌肥厚和纤维化病理生理过程[2-5]。Smyd2属于组蛋白甲基转移酶SMYD家族,通过基因表达的表观遗传调控参与多种疾病的发生发展过程[6]。Smyd2是最广泛研究的赖氨酸甲基转移酶之一,它可以甲基化修饰组蛋白H3K6、H3K4以及其他非组蛋白靶标,进而调控基因转录和表达[7]。此前研究表明,Smyd2通过调控基因转录,促进多种肿瘤,如肺癌、结肠癌和宫颈癌等的发生发展[8-10]。此外,Smyd2在心脏组织中高度表达,目前的研究对于Smyd2在心脏中的功能知之甚少[11]。对于Smyd2在病理性心肌肥厚中的作用尚不明确。因此,本研究成功构建了Smyd2基因敲除的小鼠,并建立压力负荷诱导的病理性心肌肥厚模型,以探究Smyd2在心肌肥厚和纤维化中的调控作用。
1 材料和方法
1.1 实验动物
本研究选用8~10周龄、体质量24~26 g、C57BL/6背景的雄性小鼠作为实验对象。Smyd2基因敲除(Smyd2-KO)小鼠为本实验室构建,对照组为C57BL/6背景的雄性同窝对照小鼠(WT)。小鼠的饲养和繁殖均在武汉大学模式动物研究所SPF级动物房,实验动物生产许可证号【SCXK(鄂)2019-0004】,实验动物使用许可证号【SYXK(鄂)2019-0013】。所有动物实验均经过武汉大学人民医院实验动物伦理委员会审查并获得伦理批准,伦理审批号【WDRM动(福)第20201206号】。
1.2 实验主要试剂
戊巴比妥钠(Sigma Aldrich公司,P3761)、细胞核染料(Southern Biotech公司,0100-20)、苏木精染液(谷歌生物公司,G1004)、伊红染料(BASO公司,BA-4024)、天狼星红染料(海德创业生物科技公司,26357-02)、MEGAshortscript试剂盒(Ambion公司,AM1345)、miRNeasy Micro Kit(Qiaen公司,217084)。
1.3 实验仪器
独立送回风净化笼具(苏杭科技器材有限公司)、温控手术台(WPI公司,ATC100)、台式离心机(Thermo公司,LEGNED MICRO17)、多功能脱色摇床(上海智诚公司,ZWY-344)、凝胶成像系统(伯乐公司,Gel DocTM)、PCR仪(ABI公司,Verti)。
1.4 Smyd2基因敲除小鼠的构建及鉴定
Smyd2基因敲除小鼠运用CRISPR-Cas9技术成功构建。首先,在http://crispr.mit.edu上在线预测小鼠Smyd2的引导序列并设计了两条sgRNA,sgRNA1∶5’-GATGCCGGGATGCGGATATAGGG-3’,sgRNA2∶5’-GTGGCTGGGGATCATGCCGAGGG-3’。通过引物退火得到双链DNA,将双链DNA克隆到pUC57-sgRNA(Addgene,51132)载体上,然后以上述载体为模板通过PCR扩增得到含有T7启动子及引导序列的DNA片段。扩增使用引物为正向引物:5’-GATCCCTAATACGACTCACTATAG-3’,反向引物:5’-AAAAAAAGCACCGACTCGGT-3’。以上述步骤得到的PCR产物和Cas9质粒(Addgene,44758)作为模板用MEGAshortscript试剂盒(Ambion,AM1345)分别进行体外转录。将转录得到的Cas9和sgRNA的mRNA用miRNeasy Micro Kit(Qiaen,217084)纯化后通过FemtoJet5247显微注射系统注射到野生型C57BL/6小鼠的单细胞受精卵内。选取经显微注射后存活的受精卵移植到健康雌鼠输卵管中,妊娠得到F0代小鼠。将F0代小鼠和野生型C57BL/6小鼠杂交得到F1代小鼠,然后用PCR鉴定小鼠基因型,将杂合子杂交并鉴定筛选得到纯合子小鼠。PCR鉴定引物为:Smyd2-正向:5’-CTTCCCATCTCAAACGGTTC-3’,Smyd2-反向:5’-AACTTGGCTGATGGTGTCCT-3’。本研究中所用小鼠均为纯合子。
1.5 动物模型建立
分别将10只WT和Smyd2-KO的小鼠进行主动脉弓缩窄术(TAC),建立压力超负荷诱导的心肌肥厚模型[12-14]。首先,用3%戊巴比妥腹腔注射进行小鼠麻醉,沿第2~3肋间切开皮肤并分离肌肉以及软组织,然后用解剖剪剪断右锁骨,游离主动脉弓,随后用7-0手术缝线穿过26 G垫针结扎主动脉。依次缝合切口,将小鼠置于恒温箱中,苏醒后将小鼠放回于饲养室继续饲养观察。
1.6 超声检测
TAC术后4周,用异氟烷麻醉小鼠后,将小鼠固定为左侧卧位或仰卧位,在左胸前区做剃毛处理,然后涂抹超声耦合剂在剃毛区。采用高频超声诊断仪设置超声频率为15 MHz,选取标准左室乳头肌短轴切面进行超声检测,测量并计算左室舒张末期内径、左室收缩末期内径、短轴缩短率以及射血分数。
1.7 组织病理学检测
超声检测完成后,称重后处死小鼠,快速取出心脏组织,用10倍体积的4%多聚甲醛固定24 h,切除心房组织,依次进行脱水、石蜡包埋、切片处理。随后分别进行苏木精-伊红(HE)和天狼星红(PSR)染色,显微镜下观察心肌细胞横截面积和心肌纤维化的变化。
1.8 统计学分析
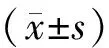
2 结果
2.1 Smyd2基因敲除小鼠的鉴定
Smyd2基因敲除小鼠采用CRISPR-Cas9技术,在Smyd2基因组DNA的第二个外显子两端分别设计2个sgRNA,以切割删除包含第二个外显子的部分,构建示意图见图1A。基因编辑小鼠成功构建后,取鼠尾组织基因组进行鉴定,鉴定结果如下图:WT小鼠鉴定的PCR产物大小为2 096 bp,删除掉Smyd2的第二个外显子后,Smyd2-KO鉴定的PCR产物为1 411 bp(图1B)。证明成功构建Smyd2敲除的纯合子小鼠。
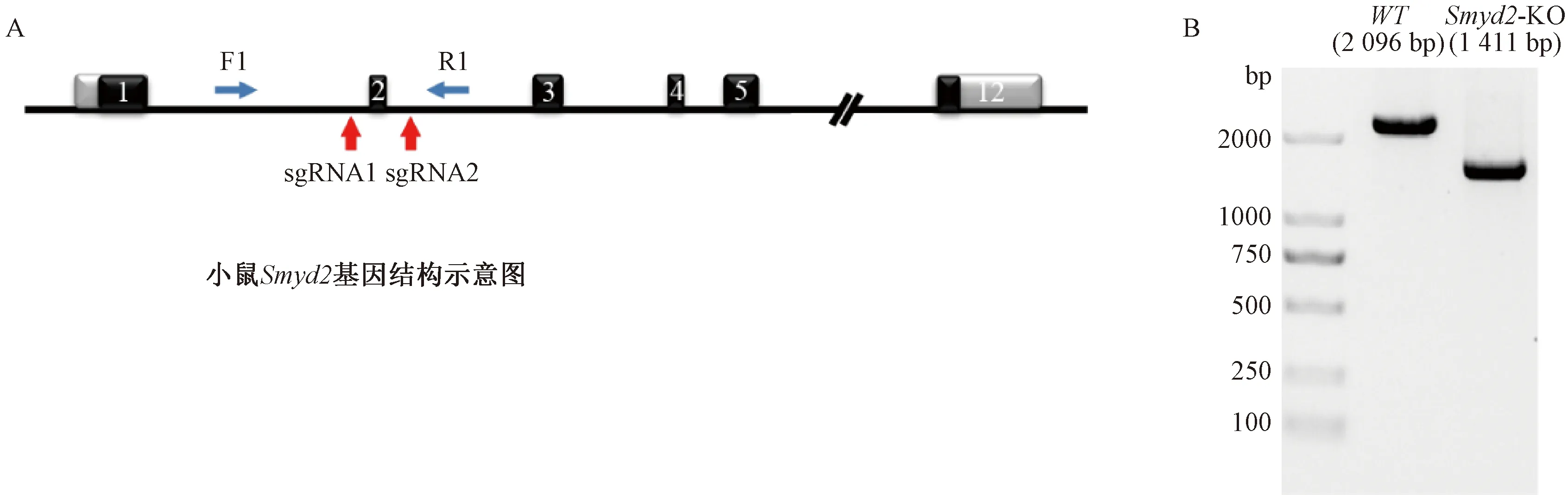
注:A.C57/6J小鼠Smyd2基因示意图,sgRNA靶位点用红色箭头表示。F1:PCR鉴定正向引物,R1:PCR鉴定反向引物。B.小鼠鼠尾鉴定 PCR产物的琼脂糖凝胶电泳图。WT:wild-type C57小鼠,Smyd2-KO:Smyd2基因敲除小鼠。
2.2 Smyd2基因敲除对心脏功能的影响
为了明确Smyd2在压力超负荷诱导的心肌肥厚中的作用,本研究检测了Smyd2基因敲除对心脏功能的影响。超声结果表明,TAC手术4周后,Smyd-KO组的左室舒张末期内径和左室收缩末期内径均显著高于WT组,而射血分数和短轴缩短率显著低于WT组(P<0.05)(表1)。表明Smyd2基因敲除促进了压力负荷导致的心脏功能受损。
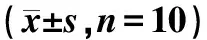
表1 TAC手术4周后各组超声检测结果的比较
2.3 Smyd2基因敲除对心肌肥厚的影响
HE染色结果显示,TAC手术4周后,Smyd2-KO组小鼠较WT组心脏体积明显增大(图2),定量统计结果显示Smyd2-KO组心肌细胞面积(503.77±24.78)较WT组(334.91±22.37)显著增加,差异具有统计学意义(P<0.05)。表明Smyd2基因敲除显著加重了压力负荷导致的心肌肥厚。
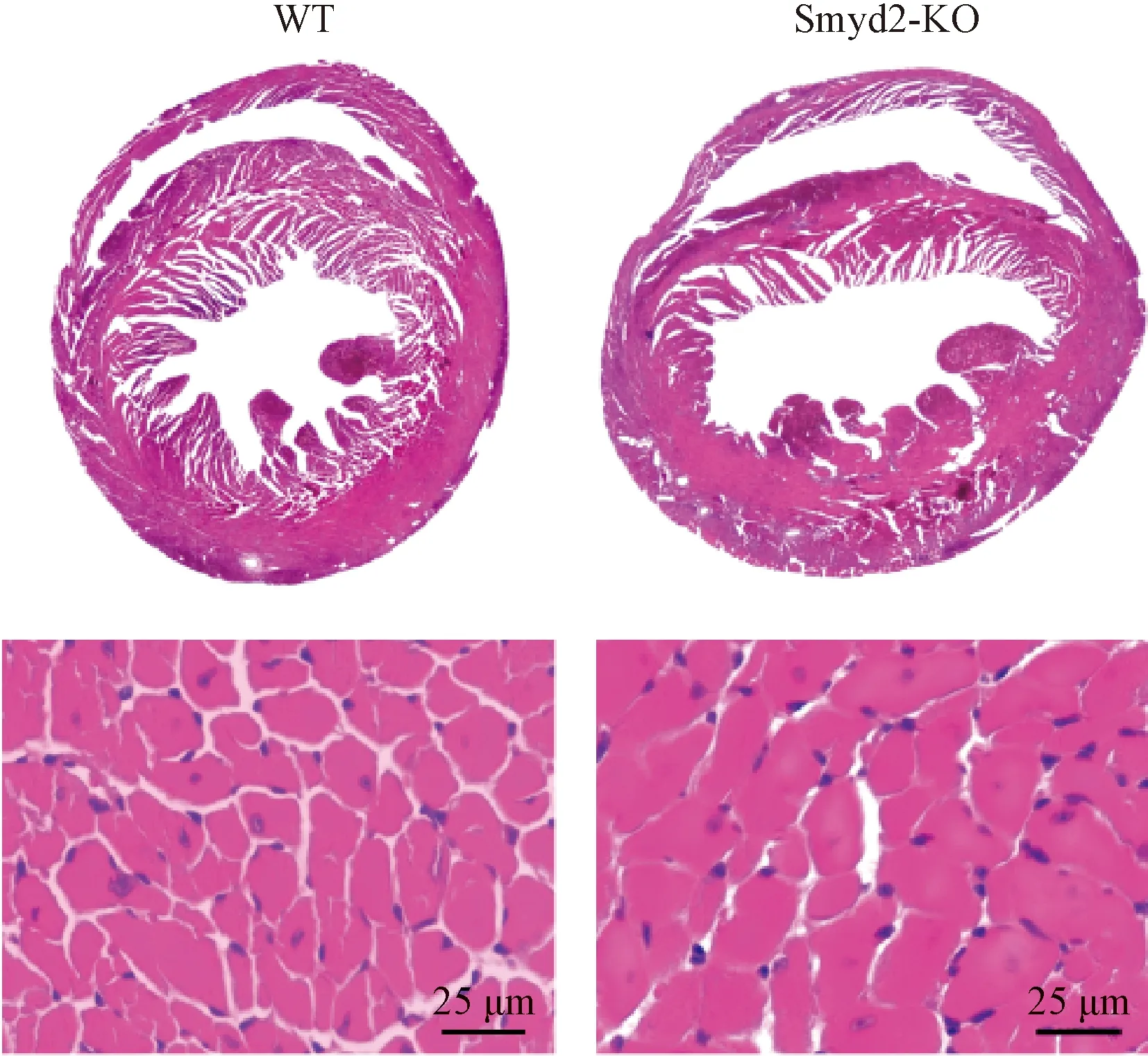
图2 TAC手术4周后各组小鼠心脏组织HE染色
2.4 Smyd2基因敲除对心脏纤维化的影响
PSR染色结果显示,TAC手术4周后,与WT组相比较,KO组心脏纤维化程度明显加重(图3)。统计学分析表明,KO组心肌胶原纤维含量(3.63±1.25)%较WT组(1.40±0.34)%明显增加,差异有统计学意义(P<0.05)。以上结果表明,Smyd2基因敲除显著加重了压力负荷导致的心脏纤维化。
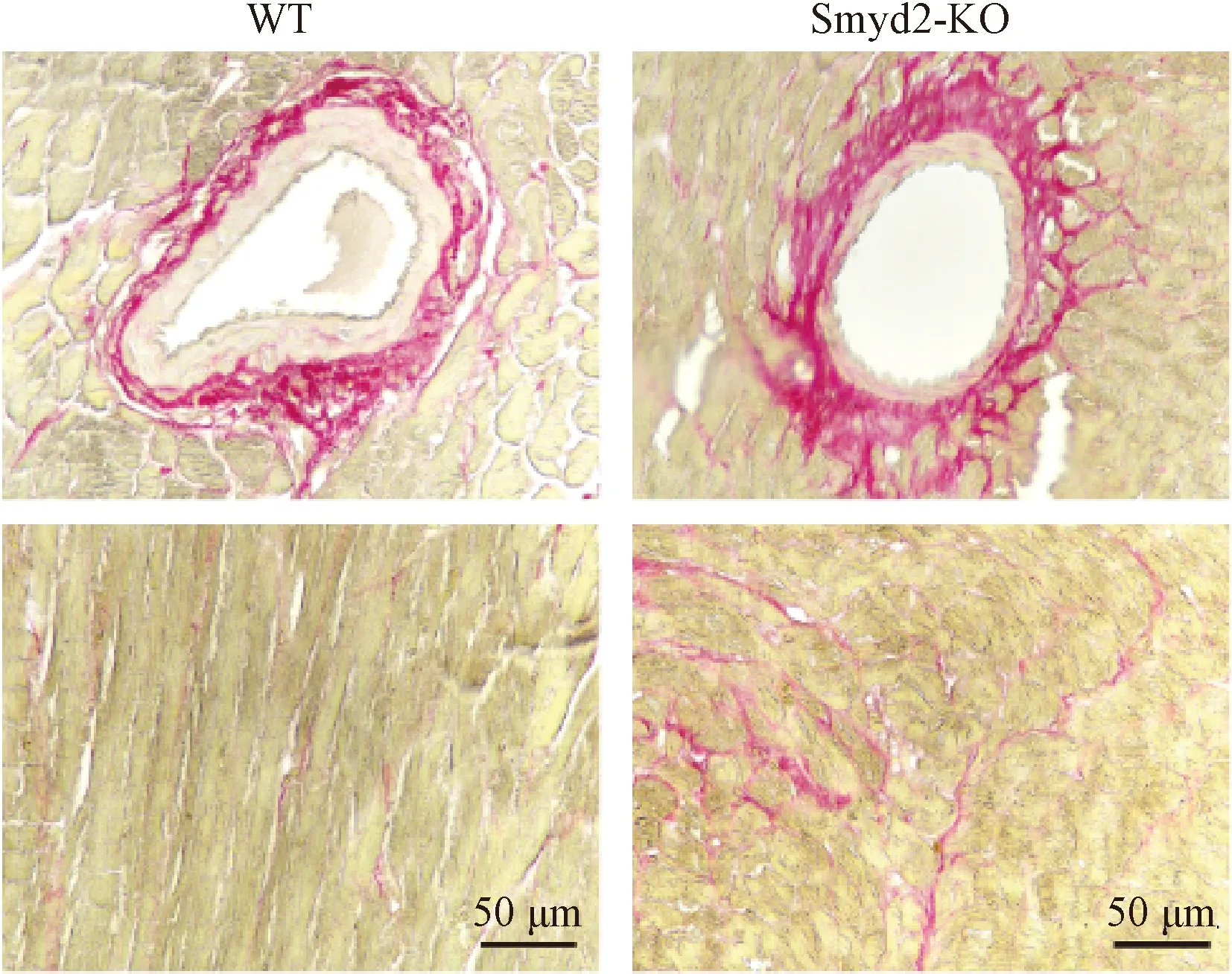
图3 TAC手术4周后各组小鼠心脏组织PSR染色的代表性图片
3 讨论
心肌肥厚是心脏对各种生理刺激和病理损伤导致的血流动力学负荷增大的代偿性应答,其主要特征为心脏重量增大,心肌细胞肥大,蛋白质合成增多[1]。代偿期心肌肥厚表现出适应性的心脏收缩能力增强,心脏输出量维持正常。但是,长期的持续性的心肌肥厚常会进展为心力衰竭,并且最终导致心血管相关病死率显著增加[15]。此外,抑制心肌肥厚的病理进展能有效降低心力衰竭发病率和死亡率[16]。因此,迫切需要更多研究深入了解心肌肥厚促发机制以及抗肥厚的保护性分子。以期未来能够开发特异性的分子有效抑制心肌肥厚的疾病进展。
本研究选用Smyd2-KO小鼠为研究对象,通过主动脉弓缩窄术建立心肌肥厚模型,术后4周分别通过超声检测心脏功能、组织病理学检测心肌肥厚和纤维化,全面评估了Smyd2敲除对压力超负荷诱导的病理性心肌肥厚的影响。结果显示Smyd2敲除后,压力负荷导致的心脏功能受损明显加重,并且病理学评价显示,Smyd2敲除显著加重了压力负荷诱导的心肌肥厚和心脏纤维化。这些结果一致表明,Smyd2敲除促进了病理性心肌肥厚和心脏重构的发生发展。此前的研究表明,Smyd2在心脏和脑组织中具有较高的表达丰度,并且Smyd2在心脏发育过程中差异表达[11]。然而,有研究表明,Smyd2的心脏特异性敲除并不会影响心脏的正常发育以及功能,但是能够有效调控翻译相关的基因转录[17]。这提示Smyd2并不影响正常心脏生理过程,而可能在多种心脏病理应激过程中发挥作用,如心肌梗死、心肌缺血、心肌肥厚等。本研究证实了敲除Smyd2不影响生理条件下的心脏功能,而加重了肥厚心脏的心脏功能受损。这提示Smyd2有潜力成为一个病理性心肌肥厚中有效的治疗靶标。
在正常水平以及压力负荷水平下,心肌细胞的功能维持需要一个复杂的调控网络控制基因表达。压力的不同类型和持续时间会导致这个调控网络发生改变,进而影响心脏表型改变,最终导致心力衰竭[18]。Smyd2作为一个研究广泛的甲基转移酶,能够有效调控细胞内的基因转录及翻译过程[6]。Smyd2在心脏功能维持以及心肌肥厚中的转录调控作用目前还不够清楚。本研究观察到Smyd2基因敲除促进心肌肥厚的疾病进展,但是并未深入探讨Smyd2的转录调控机制,后续需进一步深入探究Smyd2在心肌肥厚中的具体机制。

