电刺激小脑外侧核对内皮素-1诱导运动皮层缺血大鼠模型局部场电位的影响*
施国荣 刘婷婷 田 欣 祝自新 郑文荣 王宇峰 孙芳玲 王 文,3
(1.首都医科大学宣武医院实验动物室,北京 100053)(2.北京市老年病医疗研究中心,北京 100053)(3.北京脑重大疾病研究院脑卒中研究所,北京 100053)
缺血性卒中是世界范围内成人残疾和死亡的主要原因之一[1]。大多数幸存患者由于神经功能缺陷和障碍,导致生活质量的降低。根据流行病学统计数据,73.88%的首次卒中幸存者和55.75%的慢性卒中患者出现上肢运动障碍[2]。卒中的康复治疗是一个复杂的过程,受限于对影响脑功能重塑机制的认识不足以及我国康复医学发展起步较晚,目前亟需有效的卒中临床康复治疗手段。
作为基于脑的物理刺激干预,脑深部电刺激(deep brain stimulation, DBS)可能为卒中患者尤其是有严重运动障碍的患者,提供功能恢复的机会[3]。目前大多数卒中后遗症的DBS治疗主要集中在神经性疼痛,只有少数病例报告使用DBS治疗运动障碍[4-5]。然而,这些有限的数据表明,脑深部电刺激有可能改善卒中后的运动功能。最近的研究表明,用电或光遗传学方法刺激小脑外侧核可以促进卒中后运动功能的恢复[6]。本课题组前期研究也发现运动皮层缺血1 周或1 个月后电刺激小脑外侧核(lateral cerebellar nucleus,LCN)DBS可促进梗死侧SVZ区内源性神经干细胞增殖,进而改善大鼠的运动功能,减少梗死体积[7]。
电生理技术的应用为神经系统中的细胞活动提供客观的数据。其中在体大脑局部场电位(local field potential,LFP)记录通过记录大群神经细胞活性,监测距离记录电极最近的空间加权低频活动,体现神经网络中高度动态信息流[8]。因此LFP记录已被用于识别神经疾病的病理变化,检测进行性神经障碍的损伤程度,甚至可能提供与外显行为效应相对应的生理标志物,同时也为在体评估针对神经细胞活性的治疗手段提供客观准确的方法[9-10]。本实验通过在体记录大鼠大脑皮层的神经电生理信号,观察内皮素-1(endothelin 1,ET-1)诱导局灶性脑缺血大鼠模型皮层LFP的变化,探讨LCN DBS治疗对皮层神经元活动的影响,为LCN DBS再生修复治疗卒中提供了新的客观证据。
1 材料和方法
1.1 材料
1.1.1药物与试剂:药物与试剂内皮素-1(默克公司)、1.27 mm 2×40 p排针(深圳市连誉德科技有限公司)、1.27 mm 2×40 p排母(深圳市连誉德科技有限公司)、外径0.9 mm特氟龙镀银导线(上海鸿鹏电线电缆有限公司)、内径0.076 mm外径0.114 mm 特富龙绝缘钨丝(Plexon公司)。
1.1.2实验动物:SPF级别260~280 g雄性SD大鼠,北京华阜康生物科技股份有限公司提供。动物生产许可证【SCXK(京)2021-0008】,合格证号【11804700015271】。术前过夜禁食不禁水。采用内皮素-1注射大脑皮层诱导局灶性缺血模型,术后休息一周,第7 天安装电极,电极安装完成后随机分为模型组和DBS组,每组3 只。
1.2 方法
1.2.1模型制备:采用ET-1定点注射大鼠右侧皮层诱导局灶性脑缺血模型。雄性大鼠用戊巴比妥钠麻醉(1%戊巴比妥钠溶于无菌0.9%氯化钠溶液,43 mg/kg)后,使用立体定位仪(深圳市瑞沃德生命科技有限公司)固定。碘伏消毒大鼠头部中线处皮肤,大鼠中线做切口以暴露颅骨,并在相对于前囟的如下坐标处钻3个小孔:(1)AP(anterior-posterior,前后侧)=-1.0 mm, ML(medial-lateral, 内外侧)=-2.5 mm, DV(dorso-ventral,背腹侧)=-2.3 mm;(2)AP= +1.0 mm, ML=-2.5 mm, DV=-2.3 mm;(3)AP= +3.0 mm, ML=-2.5 mm, DV=-2.3 mm。ET-1溶于无菌0.9%氯化钠溶液中,每孔注入800 pmol/2 μL。术后将大鼠置于37 ℃的加热板上,待从麻醉中醒来,运送回笼子里。
1.2.2小脑外侧核深部电刺激:局灶性脑缺血后第7 天,用戊巴比妥钠麻醉大鼠(1%戊巴比妥钠溶于无菌0.9%氯化钠溶液,43 mg/kg),然后固定在立体定位框架上。碘伏消毒大鼠头部中线处皮肤,大鼠中线做切口以暴露颅骨,在大鼠的小脑外侧核进行打孔,相对于前囟的坐标为:AP=-11.0 mm, ML=+3.6 mm, DV=-6.3 mm安装刺激电极;在大鼠的皮层上方打孔,相对于前囟的坐标为(1)AP=-2 mm, ML=+3.0 mm,DV=-1 mm(2)AP=-2 mm, ML=-3.0 mm,DV=-1 mm安装记录电极,(3)AP=-8 mm, ML=-2 mm,DV=0 mm安装基线和地线。安装完成后用牙托水泥进行固定[11]。DBS组每天给予8 h的30 Hz电刺激,连续14 d。
1.2.3电生理记录:分别在缺血模型后第7和21天,进行诱导局部场电位记录。戊巴比妥钠麻醉大鼠后(1%戊巴比妥钠溶于无菌0.9%氯化钠溶液,43 mg/kg),刺激大鼠的左前肢10 s一次,重复30 次(10 hz,2.5 mA,3 次脉冲电流,每次脉冲刺激包括:刺激2 ms,延迟32 ms,刺激2 ms,延迟64 ms),同时采用OmniPlex在体多通道记录系统(Plexon公司)连续记录30次脉冲刺激的局部场电位信号。从第7次刺激开始到第30 次的每次刺激之后的0.5~9 s进行分析。同时分析了每个频带信号的患侧-健侧功率比:Theta(3~10 Hz), Alpha(8~14 Hz), Beta-1(15~20 Hz), Beta-2(20~35 Hz)和Gamma(35~90 Hz)。

2 结果
2.1 LCN DBS 对诱发皮层LFP平均功率的影响
ET-1定点注射诱导皮层缺血7和21 d,患侧皮层的诱发神经元活性显著降低,约为健侧皮层的37.8%和41.5%(P<0.001,P<0.01)(图1)。给予14 d LCN DBS治疗后,患侧皮层平均功率虽然低于健侧水平(P<0.001),但比刺激前显著增加86.8%(P<0.001),比模型组21 d的患侧平均功率增加79.2%。给予14 d LCN DBS治疗后,刺激后健侧相较于刺激前也有所增加(P<0.01)(图2)。

图1 缺血后7、21 d模型组和DBS组的代表性局部场电位图
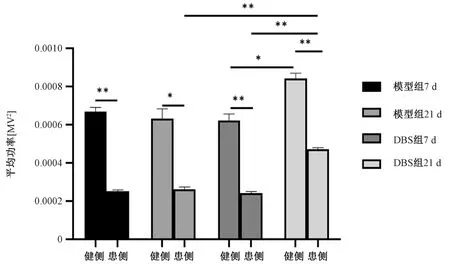
注:*P <0.01,**P<0.001
2.2 LCN DBS 对不同频带LFP功率的影响
模型组各波段的患侧/健侧功率比值缺血后21 d与缺血7 d相比没有统计学差异(P>0.05)。而DBS治疗后,Theta波、Alpha波和Beta-1波患侧/健侧功率比值与治疗前相比均有显著提高(P<0.05,P<0.01),表明DBS对这些波段神经兴奋性有改善作用。Beta-2波和Gamma波组间无显著差异,表明DBS对其无明显作用(图3)。
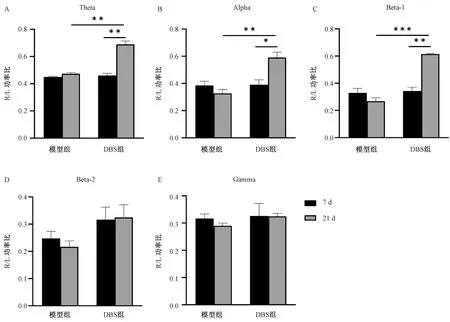
注:A.Theta波(3~10 Hz);B.Alpha波(8~14 Hz);C.Beta-1波(15~20 Hz);D.Beta-2波(20~35 Hz);E.Gamma波(35~90 Hz),*P<0.05,**P<0.01,***P<0.001
3 讨论
DBS是一种新型神经调节方式,需要在脑实质中植入刺激电极,通过所连接的脉冲发生器调节,将电脉冲传递到目标大脑结构,用来调节局部和远程功能失调的大脑回路[11]。DBS的电刺激传递是可逆的和可编程的,刺激模式可以是连续的或间歇的,刺激参数(频率、脉宽、电压)可调,刺激位点范围广泛,几乎在大脑的任何地方使用[3]。因此,DBS目前作为一种安全有效的运动障碍治疗方法,在帕金森病、特发性震颤和肌张力障碍等疾病治疗中有很好的临床应用[12]。研究表明,DBS对减轻卒中后疼痛、肌张力障碍、痉挛等也有较好的效果[12]。但是目前DBS在改善卒中运动功能方面的研究较少。另外,DBS刺激靶点的选择对于疾病至关重要。神经影像学和电生理学研究已经证实小脑-丘脑-皮层(dentate thalamo cortical,DTC)通路在运动恢复中的重要作用[13]。小脑外侧核作为该兴奋性通路的起点,将兴奋性神经输出经丘脑发送到对侧运动皮层区,包括初级运动区和腹侧前运动皮层,以及非运动区背外侧前额叶皮层[13]。有研究发现对LCN进行光遗传学刺激可以持续性恢复卒中后运动功能[6]。最近的一项回顾性研究发现有13 位卒中后运动障碍患者在LCN DBS治疗后症状有明显的改善[14]。我们前期研究发现脑缺血后给予30 Hz LCN DBS可促进SVZ内源性神经发生改善大鼠运动功能,也进一步证实LCN很有可能作为卒中DBS治疗改善运动功能的靶点[7]。
电生理研究在DBS治疗中评价神经元功能至关重要。脑内LFP通过记录电极周围群体神经元放电活动-突触跨膜电流产生的细胞场势,来直观衡量大脑神经元活性,反映神经网络中高度动态的信息流动,为疾病机制和认知过程提供更有价值的见解[15]。本研究采用电生理采集系统记录大鼠双侧运动皮层LFP信号,考察电刺激小脑外侧核对皮层神经元兴奋性的影响。有研究显示ET-1诱导局灶性脑缺血损伤后,梗死周围区域的平均神经元活动衰减约50%[16]。本研究结果显示,在ET-1注射诱导局灶性脑缺血后7和21 d,患侧的LFP显著低于健侧,提示局灶性脑缺血导致神经元活动衰减,与之前报道一致。给予对侧LCN DBS 刺激,患侧皮层LFP显著升高,表明LCN DBS具有增强神经元活性的作用。LCN DBS也导致电刺激同侧运动皮层LFP的升高,表明电刺激激活DTC通路兴奋性传导在大脑半球之间存在交联。神经元活动复杂,具有频谱特异性,不同的震荡频率具有不同的功能。因而我们用基于不同频带来分析LFP结果,将能更好地理解DBS治疗的机制。Theta波(3~10 Hz)和alpha波(8~14 Hz)都属于低频波段,称为低频波(low frequency,LF)[16]。LF通常被认为与认知和情绪有关,包括冲突判断、经济决策、冲动控制、奖励相关加工、记忆功能、注意和意识、模糊感知辨别、言语生成和抑郁[17]。此外,LF也被发现与运动障碍相关[18]。本研究也发现LCN DBS刺激后LF的功率上升,这与运动功能改善相一致。Beta波一般被划分为高Beta波(Beta-1,15~20 Hz)和低Beta波(Beta-2,20~35 Hz)。Beta-1波通常被认为与步态障碍有关,本研究发现LCN DBS刺激后Beta-1得到改善[19]。Beta-2波通常被认为与力量有关,LCN DBS刺激则对其没有作用[20-22]。Gamma波通常被认为与神经元的异常放电有关,在本研究中也对LCN DBS不敏感[23]。我们前期证实LCN DBS能增加面条矩阵抓取任务中大鼠前肢抓取面条数量和扩大在矩阵的分布,减少不规则水平梯子行走实验和网格漏空实验中错误步数,增强内源性神经干细胞增殖和分化,缩小梗死体积[7]。本研究中LCN DBS对LFP不同波段功率的影响与改善运动功能的作用相吻合,为LCN DBS治疗脑缺血后运动功能障碍提供客观证据,同时该研究也为运动功能的客观评价提供可靠的方法。
综上可见,ET-1定点注射诱导局灶性脑缺血后,皮层局部场电位降低,神经元活动减弱,而LCN DBS激活DTC通路对皮层神经元的兴奋性有改善作用。结合前期行为学研究和组化研究结果,LCN DBS很可能成为治疗卒中运动功能障碍的有效方法。LFP只能采集局部皮层下神经元电活动的情况,我们后续将采用磁共振成像分析等技术进一步完善神经纤维追踪,构建LCN DBS治疗的神经网络图谱,更好地理解DBS改善运动功能的机制。

