胃肠道双向分化癌2例临床病理特征及文献复习
杨钰斌,吴春林*
(福建医科大学附属第二医院病理科,泉州 362000)
双向分化癌(amphicrinecarcinoma, AC)是一种特殊的具有双向分化特性的恶性肿瘤[1],定义为同一肿瘤细胞同时具有腺和神经内分泌分化的特征,且免疫组织化学染色证实这类肿瘤表达腺和神经内分泌标志物。多年来因为这类病变不同命名表述,其分类较混乱,常诊断错误。明确AC诊断条件及分级标准,有助于其精准治疗。本文回顾性分析2例胃肠道双向分化癌,探讨其临床病理特征、诊断、分级及鉴别诊断。
材料与方法
1 临床资料
收集2012年1月—2022年5月福建医科大学附属第二医院收治的2例胃肠道AC患者的临床病理资料。例1,男,82岁,以反复排便困难伴便后滴血1月为主诉入院;肛门指诊:距肛缘约2 cm,位于肛管左侧壁可扪及一质硬肿块;内镜:直肠肿物;病检示腺癌;实验室肿瘤标记物:糖类抗原19-9升高(30.05 U/mL,正常0~28 U/mL),甲胎蛋白、癌胚抗原正常;术中肿瘤位于腹膜返折水平下方约5 cm,大小5 cm×4 cm×3 cm,累及肠壁一周,质地较硬,侵出及浆膜层,周围组织轻度水肿。例2,男,78岁,以上腹部闷痛1月余为主诉入院,呈持续性疼痛,阵发性加剧,伴呃逆、反酸;内镜:胃窦部癌并幽门梗阻;病检示腺癌,形态较符合黏液腺癌,部分为印戒细胞癌;CT检查示:①左肺及右肺中上叶多发微小结节及小结节,建议随诊;②胃窦部胃壁不均增厚伴周围多发淋巴结,符合恶性病变改变;③肝内多发结节样低密度灶。实验室肿瘤标记物:癌胚抗原、糖类抗原19-9正常。
2 HE、免疫组织化学染色和组织化学染色
直肠及胃大部切除标本各1例经4%甲醛固定、石蜡包埋、4 μm厚切片,HE染色。免疫组织化学染色采用EnVision二步法。MLH1、PMS2、MSH2、MSH6、CDX-2、P53、Syn、CK(L)、CK7、CD56、CgA等抗体均购自福州迈新生物技术开发有限公司即用型抗体。过碘酸雪夫(periodic acid-Schiff stain,PAS)染色检测中性和酸性黏液,阿尔新兰(Alcian blue, AB)染色检测中性黏液,PAS和AB试剂盒均购自福州迈新生物技术开发有限公司。
结果
1 病理特征
大体观察:例1,直肠一溃疡型肿物,大小约4 cm×2.3 cm×1.5 cm,占据1/3管周,切面灰白,质中,无包膜,界不清,侵及全层,累及齿状线。例2,胃窦小弯处溃疡型肿物,大小5 cm×3.5 cm×1 cm,肿物表面出血坏死,暗褐色,较粗糙,切面灰白,质中,无包膜,界不清,周边呈蟹足状浸润,侵及全层。
显微观察:例1肿瘤呈腺样、筛状、巢状结构,可见明显细胞内外黏液(图1A),例2在黏液背景中见印戒样细胞(图1B);2病例肿瘤细胞染色质细腻,可见核仁,周围可见淋巴细胞浸润;例1可见1枚淋巴结转移,例2可见7枚淋巴结转移,淋巴结转移灶形态与原发灶一致;例1肿瘤TNM分期为pT3aN1aM0,ⅢB期,例2肿瘤TNM分期为pT4aN3aM1,Ⅳ期。
2 免疫组织化学与组织化学表型
免疫组织化学染色显示:直肠AC显示CDX-2(+)(图1C),CK(L)(+),Syn(+)(图1D),CD56(+),CgA(少量+),P53(弥漫+),Ki-67约70%;胃AC 显 示 CK7(+),Syn(+),CD56(+),CgA(-),P53(弱 +,5%),Ki-67约 80%;两者MLH1、PMS2、MSH2、MSH6、CD44均(+)。组织化学染色:两例病例PAS、AB均(+)(图1E, 1F)。
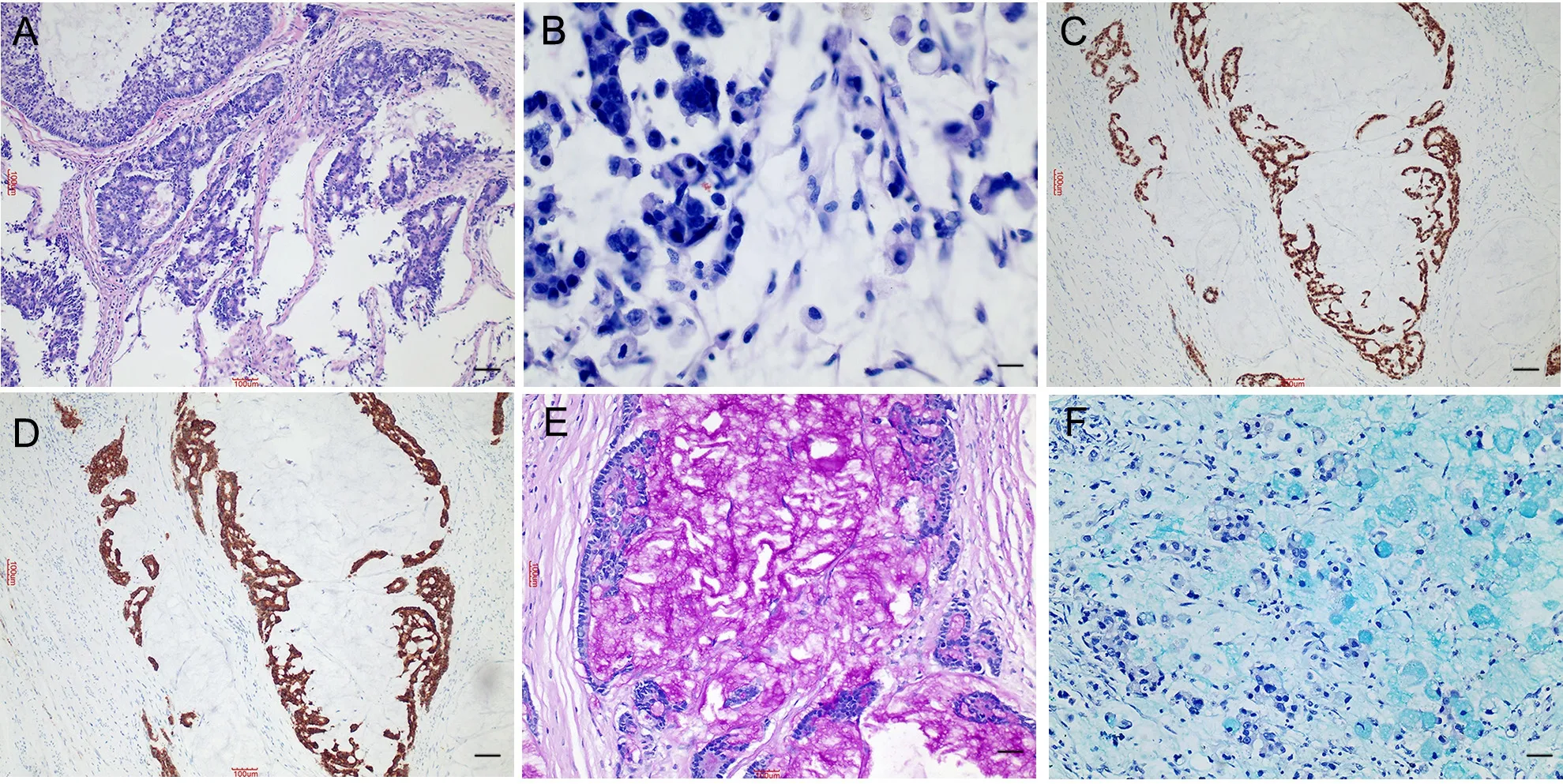
图1 双向分化癌组织病理学、免疫组织化学与组织化学检测。A,HE染色,肠AC肿瘤呈筛状、巢状结构,可见明显细胞外黏液;B,HE染色,胃AC肿瘤在黏液背景中见印戒细胞样细胞;C,肠AC标本CDX-2免疫组织化学染色阳性;D,肠AC标本Syn免疫组织化学染色阳性;E,肠AC标本PAS染色阳性;F,胃AC标本AB染色阳性。比例尺,A、C和D,100 µm;B,25 µm;E和F,50 µmFig.1 Histopathological, immunohistochemical and histochemical examination of amphicrine carcinoma.A, HE staining, rectal amphicrine carcinoma showed a cribriform, nest-like structure with obvious extracellular mucus; B, HE staining, gastric amphicrine carcinoma had signet ring-like cells in mucus; C, positive CDX-2 immunohistochemical staining of rectal amphicrine carcinoma; D, positive Syn immunohistochemical staining of rectal amphicrine carcinoma; E, positive PAS staining of rectal amphicrine carcinoma; F, positive AB staining of gastric amphicrine carcinoma.Scale bar, 100 μm in A, C and D; 25 µm in B; 50 µm in E and F
3 治疗及随访
2例均行手术治疗,例一行腹腔镜腹会阴联合直肠癌根治术,例二行腹腔镜胃大部切除伴胃空肠吻合术,肝转移瘤微波消融术。例一患者术后1个月并发肠坏死、肠穿孔、休克,死亡。例二术后随访3月发现CEA轻度升高(8.57 ng/mL,正常≤5.2 ng/mL),并给予替吉奥+替雷利珠单抗联合化疗。
讨 论
1924 年,Cordier[2]首次报道了同时具有外分泌和神经内分泌的胃肠道肿瘤。1987年,Lewin[2]对腺-神经内分泌细胞癌的混合或复合肿瘤进行系统分类,分为碰撞瘤、复合瘤和双向分化肿瘤3大类。中国胃肠胰神经内分泌肿瘤病理诊断共识(2020版)[3]建议在常规诊断时予以重视。2022年WHO神经内分泌系统认为AC是具有独特生物学和组织学特征的临床病理学实体。目前用于描述胃肠道双向分化肿瘤的术语包括杯状细胞类癌、杯状细胞腺癌、双向分化肿瘤和双向分化癌[4]。AC最常见于阑尾,其他地方少见如胃、胰腺、肺、肝脏[5,6]、胆囊[7]等。
1 起源
关于混合肿瘤的起源和发展主要有2种理论[2]:①来源于共同的多能干细胞,在癌变过程中获得双表型;②起源于共同的单克隆细胞,它们在同一细胞中表达外分泌和神经内分泌成分[8]。本组2例AC淋巴结转移性癌细胞与原发灶组织形态学相同,一致表达Syn和CD56。肿瘤干细胞标记CD44免疫反应阳性表明双向分化癌具有干细胞的特性。
2 病理学特征
所有AC病例均符合以下诊断标准[6]:①单个肿瘤细胞群;②基于光学显微镜检查,具有腺癌的肿瘤形态且让人联想到神经内分泌癌,其特征是具有嵌套或小梁、或类器官模式,染色质细腻;③免疫组织化学显示肿瘤细胞腺癌标记阳性且神经内分泌标记的弥漫性或非局灶性反应。肿瘤胞浆内和胞外均产生粘蛋白,部分可见大量细胞外黏液,可见印戒细胞[9]。肿瘤细胞表现出“椒盐”染色质,明显的嗜酸性至两性大核仁。可见有丝分裂象和坏死[7]。腺癌标记主要为低分子量角蛋白及AB、PAS染色。常规神经内分泌标记弥漫强阳性表达,主要有突触体素(synaptophysin, Syn)、嗜铬素A(chromogranin A,CgA)、胰岛素瘤相关蛋白1(insulinoma associated protein 1, INSM1)和CD56。研究表明[5]双向分化癌生长抑素受体2(somatostatin receptor 2, SSTR2)均为阴性。本组病例1以腺样、巢状生长为主,病例2以印戒细胞生长为主。2例病例除明显腺癌形态外,染色质均较细腻,具有神经内分泌癌的部分特征,且免疫组织化学弥漫强表达Syn和CD56,符合双向分化癌的诊断。超微结构分析证实,肿瘤细胞质内含有粘液蛋白和神经内分泌颗粒[10]。数量不等的神经内分泌颗粒主要浓聚于细胞血管极,粘蛋白颗粒主要位于腺腔或胞浆内腔。因此AC是双向分化的肿瘤[11]。
3 组织学分级
Huang等[4]建议胃肠AC参照阑尾杯状细胞腺癌的分级系统,主要基于低级别和高级别肿瘤的占比。1级肿瘤由<75%的低级别肿瘤和< 25%的高级别成分组成。2级肿瘤由50%至75%的低级别肿瘤组成,其余为高级别成分的任意组合。3级肿瘤具有<50%的低级别肿瘤,其余为高级别成分的任意组合。低级别AC肿瘤细胞排列成离散的小管或筛状结构,或有限的小管融合或细胞簇,缺乏单个细胞的浸润,肿瘤细胞异型性小,核质比较低,核分裂象少见,部分病例可有细胞外黏液。高级别AC肿瘤细胞异型性明显,核分裂象易见,主要呈不规则簇状、片状及条索样浸润,或呈印戒样,部分肿瘤细胞内可缺乏黏液,类似于普通腺癌的高级别细胞形态[1,5],可出现增生性间质反应。部分文献认为高级别AC 的Ki-67 阳性指数平均为52%, 低级别AC的平均值22%, 可作为分级的参考。建议将分级系统加入诊断报告中。本组2例病例高级别肿瘤成分均>75%,分级均为3级。
4 分子学特征
与腺癌、神经内分泌癌比较:Huang等[4]研究比较了胃AC、胃腺癌及胃神经内分泌肿瘤mRNA表达水平,热点图显示AC患者聚集类型与腺癌相似,而与神经内分泌癌不同。AC亦与腺癌表现出相似的基因突变谱,如BRAF、KRAS、APC、ATM、SBXW7、PTEN、SOX9等[12]。但是部分文献[5]也证明AC与腺癌相关癌基因表达存在差异。
与混合性神经内分泌-非神经内分泌肿瘤比较:Sun[13]等人基于层次聚类分析,认为胃AC的拷贝数特征与混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasms, MiNEN)不同,支持AC与MiNEN是不同肿瘤。
与阑尾杯状细胞腺癌比较:阑尾杯状细胞腺癌的分子病理学改变更接近腺癌[12]。癌变机制表现为所有病例微卫星稳定,TP53、KRAS、SMAD4和APC等基因很少或没有突变[3]。
低级别AC与高级别AC比较:在有限的队列中,低级别和高级别肿瘤中表现出相似的mRNA表达水平[1,4]。
分子通路:通过研究90个基因的mRNA表达水平,热点图显示胃AC突变最明显的12个基因中10个是以VEGFA为节点,推测胃AC主要与VEGFA介导的肿瘤信号通路相关[1]。
5 鉴别诊断
碰撞瘤:碰撞瘤在同一器官分别发生神经内分泌肿瘤和非神经内分泌肿瘤,两者界限清楚,且两种肿瘤细胞无混合。
混合或复合瘤:这类肿瘤同时存在非神经内分泌肿瘤和神经内分泌肿瘤,两者互相混合且可区分,例如MiNEN。
腺癌伴神经内分泌分化或伴syn表达:该肿瘤细胞未见神经内分泌形态特征且神经内分泌表达较弱或<30%阳性表达[6]。
6 治疗
目前尚缺乏AC治疗的共识意见,也缺乏免疫治疗的相关资料,临床上主要参照腺癌进行治疗[3]。本组病例2按“替雷丽珠单抗 200 mg+替吉奥60 mg”方案治疗后,病情得到短暂控制。目前患者口服化疗药物加免疫治疗过程顺利,无明显免疫治疗副反应,患者已无病生存6个多月。
7 预后
肿瘤预后与分级和分期相关[3]。组织学分级是独立于分期的预后因素,Huang等[4]对10例胃肠AC的研究发现所有死亡病例均来自高级别组。肿瘤分期也与总生存期密切相关[14]。本组病例1确诊1月后死亡,表现出AC较高的侵袭性。
总之,双向分化癌表现为同一肿瘤细胞同时具有腺和神经内分泌分化的特征。诊断主要依赖于组织学形态及免疫组织化学检测。准确的诊断及病理学分级是精准治疗的前提。手术完整切除及术后合理的化疗方案有助于延长患者生存时间。目前尚需要更多的病例报道以提高对该病的认识。

