超声预处理对大豆分离蛋白-儿茶素非共价/共价复合物结构及功能的影响
代世成,连子腾,马林智,佟晓红,田 甜,亓伟杰,彭潮勇,范宇航,王 欢,2,*,江连洲,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江省北大荒绿色健康食品有限责任公司,黑龙江 佳木斯 154000)
大豆分离蛋白(soybean protein isolate,SPI)是一种重要的植物蛋白,由于营养价值高、生产成本低、具有优良的生物相容性以及加工特性,广泛应用于食品工业、农业、生物技术等领域[1],一直以来是学者们的研究热点。由于多酚类物质如茶多酚、花青素、槲皮素等小分子多酚具有较强的抗炎、抗菌以及抗氧化性,可以清除人体自由基,减轻炎症反应,从而起到预防心血管疾病的作用[2]。因此,近年来大量研究人员研究蛋白质与多酚相互作用及其复合物的功能性质。两者之间的相互作用对食品的生产和营养价值起着重要作用,主要分为非共价(可逆)和共价(不可逆)相互作用[3],其中非共价相互作用主要是蛋白质上的氢原子受体和多酚的酚羟基结合形成氢键,蛋白质上的某些氨基酸基团或残基也会和酚羟基或者苯环结合形成离子键、疏水作用、范德华力等。而共价相互作用主要是多酚可以在碱性或者氧化酶存在的条件下,氧化生成醌类物质,与蛋白发生亲核加成反应形成共价复合物(亲核基团包括氨基、巯基、或者某些氨基酸残基)[4]。
儿茶素是一类属于黄酮类的多酚类化合物,是茶多酚的主要成分,可以通过预防各种疾病来改善人体健康。Jia Zhenbao等[5]研究发现乳清蛋白通过与儿茶素共价交联,可以引起蛋白质二级和三级结构发生变化,并增强蛋白的起泡性。Chen Gang等[6]发现茶多酚与大豆蛋白通过非共价相互作用可以提高大豆蛋白的溶解度。Zhou Siduo等[3]通过向SPI中添加表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)制备出SPI-EGCG非共价/共价复合物,发现EGCG可以改变SPI的二级结构,生成的共价复合物比非共价复合物更稳定。
超声是一种较强的物理处理方法,能改变蛋白质分子结构,破坏蛋白质分子内键,对其溶解性有一定影响[7]。另一方面,超声处理在食品中可用于辅助提取、灭菌、乳化、结晶、干燥等,主要是利用超声波的空化作用、机械效应及热效应对食品的结构和功能产生影响[8]。Jambrak等[9]通过高强度超声处理乳清蛋白降低蛋白的分子质量,增加其溶解度。Li Yihe等[10]发现超声可以改变蛋白的二级结构,提高菜籽蛋白的功能性质,这种变化在碱性条件下尤为明显。
目前研究多集中于超声改性蛋白以及多酚非共价/共价改性蛋白,但超声与多酚联合改性蛋白却少有报道。因此,本实验为探究超声联合多酚改性对蛋白结构及功能的影响,SPI经超声处理后,在pH 3、7、9、12的条件下制备了SPI-儿茶素非共价/共价复合物,比较其溶解性、起泡性和抗氧化性等功能性质,并通过荧光光谱、傅里叶变换红外光谱和分子对接技术解析SPI-儿茶素的相互作用及对结构的影响,以期为超声联合酸/碱处理在蛋白改性领域以及大豆蛋白-多酚复合物作为功能性食品成分的应用提供研究依据和理论参考。
1 材料与方法
1.1 材料与试剂
脱脂豆粕 哈尔滨益海嘉里粮油食品工业有限公司;儿茶素(绿茶,纯度>98%)、考马斯亮蓝G250、牛血清白蛋白 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazine,DPPH)、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、磷酸盐缓冲液(干粉) 北京索莱宝科技有限公司;5×上样缓冲液、电泳液(Tris-Gly)、彩色预染标准分子质量蛋白(10~170 kDa)、Plus PAGE预制胶(Tris-Gly,预制胶质量分数4%~20%,10 孔) 上海碧云天生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平 梅勒特-托利多仪器(上海)有限公司;PHS-3C型实验室pH计 上海仪电科学仪器股份有限公司;F-6000荧光分光光度计 日本Hitachi公司;TU-1800 紫外-可见分光光度计 北京普析通用仪器有限责任公司;Allegra64R台式高速冷冻离心机 美国贝克曼公司;IRTracer-100傅里叶变换红外光谱仪 日本岛津公司;电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
根据Li Yang等[11]的方法。将脱脂豆粉与去离子水按照1∶10(m/V)比例混合后,调节pH值为8.0搅拌,9 000×g离心30 min,取上清液并调节pH值为4.5。静置2 h后6 000×g离心20 min得到蛋白沉淀,用去离子水洗涤至溶液pH值为7.0,冻干得到SPI粉末,使用杜马斯定氮仪测定蛋白质量分数为(92.26±0.36)%。
1.3.2 大豆分离蛋白超声预处理条件的确定
1.3.2.1 超声功率的确定
将SPI按照1∶100(m/V)比例溶于磷酸盐缓冲液(pH 7.4、10 mmol/L,后同)中进行超声处理,将超声探头插入距离溶液底部1 cm处,在冰浴(0 ℃)下超声,总超声时间为10 min(处理5 s,间隔5 s),功率分别为100、200、300、400、500 W。参照Zhang Yezhong等[12]的方法,将SPI稀释50 倍(蛋白质量浓度为0.02 mg/mL),用F-6000荧光分光光度计进行荧光光谱的测定,参数设定:λEx为280 nm,λEm为300~500 nm,增长间隔为1 nm,扫描速率为600 nm/min。选择光谱荧光强度峰值最大的处理功率作为超声预处理功率。
1.3.2.2 超声时间的确定
将SPI按照1∶100(m/V)比例溶于磷酸盐缓冲液中进行超声处理,在1.3.2.1节优化后的超声功率下处理(处理5 s、间隔5 s),时间为2、5、10、15、20 min。测定样品的荧光光谱,方法同1.3.2.1节,确定最佳超声预处理时间。
1.3.3 SPI-儿茶素复合物的制备
SPI-儿茶素非共价/共价复合物的制备方法参考文献[4]。
非共价复合物的制备:将SPI按照1∶100(m/V)比例溶解于磷酸盐缓冲液中,按照1.3.2节的方法进行超声预处理,超声处理过的蛋白记为USPI,未超声处理的蛋白记为NUSPI,以NUSPI和USPI为对照组,分别量取100 mL不同溶液调节pH值至3.0和7.0,加入适量儿茶素粉末室温下避光搅拌24 h,制得不同pH值下的USPI、NUSPI与儿茶素复合物,分别记为pH3NUSPI-C、pH3USPI-C、pH7NUSPI-C、pH7USPI-C。
共价复合物的制备:将SPI按照1∶100(m/V)比例溶解于磷酸盐缓冲液中,按照1.3.2节的方法进行超声预处理,分别量取100 mL USPI、NUSPI溶液调节pH值至9.0、12.0,加入适量儿茶素粉末室温下避光搅拌24 h,制得不同pH值下的USPI、NUSPI与儿茶素的复合物,分别记为pH9NUSPI-C、pH9USPI-C、pH12NUSPI-C、pH12USPI-C。
1.3.4 傅里叶变换红外光谱分析
参考文献[13]的测定参数,用IRTracer-100傅里叶变换红外光谱仪对样品在波数范围4 000~400 cm-1,分辨率为4 cm-1条件下测定红外光谱。光谱图利用Peakfit 4.2.0软件进行处理,利用积分面积计算各二级结构的相对含量[14]。
1.3.5 荧光光谱分析
所有样品稀释50 倍,用F-6000荧光分光光度计进行荧光光谱的测定,方法同1.3.2.1节。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定
根据Laemmli等[15]的方法稍作修改,利用SDS-PAGE测定样品的分子质量,分析SPI和儿茶素的结合情况。使用BeyoGel™ Plus PAGE预制胶(Tris-Gly,预制胶质量分数4%~20%,10 孔),将SPI及SPI-儿茶素复合物与上样缓冲液混匀煮沸5 min,冷却至室温后上样,采用彩色预染蛋白标准分子质量标准蛋白作为标准蛋白,上样质量浓度为2 mg/mL,上样量为10 μL。电泳过程中维持100 V恒压1 h直至指示条带迁移至底,电泳结束后用BeyoBlueTM考马斯亮蓝超快染色液对凝胶进行染色,随后脱色并拍照观察。
1.3.7 蛋白质溶解度测定
参考Shimada等[16]的方法稍作修改,将样品溶液在10 000×g条件下离心20 min,取上清液稀释,采用Lowry法测定样品中可溶蛋白质含量,采用凯氏定氮法测定样品总蛋白含量。用牛血清白蛋白为标准品绘制标准曲线,按式(1)计算蛋白质溶解度。

1.3.8 浊度测定
参考Martini等[17]的方法,室温下,将所有样品稀释2 倍(蛋白质量浓度为5 mg/mL)后用TU-1800 紫外-可见分光光度计在600 nm波长处测定吸光度。
1.3.9 起泡性及泡沫稳定性测定
参照Aewsiri等[18]的方法。样品用高速均质机以12 000 r/min均质2 min,将泡沫全部倒入量筒中,并记录初始泡沫体积以及在室温下静止15 min后的泡沫体积,分别按式(2)、(3)计算起泡性和泡沫稳定性。

式中:V是均质前溶液体积/mL;V0是均质后的起始泡沫体积/mL;V1是均质后静止15 min的泡沫体积/mL。
1.3.10 抗氧化性测定
根据Gong Ying等[19]的方法测定样品的DPPH自由基清除能力。2 mL样品(蛋白质量浓度为0.05 mg/mL)加入2 mL DPPH溶液(吸光度为0.7~1.0),混匀,空白组用等体积去离子水替代样品溶液,避光反应30 min,用TU-1800紫外-可见分光光度计在517 nm波长处测定吸光度,按式(4)计算DPPH自由基清除率。

式中:A1为实验组;A0为空白组。
根据Zhou Siduo等[3]的方法测定样品的ABTS阳离子自由基清除能力。0.5 mL样品(5 mg/mL)加入2 mL ABTS溶液(吸光度为0.70±0.02),混匀,空白组用等体积去离子水替代样品溶液,避光反应6 min,用TU-1800紫外-可见分光光度计测定734 nm波长处吸光度,按式(5)计算ABTS阳离子自由基清除率。

式中:A1为实验组;A0为空白组。
1.3.11 分子对接
参考Wang Qiming等[20]的方法稍作修改。11S蛋白、7S蛋白的晶体结构取自蛋白质数据库PDB(Protien Date Bank)(11S蛋白编码为2D5F;7S蛋白编码为3AUP)。通过ChemBio Draw U1tra 14.0、Chem 3D、Pymol软件进行前处理,采用AutoDock Tools-1.5.6软件进行分子对接,通过Pymol软件对分子对接结果进行处理。
1.4 数据处理与分析
以上实验重复3 次,结果采用平均值±标准差表示,利用SPSS 26软件进行单因素方差分析,采用Duncan检验进行显著性分析,P<0.05为差异显著。采用Origin 2019b 32bit软件绘图。
2 结果与分析
2.1 超声对SPI结构的影响
由于蛋白质和多酚结合过程实质是蛋白的侧链基团(如色氨酸)和多酚小分子的官能团(如酚羟基)发生非共价/共价结合,可以通过荧光分光光度计测定色氨酸的数量来确定SPI内部结构的打开程度以及SPI与儿茶素的结合程度[21]。本征荧光光谱在激发波长为280 nm处可以反映蛋白质内部色氨酸的荧光强度变化,大量色氨酸存在于SPI的内部疏水区域,当荧光强度上升,说明蛋白内部暴露的色氨酸基团增多[22]。如图1A所示,当固定超声时间5 min,经过不同功率超声处理后,SPI的荧光强度明显增强,其中超声功率为500 W处理的荧光强度提升最大。如图1B所示,当固定超声功率为500 W,经过不同时间超声处理,发现5 min的条件下荧光强度提升最大,说明在500 W、5 min的超声处理条件下SPI结构打开程度最为明显,色氨酸基团暴露最多[22]。同时也说明超声处理可以促进蛋白内部疏水区域的打开。
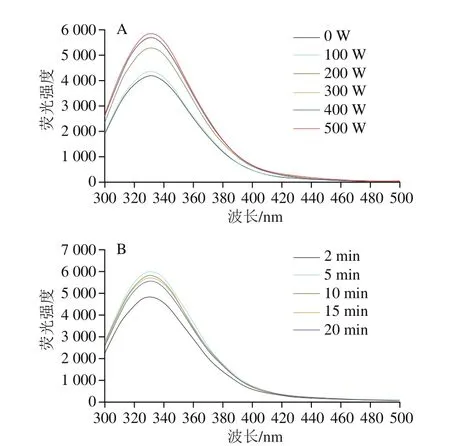
图1 不同超声功率(A)、不同超声时间(B)的SPI荧光光谱Fig.1 Fluorescence spectra of SPI treated at different ultrasonic powers (A) and for different periods of time (B)
2.2 pH值对蛋白质-儿茶素复合物二级结构的影响
傅里叶变换红外光谱被广泛用来表征蛋白质的二级结构[23],图2为超声预处理的SPI在不同pH值下与儿茶素形成复合物的傅里叶变换红外光谱图。经过不同条件处理后,其酰胺I带(1 600~1 700 cm-1)发生较为明显的改变,其变化主要归因于C=O拉伸振动、N—H的弯曲和C-H的拉伸振动,酰胺I带吸收峰向低频方向移动,可能是蛋白质经超声处理后分子内缔合形成氢键所致[24]。样品傅里叶变换红外光谱拟合的二级结构相对含量如表1所示,与NUSPI相比,超声后的蛋白α-螺旋和β-折叠相对含量显著减少,β-转角和无规卷曲相对含量显著增加(P<0.05),说明超声导致SPI的结构变得更加松散且无序。伴随着儿茶素的加入以及pH值的改变,得到的复合物中也观察到了相似的趋势,大量的α-螺旋和β-折叠转化为β-转角和无规卷曲,尤其是在pH 12和超声处理的条件下最为显著(P<0.05),其中,pH12USPI-C样品的β-转角相对含量增加至40.20%,无规卷曲相对含量增加至28.61%,该处理使SPI结构变得更加松散和舒展,从而使蛋白肽链内部的疏水基团和极性基团暴露于表面,增大了SPI与儿茶素的相互作用程度[22]。

图2 不同pH值的SPI及SPI-儿茶素复合物的傅里叶变换红外光谱Fig.2 FTIR spectra of SPI and SPI-catechin complexes formed at different pHs

表1 不同pH值下超声预处理的SPI及SPI-儿茶素复合物的二级结构相对含量Table 1 Secondary structures of SPI and SPI-catechin complexes pretreated by ultrasound at different pHs
2.3 pH值对蛋白质-儿茶素相互作用的影响
本实验通过本征荧光光谱考察SPI内部色氨酸的荧光强度变化,来研究蛋白内部结构的变化以及蛋白和儿茶素的结合程度。当色氨酸在蛋白质内部没有暴露出来时,荧光强度较低,荧光峰位会发生蓝移,当蛋白质结构展开色氨酸暴露出来时,荧光强度增加并发生红移[25]。如图3所示,与NUSPI相比,超声后的SPI荧光强度增加,可能是由于超声产生的空化作用改变了蛋白质分子内部的极性微环境,使蛋白结构变得疏松,蛋白质内部的色氨酸暴露出来导致荧光强度增加[26]。随着儿茶素的加入以及pH值的增加,复合物的荧光强度下降程度逐渐增大,与NUSPI-C组比较,USPI-C复合物的荧光强度下降更大,且共价结合作用下的荧光强度下降更为明显,其中pH 12下的USPI-C复合物下降最明显,与NUSPI相比荧光强度降低了89.16%,同时发生了明显的红移(5 nm),这可能是由于超声处理过使SPI内部疏水区域打开,结构变得松散,儿茶素与蛋白在碱性条件下产生不可逆的共价作用大大降低了色氨酸含量,色氨酸的侧链氨基(—NH2)与儿茶素的C发生共价交联生成C—N共价键,使得部分色氨酸基团被掩盖,改变了色氨酸附近的疏水环境,降低了荧光强度[27]。
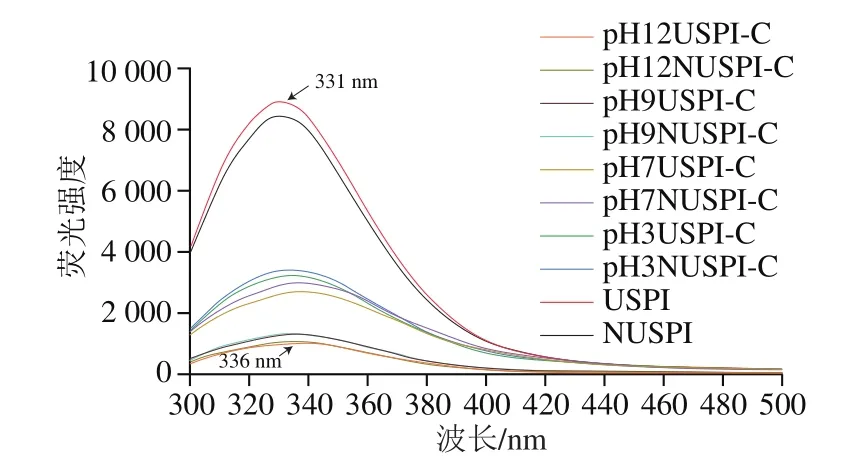
图3 不同pH值的SPI及SPI-儿茶素复合物的荧光光谱Fig.3 Fluorescence spectra of SPI and SPI-catechin complexes formed at different pHs
2.4 pH值对蛋白质-儿茶素复合物分子质量的影响
利用电泳图可以观察复合物的分子质量以及SPI结合儿茶素的程度,图4为不同pH值下超声预处理的SPI及SPI-儿茶素复合物的SDS-PAGE图。

图4 不同pH值的SPI及SPI-儿茶素复合物的SDS-PAGEFig.4 SDS-PAGE images of SPI and SPI-catechin complexes formed at different pHs
如图4所示,样品1与样品2没有明显差异,表明500 W超声对SPI的亚基成分影响较小。样品7~10的分离胶顶部有黑色条带出现,说明有新的复合物生成,其中样品8和样品10(USPI-C)最顶部条带较样品7、9(NUSPI-C)颜色更深,可能是因为超声后的SPI内部结构打开,结合位点增加,促进了与儿茶素结合,样品10可能是因为SPI经过超声和碱处理后结构打开程度更明显,结合了更多的儿茶素,形成了更强的共价交联,结果表明SPI与儿茶素发生共价交联生成了共价复合物。样品3和4可能是由于在pH 3下制备,可溶性蛋白质量浓度较低导致电泳条带颜色较浅,样品3~6并未形成新的条带,表明在pH 3和pH 7条件下SPI和儿茶素未发生共价交联,未改变蛋白质的四级结构[4]。
2.5 pH值对蛋白质-儿茶素复合物溶解度的影响
蛋白质的溶解性是蛋白质在食品应用中一个重要的功能特性,因为蛋白质溶解性差可能限制其他功能性质的发挥。蛋白质溶解度取决于某些内在因素(如蛋白质氨基酸组成以及序列)和外在因素(pH值、温度、离子强度)[28]。如图5所示,SPI经超声处理后溶解度显著增加(P<0.05),可能是因为超声使SPI发生裂解形成了更小的粒子,引起蛋白质的比表面积增加,促进了蛋白质与水之间的相互作用,引起蛋白质溶解度增大[8]。而SPI与儿茶素在不同pH值下形成的复合物溶解度差异较大,pH 3时可能由于溶液体系的pH值距离SPI的等电点较近,导致部分蛋白沉淀降低了溶解度[28]。pH 7时溶解度较未处理SPI有所增加,可能是由于儿茶素引入的—OH基团与水分子形成氢键增强了复合物的水合作用。而在pH 9和pH 12条件下,添加儿茶素显著降低了SPI的溶解度(P<0.05),可能是由于在碱性条件下,儿茶素氧化为茶黄素类物质(醌类物质),与SPI侧链形成C-N键形成了网状结构,从而形成了颗粒较大不溶性的复合物,其分子质量也有所增加[29],SDS-PAGE图进一步证实了这一结论。这与Prigent等[30]的发现相似,当pH≥8.0时,绿原酸发生氧化,形成醌类物质,该化合物的存在会导致溶菌酶的溶解度降低。如图5所示,对于同一pH值下的复合物而言,超声预处理会增加其溶解性,可能是因为超声处理过的SPI结构打开程度更大,结合更多儿茶素的同时,也引入了大量的亲水基团(羟基和羧基),因此溶解度增大[31]。

图5 不同pH值的SPI及SPI-儿茶素复合物的溶解度Fig.5 Solubility of SPI and SPI-catechin complexes formed at different pHs
2.6 pH值对蛋白质-儿茶素复合物浊度的影响
浊度分析是一种直观反映蛋白质-儿茶素之间相互作用的方法,浊度的增加可归因于复杂聚集体的数量和尺寸的增加[32]。如图6所示,引入儿茶素后,pH 3、7、9下形成的复合物浊度较SPI显著增大(P<0.05),说明溶液内形成了较大颗粒的物质。溶液在pH 3和pH 7下形成非共价复合物,pH 3的复合物浊度比pH 7高,可能是因为距离SPI等电点较近导致蛋白沉淀。在pH 9和pH 12下形成共价复合物,而pH 12的复合物浊度显著低于pH 9(P<0.05),可能是由于pH 12距离SPI等电点较远。pH 9的复合物浊度较高可能是因为在碱性条件下SPI与儿茶素共价交联形成了粒度较大的网状复合物[33]。而超声预处理显然提高了溶液浊度,可能是因为SPI经过超声后内部结构打开,结合了更多的儿茶素形成了更大分子质量的聚集物[34],SDS-PAGE结果也证实了这一点。

图6 不同pH值的SPI及SPI-儿茶素复合物的浊度Fig.6 Turbidity of SPI and SPI-catechin complexes formed at different pHs
2.7 pH值对蛋白质-儿茶素复合物起泡特性的影响
起泡特性对于许多食品的质量至关重要,比如牛奶、冰淇淋、鲜奶油、蛋糕和面包等[29]。如图7所示,随着儿茶素的添加以及pH值的增大,SPI的起泡性和泡沫稳定性显著增强(P<0.05),蛋白质-儿茶素复合物表现出更高的固有黏度,产生了更稳定的泡沫,可能是因为儿茶素的加入降低了SPI界面的表面压力,使蛋白结构展开与其发生相互作用,令界面薄膜变得更加稳定[35]。碱性条件下儿茶素的添加对于蛋白起泡性比酸性强,这可能是由于共价交联结构可以有效地提高蛋白在气/液表面的展开,形成更多泡沫网络结构,通过抑制蛋白聚集和歧化增强了泡沫的形成,因此起泡性更好。而碱性条件下SPI与儿茶素通过共价键结合形成的具有网状结构的共价复合物更加稳定,因此泡沫稳定性更好[4]。通过SPI超声处理后形成的蛋白质-儿茶素复合物明显比未处理蛋白形成的复合物起泡性和泡沫稳定性更好,可能是因为SPI超声后溶解得更多,结合了更多的儿茶素,从而有利于发挥其起泡性能。Xiong Ting等[36]研究发现与未处理的豌豆分离蛋白相比,超声处理后的豌豆分离蛋白产生的气泡尺寸更小、更均匀,且起泡性优于未处理的蛋白。
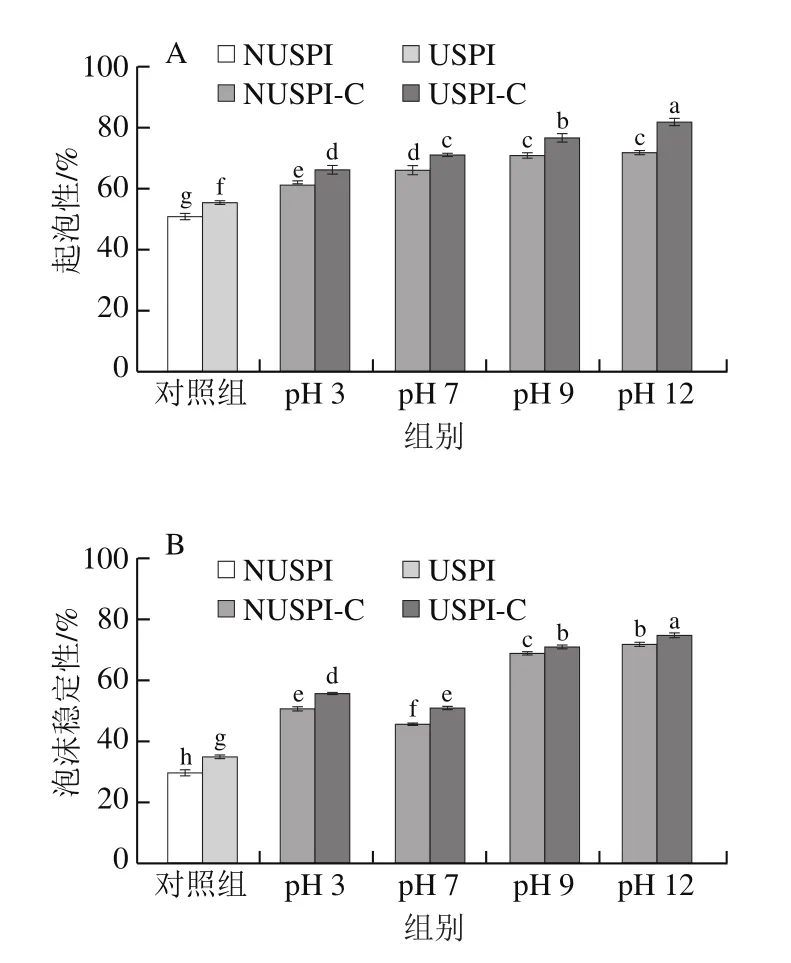
图7 不同pH值的SPI及SPI-儿茶素复合物的起泡特性(A)及泡沫稳定性(B)Fig.7 Foaming ability (A) and foam stability (B) of SPI and SPI-catechin complexes formed at different pHs
2.8 pH值对蛋白质-儿茶素复合物抗氧化性的影响
本实验通过测定DPPH自由基清除能力和ABTS阳离子自由基清除能力来探究超声预处理对不同pH值下SPI-儿茶素复合物抗氧化能力的影响。由图8可知,DPPH自由基清除率与ABTS阳离子自由基清除率结果趋势基本一致,与NUSPI样品相比,随着pH值的增加以及SPI超声预处理,形成的复合物抗氧化能力逐渐增强,在pH 12时提升最显著(P<0.05),pH12USPI-C样品的DPPH自由基清除率提高至NUSPI样品的5.5 倍,ABTS阳离子自由基清除率提高至NUSPI样品的4.8 倍,可能是由于超声预处理使SPI内部结构打开,暴露更多的疏水基团与儿茶素结合,儿茶素引入了大量的氢离子,与DPPH生成DPPH·H,以及ABTS经氧化后生成大量的阳离子自由基,增强了抗氧化能力[4]。pH 3时抗氧化性较差,可能由于pH 3距离SPI等电点较近,复合物部分沉淀未能发挥其抗氧化性能。而在pH值为7、9、12的条件下,可能由于碱性条件下共价结合的儿茶素数量多于非共价结合,因此共价复合物的抗氧化能力更强[4]。
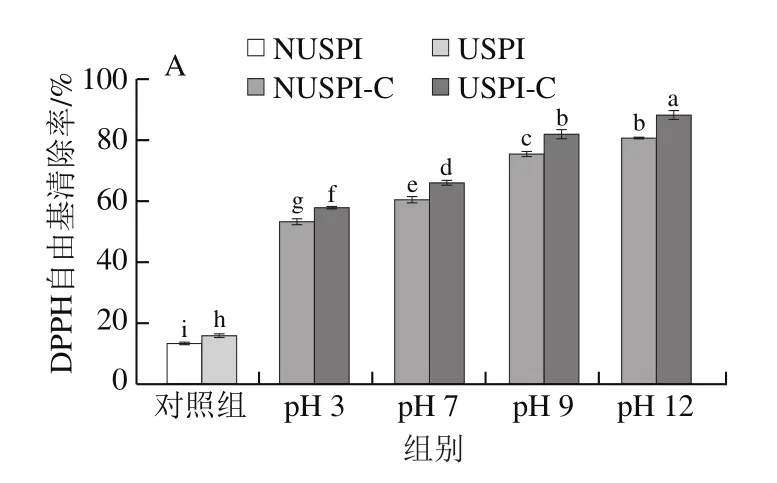
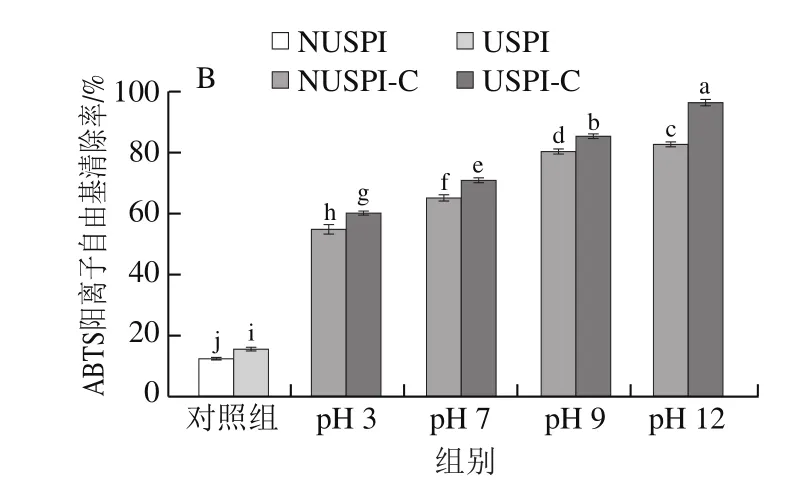
图8 不同pH值的SPI及SPI-儿茶素复合物的DPPH自由基清除率(A)及ABTS阳离子自由基清除率(B)Fig.8 DPPH radical (A) and ABTS radical cation scavenging rates (B)of SPI and SPI-catechin complexes formed at different pHs
2.9 分子对接分析结果
根据沉积系数,SPI可分为4 个成分:2S、7S、11S、15S蛋白,其中7S和11S蛋白是SPI的主要成分最多,共占SPI的70%左右[37]。儿茶素的氧化产物是茶黄素(图9),因此通过这两个蛋白和儿茶素与茶黄素模拟分子对接考察氢键及疏水作用对于溶液体系的影响。如图10所示儿茶素主要通过氢键与7S蛋白的Gly88、Gln354、Gln77、Met353与Glu358相互作用。儿茶素主要通过氢键与11S蛋白的Glu172、Gly202与Pro160相互作用。茶黄素主要通过氢键与7S蛋白的Gln104、Phe145、Ser144与Asn350相互作用,茶黄素主要通过氢键与11S蛋白的Gly207、Val162与Glu200相互作用。蛋白质分子中的几个疏水氨基酸残基为蛋白质-儿茶素复合物提供了重要的疏水相互作用,而疏水相互作用在蛋白质-儿茶素复合物的形成中起着关键作用[38]。通过对表2中各氨基酸的疏水参数计算比较发现,非共价复合物的总疏水性较共价复合物更强,说明在非共价复合体系中形成氢键以及疏水作用的能力更强,促进了复合物亲水能力,可以通过提高蛋白溶解度来增强其他理化性质及生物活性,进一步验证了非共价复合物的主要作用力为氢键和疏水相互作用。

表2 各氨基酸的分类、疏水参数以及复合物疏水性Table 2 Hydrophobic parameters of complexes and their abilities to form hydrogen bonds with water
图9 儿茶素(A)与茶黄素(B)的三维立体结构Fig.9 Three-dimensional structures of catechin (A) and theaflavin (B)


图10 蛋白质-儿茶素分子对接Fig.10 Molecular docking of protein with polyphenols
3 结 论
本实验探究了蛋白超声预处理下pH值对SPI-儿茶素非共价/共价复合物结构和功能的影响,在超声时间为5 min,功率为500 W的优化条件下,SPI与儿茶素通过非共价/共价结合得到复合物。通过傅里叶变换红外光谱、荧光光谱和SDS-PAGE结果发现,SPI经超声预处理后在pH 12的条件下与儿茶素的相互作用最强,SPI的α-螺旋和β-折叠含量显著降低,β-转角和无规卷曲含量显著增加,同时二者交联形成了高分子质量的共价聚合物。另外,SPI经超声处理后,在pH 12下,SPI-儿茶素复合物的起泡性、泡沫稳定性、抗氧化能力明显强于pH 3、7、9下的复合物。分子对接结果表明非共价结合比共价结合更容易生成氢键和疏水相互作用。以上实验结果可为蛋白质-儿茶素复合物在功能性食品成分和蛋白超声改性领域的应用提供理论指导。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

