醌指纹法及其在环境微生物领域的应用*
祝冲之 余 冉# 龙 涛 张晓东 罗默也 孙丽伟
(1.东南大学能源与环境学院,江苏 南京 210096;2.生态环境部南京环境科学研究所,江苏 南京 210019)
微生物是环境中的重要组成,通过分析微生物丰度和多样性有助于了解环境因素的变化和环境污染的情况。研究微生物群落丰度和多样性的方法种类繁多,其中生物标记法受到广泛关注。类异戊二烯醌(以下简称“醌”)几乎存在于所有生物体中,在呼吸和光合作用过程的电子传输中担任重要作用。同时,醌的结构具有多样性,一种微生物通常主要含有一种醌,因此可以作为微生物化学分类的参数之一。本研究将综述一种通过分析微生物菌群中电子传递体的种类和数量来表征其群落丰度和多样性的方法——醌指纹法[1]95。醌指纹法在20世纪80年代创立,近年来,随着化学分析技术的进步和微生物特征醌数据的完善,醌指纹法在废水处理、水环境分析、土壤监测和堆肥处理等场景有所应用[2]1,[3]393,[4]3,[5]1,但对研究结果缺乏系统的归纳总结。本研究重点探讨醌指纹法的原理与作用及其在环境修复领域的应用情况。
1 醌指纹法的原理
醌是一类含共轭环状二酮的母核连接异戊二烯侧链的有机化合物。醌根据其极性环状结构通常分为苯醌和萘醌。苯醌含有一个环状结构,苯醌包括泛醌、质体醌和紫醌等;萘醌含有两个环状结构,萘醌包括甲基萘醌、叶绿醌、去甲基萘醌和甲硫基萘醌等。
微生物细胞主要含有泛醌和甲基萘醌,它们在生物膜系统作为呼吸链中专一的电子和质子载体[6],也被称为呼吸醌,并可以进一步以其侧链中的异戊二烯单元数和饱和度来分类。
甲基萘醌又称维生素K2,是一类2-甲基-1-萘醌化合物,连接可变数量的异戊二烯链。甲基萘醌位于细胞的胞质和类囊体膜中,或一些细菌的光合系统的反应中心,在电子传递途径中的蛋白质复合物间转移电子和质子[7-8]。通常,将侧链中含有n个异戊二烯单元的甲基萘醌记为MK-n,如果其侧链中的异戊二烯双键饱和,则记为MK-n(Hx),x为饱和氢原子数。
泛醌又称辅酶Q,是一类2,3-二甲氧基-5-甲基-1,4-苯醌的化合物,连接可变数量的异戊二烯侧链。泛醌通常包含6~10个异戊二烯单元,很少能达到14个。大多数泛醌分布在革兰氏阴性菌的细胞膜、真核细胞中线粒体的内膜和叶绿体的类囊体膜上。泛醌在需氧呼吸电子传输链中起强制性辅因子的作用,充当电子和质子载体[9]。与甲基萘醌类似,侧链中含有n个异戊二烯单元的泛醌通常记为UQ-n,含有x个饱和氢原子记为UQ-n(Hx)。
叶绿醌也称维生素K1,它和质体醌作为光系统Ⅰ中电子转移辅助因子[10],存在于光合细菌或真菌中。
一种微生物通常只有一种优势醌型[11],醌种类的多样性使其可作为一种有效的生物化学分类学指标[12]247。醌指纹法利用这一特性,以样品中的醌作为生物标志物来表征微生物群落结构和活性。典型醌的结构示意图见图1。
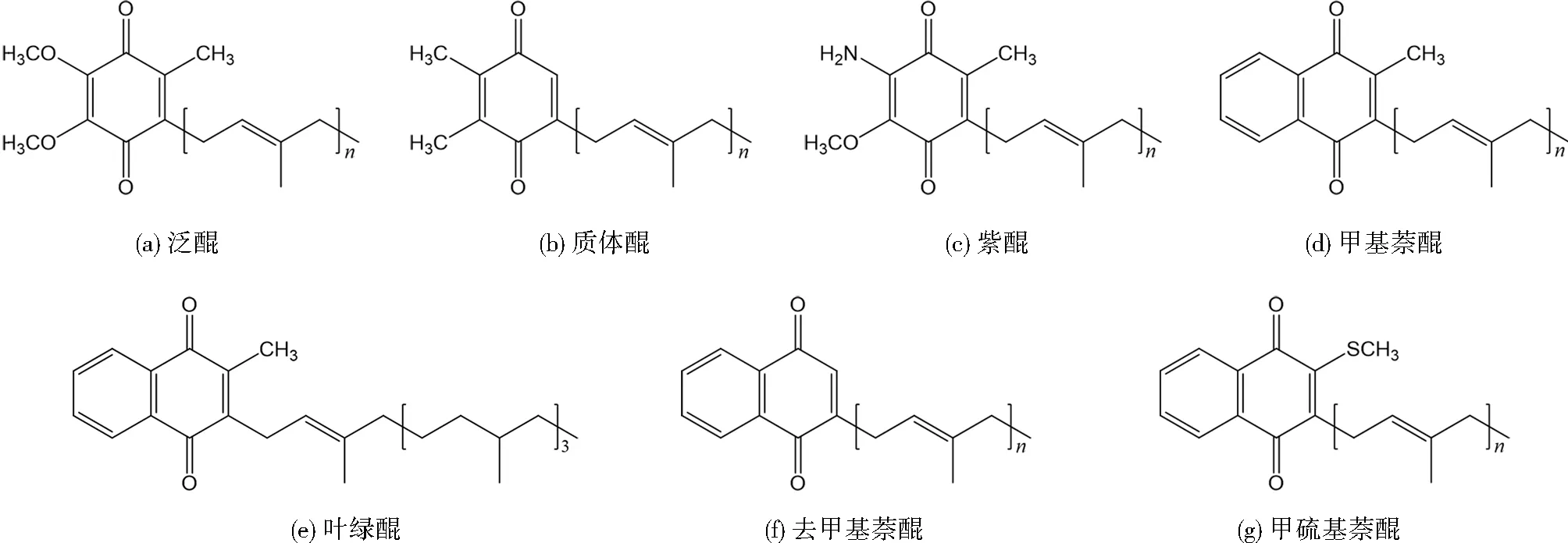
图1 典型醌的结构示意图
2 醌的提取和检测
2.1 醌的提取
醌是一种中性脂质,可以溶解于常见的脂溶性溶剂(如丙酮、甲醇、二氯甲烷和氯仿等)中。故萃取法是从环境样品或冻干细胞中提取醌的最常用的方法[12]247。常用的萃取剂有氯仿/甲醇(体积比2∶1)或二氯甲烷/甲醇/磷酸盐缓冲液(体积比2.0∶1.0∶0.8)。由于环境中的脂质提取物可能含有磷脂或非脂质的杂质,所以需通过银离子硅胶色谱或者反相薄层色谱对提取物进一步分离和纯化[13],但回收率不高(<90%)。因此现在通常使用固相萃取柱(如Waters Sep-Pak硅胶柱)进行纯化,这种方法的回收率高于96%[3]393。
为了克服传统萃取法耗时、繁琐和溶剂有毒的缺点,最近研究者开发出一种应用超临界流体萃取(SFE)提取样品中醌的方法[14-15]。这种方法在55 ℃和25 MPa下,以甲醇作为改性剂,使用超临界CO2萃取活性污泥中的醌,发现萃取后没有使用Sep-Pak柱和经Sep-Pak柱纯化的醌总量分别为390、410 μmol/kg,和传统萃取法的回收量(420 μmol/kg)相当。另有一种仅在冻干细胞中应用的新型检测技术,它不使用有机溶剂,仅通过脱水破坏细胞并将其中的醌转移到氧化铟锡电极上进行检测[16]。
2.2 醌的检测
提取出的醌通常用高效液相色谱(HPLC)检测并定量,HPLC的流动相可以是甲醇/异丙醚、甲醇/异丙醇或乙腈/异丙醇等混合物[3]394,[4]75。通常,在紫外光谱检测器下甲基萘醌的检测波长是270 nm,泛醌是275 nm。然而,HPLC易受环境中杂质的影响,灵敏度有限,无法鉴定醌结构。因此,液相色谱(LC)与质谱(MS)耦合技术在醌检测中愈发被重视[17-18]。某些醌型(如MK-8(H4)和MK-9)在HPLC检测下保留时间十分接近,LC—MS可以更好地分离这些醌[19]。其中MS主要使用的电离模式是正离子的大气压化学电离模式[20]。图2为环境样品中醌的主要检测流程。

图2 环境样品中微生物醌的主要检测流程
色谱检测需要标准物质,而目前部分醌型缺少市售的标准品(比如含有饱和氢原子的泛醌和甲基萘醌),所以通常从已知醌型的微生物中分离获得醌标准品[3]395。所选用的菌株需具备醌型单一、培养快速和简单等特点[21-22]。此外,泛醌和甲基萘醌中异戊二烯单元数和色谱保留时间的对数具有线性关系,可以基于此计算未知醌组分的异戊二烯单元数目[23]455。
3 醌指纹法的作用
3.1 醌指示的环境微生物
环境样品中的醌指纹可以推断样品的微生物种群结构和对应的种属丰度与活性,表1列举了已知所含醌型的微生物的种类。

表1 常见醌型指示的环境微生物
3.2 数据分析
醌指纹法可以检测出样品中醌的种类及数量的直接信息,为了比较样品间的差异,通常要进行统计学分析。目前,分析醌指纹常用的指数有总醌指数(TQ)、多样性指数(DQ)、均匀性指数(EQ)和非相似性指数(D)[45],公式见表2。

表2 醌指纹法的常见指数1)
TQ能够反映样品中具有活性的微生物数量,因为醌在死细胞内会很快分解。在水环境和土壤中,TQ和细胞丰度呈线性关系[46-47]。在湖泊中,1 nmol醌约对应0.67 mg微生物碳。然而,在不同水深下TQ与微生物碳含量的比例会变化,同时也会在一些深度中没有明显相关性[48]250。
醌的多样性水平可以代表微生物群落的多样性水平。最初曾用香农指数来量化基于醌指纹法的微生物多样性,但由于它对变化的敏感性不高,尤其是对摩尔占比较小的物种[23]455,所以目前通常使用DQ和EQ[1]96来量化。DQ越高表明微生物的多样性越高。EQ越高,表明微生物的分布比例越接近,当EQ达到最大值1时,表明所有含有不同醌型的微生物比例相同。此外,D可以比较两个样品间微生物群落的相似性,D值越小,两组样品越相似。
4 醌指纹法在环境领域的应用
4.1 废水生物处理系统
醌指纹法能用于反映污泥系统中微生物的情况。当BOD负荷为0.2~0.4 kg/(kg·d)时,活性污泥中甲基萘醌与泛醌的摩尔比(P)介于0.6~1.0,大部分在0.9~1.0;BOD较低或者保留时间较长的活性污泥中P会提高到1.2~4.0[23]454。在稳定的活性污泥系统中,UQ-8是最主要的泛醌类型[49]146,[50],[51]198,[52],而在丝状菌膨胀期间,UQ-9占主导地位[53],UQ-10也是常见的类型。同时,MK-7是最主要的甲基萘醌[49]146,其他常见的甲基萘醌有MK-8、MK-6或MK-9。在循环生物流化床系统的生物膜中,UQ-8和UQ-10增加而UQ-9减少[54],代表硝化细菌增加的同时变形细菌的γ亚类数量减少,生物膜中微生物种群均匀性变化较小。在膜生物反应器(MBR)中,泛醌的种类通常比甲基萘醌少。此外,膜表面生物膜的UQ-9、MK-7、MK-8(H2)、MK-8(H4)和MK-10(H4)含量的增加可能与MBR膜污染有关[55],MBR污泥的DQ可能会略低于悬浮微生物和生物膜中的DQ。
4.2 水环境和沉积物
河流、湖泊和海洋等水生系统中的醌含量往往不高,但通过醌指纹法可以推测水环境中有氧与无氧条件的变化情况。水系统中的醌以MK-6和UQ-8为主[48]250。醌分布受环境变量影响较大,但没有季节性规律。BECKER等[2]7发现有氧区的醌浓度比有氧-缺氧化变层提高了7倍,最深的水柱样品中醌浓度最低,并且缺氧区中不饱和甲基萘醌和泛醌的相对丰度较高。
醌种类和丰度分布可与沉积物的地理位置和深度关联[56]。潮汐沉积物中主要的醌是UQ-10和UQ-8,而潮下沉积物中以MK-6和UQ-9为主,主要原因可能是溶解性有机碳、氨氮、溶解氧浓度的变化影响了微生物活动[57]。LI等[58]发现在海湾冷渗流和可燃冰附近的沉积物中,泛醌含量相似(分别为51.7 pmol/g和55.0~57.3 pmol/g),UQ-8含量最高,并随深度增加而急剧下降;而冷渗流中甲基萘醌含量只有可燃冰的1/8~1/4,以MK-4和MK-6最为丰富。另外,还有研究表明海湾沉积物中DQ与总有机碳含量正相关,与盐度和导电性负相关,与重金属含量无显著相关关系[59]。
4.3 土 壤
醌指纹法可以间接反映土壤污染状况及其变化。有研究发现,土壤在受碳氢化合物污染后,TQ会显著增加,其中MK-8(H4)、MK-9(H2)和UQ-9显著增加,高浓度的碳氢化合物会使DQ有所降低,碳氢化合物被降解去除后,TQ和DQ与未污染土壤的差异消失[60]。KATAYAMA等[61]报道了土壤在多种农药杀虫剂施用下醌指纹的变化情况,其中杀螟松、利谷隆和西玛津不影响醌的浓度和种类;而百菌清会降低DQ但不改变TQ;三氯硝基甲烷会降低醌的数量和多样性。在重金属污染土壤中,土壤酶活性与甲基萘醌种类有明显的正相关关系,并且污染前后土壤中的泛醌含量变化较小,表明部分微生物对重金属存在耐受机制[62]。
4.4 堆 肥
有研究发现,堆肥初期MK-7和UQ-9通常是优势醌型[4]88,[5]79,[63],随着堆肥的进行,泛醌含量会有所下降,长链(含有9个及以上异戊二烯单元)甲基萘醌含量会有所增加,醌的多样性通常会下降,但有时候也会持续增加[5]73。随着堆肥过程的进行,微生物中变形菌纲的微生物会减少,而放线菌纲微生物会增加。
5 醌指纹法的优缺点
目前,碳源利用法(如Biolog法)和生物标记法(如磷脂脂肪酸分析法)已广泛用于自然环境中微生物群落的表征[64-65]。首先,与碳源利用法等培养法相比,醌指纹法优势在于无需培养微生物,可以直接反映环境中微生物群落结构。此外,醌指纹法可以有效指示古细菌,而磷脂脂肪酸分析无法检测古细菌,因为它们的极性脂质是醚键而不是酯键。
另外,分子生物学方法是鉴定微生物最常用的方法,它在微生物分类学和系统发育学的研究中作用明显。已有研究发现,醌指纹法表征微生物多样性的结果与变形梯度凝胶电泳(DGGE)、荧光原位杂交(FISH)、16S rRNA克隆和测序的结果基本一致[23]456,[51]198,[66]。此外,醌是细胞呼吸作用中的活性物质,所以它的浓度可以直接反映微生物的活度;同时醌指纹法更易于表征放线菌和古细菌[2]2,而这些微生物难以定量提取核酸来表征。
但是,醌指纹法也有局限性。首先,醌指纹法指示的分类水平较低,不能精确到物种的种属层面。其次,尚未完全掌握环境中所有微生物醌,所以某些特定情况下醌指纹所包含的生物学意义尚未完全解读。再次,在少数情况下,一种细菌的主要醌型也会发生变化,这会导致醌指纹的误差。此外,醌会在光下氧化,也会在强酸和强碱下发生分解,所以提取的过程可能会发生损失。
6 展 望
醌指纹法是研究环境中微生物群落结构和丰度的有效方法,它无需培养微生物,能避免死亡细胞的干扰,加之化学检测技术的进步和微生物特征醌指纹数据库的逐渐完善,使得分析环境样品中的微生物群落结构和活性更加便捷、高效和准确。在环境治理领域,往往只需要了解功能微生物群落结构和数量的变化情况,而非具体的微生物种属,所以醌指纹法的这些特性预示它具有广泛的应用前景。
未来,醌指纹法的发展需要进一步总结不同环境条件下醌指纹的变化规律,深入分析菌群的醌组成和分布与环境微生物的对应关系,降低检测成本。在微生物治理领域,醌指纹法可以和其他生物标志物法或分子生物学方法结合,以提供更为全面的系统微生物群落结构和活性分析。

