多因素影响白花前胡甲素和乙素含量分析
李肖莉,宋 程,贾 彬,刘 丽,欧金梅,韩邦兴1,**
(1.安徽中医药大学药学院,安徽合肥230038;2.皖西学院生物与制药工程学院,安徽六安237012;3.安徽省中药资源保护与持续利用工程实验室,安徽六安237012)
伞形科植物白花前胡(Peucedanumpraerupto⁃rumDunn)的干燥根是中国药典规定的中药前胡的唯一来源。前胡味苦、辛,性微寒,具有降气化痰、散风清热的功效,多用于治疗痰热喘满、咯痰黄稠、风热咳嗽痰多等症[1]。白花前胡资源丰富,主要分布于浙江、江西、福建、安徽、贵州等地,生长于山坡林缘,路旁或半阴性的山坡草丛中。目前研究认为前胡主要含香豆素类化合物[2-4],特征性成分为角型二氢呋喃香豆素类化合物,白花前胡甲素、白花前胡乙素、白花前胡素E是前胡中主要的3种香豆素类成分。现代药理研究表明,白花前胡乙素具有抗肿瘤作用,白花前胡素E能扩张血管,降低血压[5-6]。近年来,随着市场需求的增大,野生资源日渐枯竭,已难以满足市场的需要。在传统种植过程中,第一年播种出苗后进入营养生长,根部肉质肥厚,当年秋、冬季节采挖,可做药材。早期抽薹严重影响中药材次生代谢产物的积累,对白花前胡药材的产量和质量都有很大程度的影响[7]。目前,关于伞形科植物抽薹后不能药用的调控机制尚不明确,一种可能原因是处于生殖生长时期的白花前胡体内大量的营养成分用于抽薹,根部得不到充足的营养而无法进行正常代谢活动,导致次生木质部面积的增加,香豆素类含量降低[8]。另一种可能原因是白花前胡开始抽薹后,生长中心是地上部分,植物光合作用产生的大部分营养物质由根部转移至地上部分,供给白花前胡叶和花器官的发育,这可能是早期抽薹现象的主要原因[9]。但由于受遗传因素、生态因素等影响,致使同一时期白花前胡不同个体间营养生长和生殖生长不相统一,白花前胡早臺是否发生已成为前胡药材品质形成的关键。本研究采用高效液相色谱法测定不同采收时期前胡甲素和乙素含量,探讨不同采收期特别是抽薹开花对白花前胡甲素及乙素成分含量的影响,为明确白花前胡采收时期的进一步研究奠定基础。
1 材料与方法
1.1 仪器
HPLC高效液相色谱仪(日本岛津公司);JE3002G型电子天平[梅特勒-托利多仪器(上海)有限公司];JE303G型电子分析天平[梅特勒-托利多仪器(上海)有限公司];101-4B电热鼓风干燥箱(余姚市星辰仪表厂);1000C型粉碎机(永康市红太阳机电有限公司);F-030S型超声波清洗器(福洋电器有限公司)。
1.2 试剂
白花前胡甲素(praeruptorin A,批号B20035~20 mg),白花前胡乙素(praeruptorin B,批号B20037~10 mg),所有对照品均购自上海源叶生物科技有限公司,甲醇为色谱纯(上海麦克林生化科技有限公司),甲醇分析纯(上海麦克林生化科技有限公司),三氯甲烷分析纯(纯度≥99.0,西陇科学股份有限公司)。
1.3 材料
试验所用白花前胡均采自于安徽省六安市金安区东河口栽培基地,土壤类型为水稻土,基原植物经皖西学院韩邦兴教授鉴定为伞形科植物白花前胡。分别于2019年3月~11月进行样品收集,约每隔15~30 d,取不同生长年限、不同坡向生长的样品。采收其鲜根后洗净泥土,除去须根,趁鲜切片。经自然阴干后粉碎成粗粉,过3号筛后置于干燥器,密封保存。
1.4 试验方法
1.4.1 色谱条件
本试验采用的色谱柱为Inertsil-C18(5µm,250 nm×4.6 mm),以甲醇(A)-水(B)为流动相,等度洗脱的程序如下:流动相甲醇:水=75:25,流速1.0 mL/min,最大吸收检测波长设为321 nm,进样体积10µL。理论塔板数按照白花前胡甲素计算应不低于4 000。前胡甲素和乙素对照品及白花前胡不同年限、不同部位的HPLC图谱结果见图1。

图1 白花前胡甲素与乙素标准品及前胡样品HPLC图谱Fig.1 The HPLCchromatograms of praeruptorin standards and P.praeruptorum Dunn samples
1.4.2 对照品溶液制备
精密称取前胡甲素及前胡乙素适量,置100 mL容量瓶,用甲醇定容至刻度,摇匀,配置成甲素浓度0.343 ug/mL及乙素浓度0.340 ug/mL以100%甲醇为空白对照在321 nm处测定吸光值。
1.4.3 样品溶液制备
称取粉碎的白花前胡样品约0.5 g,置具塞锥形瓶中,加入三氯甲烷25 mL,密塞,称重,超声处理(功率250 W,频率33 kHz)10分钟,放冷,再称重,用三氯甲烷定容,摇匀,滤过;量取续滤液10 mL,蒸干,残渣加甲醇溶解并转移至25 mL量瓶中。
1.4.4 线性关系的考察
量取白花前胡甲素和白花前胡乙素母液各1 mL分别放入5、10、25、100、250 mL容量瓶,用甲醇定容至刻度,即得梯度浓度混合对照品。吸取上述混合对照品溶液10µL,注入液相色谱仪,记录峰面积,以绝对含量为横坐标,峰面积为纵坐标,将所得数据进行线性回归。
1.4.5 精密度试验按照供试品溶液的制备方法,在1.4.1项色谱条件下,进样10µL,重复进样6次,记录峰面积。
1.4.6 稳定性试验
按照供试品溶液的方法制备一份供试品溶液,在2.1色谱条件下,分别在4、8、12、16、20、24 h时进样,记录峰面积。
1.4.7 重复性试验
称取同一批母前胡样品6份,按照供试品溶液制备方法分别制备6份供试品溶液,在1.4.1项色谱条件下,进样10µL,分别记录峰面积。
1.4.8 加样回收试验
取母前胡样品6份约0.5 g,分别加入白花前胡甲素和白花前胡乙素对照品适量,按照供试品溶液制备方法制备供试品溶液,在1.4.1项色谱条件下,记录峰面积。
1.4.9 样品含量测定
称取样品粉末,按照供试品溶液制备方法制备供试品溶液,在1.4.1项下色谱条件测定样品中白花前胡甲素和白花前胡乙素含量,重复3次,结果取算术平均值。含量计算公式:m=c(样品)/c(甲素或乙素)。
1.5 数据分析
采用方差分析、多重比较等统计方法对原始数据进行统计,应用SPSS 21.0等软件进行数据分析和处理。

表2 白花前胡甲素和乙素回归方程、相关系数和线性范围Table 2 Regressive equations,correlation coefficients,linear ranges of praeruptorin A and B
2 结果与分析
2.1 方法学验证
如表3所示,重复性测定结果表明白花前胡甲素和白花前胡乙素峰面积的Relative standard devia‑tion(RSD)分别是0.014%和0.032%,表明该仪器重复性良好。回归方程为:白花前胡甲素Y=1 701775.02x+1 574.10(r=0.999),线 性 范 围0.002~5.15。白花前胡乙素Y=2 099 983.22x+6707.64(r=0.999),线性范围0.002~5.09。白花前胡甲素和白花前胡乙素精密度的RSD,分别为0.009%和0.012%,结果见表4。供试品溶液在24 h内稳定性良好,白花前胡甲素和白花前胡乙素的RSD,分别为0.014%和0.032%,结果见表5。加样回收率为99.32%和98.58%,RSD分别为0.025%和0.012%,结果见表6。

表3 重复性实验结果Table 3 The repeatability experiment

表4 精密度实验结果Table 4 The precision experiment

表5 稳定性实验结果Table 5 The stability experiment

表6 加样回收率实验结果Table 6 The sampling recovery experiment
2.2 色谱条件优化
图1 为利用已优化的色谱条件进行白花前胡对照品和样品分析的结果。可以看出,白花前胡甲素和乙素对照品色谱峰尖锐,对称性较好。样品中大多数色谱峰能够基线分离,其中两种对照品与其它杂质的分离度较好,可用于后续定量的实验。
2.3 采收时期对前胡甲素和乙素含量的影响
如表7和图2所示,对比前胡甲素和乙素含量,前胡甲素含量总体较高,前胡乙素含量总体较低。在14次采样过程中,二年生的前胡含量高于一年生前胡,前胡甲素含量变化幅度较大,前胡乙素含量的变化幅度较小。前胡甲素含量在2019年3月30日(二年生)采样时最高,含量约为1.067 2%;前胡乙素在2019年3月30日(二年生)采样时含量最高,约为0.120 3%。

表7 不同采收期前胡甲素及前胡乙素含量Table 7 contents of imperatorin A and imperatorin Bin differ‑ent harvest time
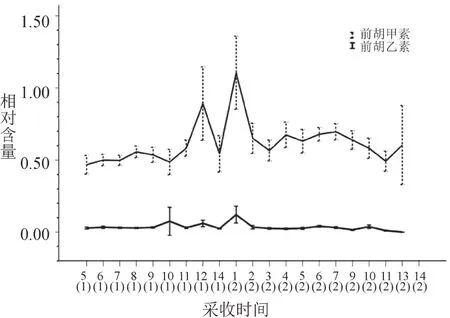
图2 不同采收期前胡甲素及前胡乙素含量变化Fig.2 The contents of praeruptorin A and Bat different har‑vest time
2.4 栽培环境对前胡甲素和乙素含量的影响
如表8和图3所示,白花前胡甲素在不同坡向上的含量存在差异,南坡的白花前胡甲素含量约高于北坡、西坡及东坡的80%;而白花前胡乙素含量在不同坡向上差异较小。

图3 不同坡向前胡甲素和乙素含量Fig.3 The content of praeruptorin A and Bin different slope directions

表8 前胡甲素和乙素含量在不同坡向的差异检验Table 8 Difference test of praeruptorin A and Bcontents in dif‑ferent slope directions
2.5 抽薹对前胡甲素和乙素含量的影响
由表9和图4看出,在白花前胡甲素、乙素含量在抽薹前后的差异检验中,白花前胡甲素和乙素含量在抽薹前后差异不显著。

表9 前胡甲素和乙素含量在抽薹前后的差异检验Table 9 Difference test of praeruptorin A and Bcontents during bolting

图4 抽薹前后前胡甲素和乙素含量Fig.4 The content of praeruptorin A and Bbefore and after bolting
2.6 不同组织对前胡甲素和乙素含量的影响
如表10和图5所示,前胡甲素、乙素含量在不同部位上的差异检验中,根组织的前胡甲素含量约高于茎部和叶片的一倍。其中,前胡甲素在叶片的含量高于茎部的1.5倍,即前胡甲素含量在不同部位的顺序从大到小为:根>叶>茎。根组织中的前胡乙素含量约高于茎部和叶片的1.5倍,叶片的乙素含量高于叶部3倍,即前胡乙素含量在不同部位的顺序从大到小为:根>叶>茎。

表1 白花前胡样品采收时间Table1 Sampling of P.praeruptorum Dunn time for collection

图5 不同生长部位前胡甲素和乙素含量Fig.5 Content of praeruptorin A and Bin different growth parts

表10 前胡甲素和乙素含量在不同部位上的差异检验Table10 Difference test of praeruptorin A and Bcontents in different tissues
3 讨论
3.1 不同采收期前胡甲素和乙素含量变化
不同的环境、气候对前胡药材中香豆素类成分的含量影响较大,包括土壤、温度、湿度等因素[11]。白花前胡为两年甚至多年生宿根植物,一般第一年进行营养生长,第二年抽薹开花进行生殖生长[12]。因此,在恰当的时期采收其根茎是保证前胡质量和功效的前提。一般来说,前胡适于冬季至次春茎叶枯萎或未抽花茎时釆挖,此时的前胡甲素和乙素等香豆素成分含量最高。本实验中,二年生前胡第1次采收时,前胡甲素及乙素含量达到最大值;第1次采样时含量最高,其他采样点含量略低于二年生第1次,综合考虑若采收二年生前胡药材应选取3月份时间点,采样时间与文献报道一致。前胡在第二年三月份采收时,前胡甲素和乙素含量最高,达到《药典》规定的甲素及乙素含有量不少于0.9%和0.24%的标准,其余采样点的样品甲素及乙素含量均不达标。
3.2 栽培因素(光照强度)前胡甲素和乙素含量变化
光照是影响植物生长和生物量积累的重要因素之一。许多研究均表明,农作物的生长情况和产品品质会随着光照强度的变化而变化[13]。本实验的采集地位于安徽六安山区,处于北半球北纬31度。因此,位于南坡的前胡植株受到日照的时间最长,其次是西坡和东坡。试验结果也表明,南坡的前胡甲素含量显著高于北坡、西坡、东坡;南坡和西坡的前胡乙素含量也是较高的。此外,光照不仅对阴生植物的形态结构塑造具有重要的调控作用,对其内在的生理生化效应和次生代谢产物合成也有明显的诱导效应[14]。前胡作为半阴生草本植物,其香豆素活性成分的积累同样受到光照的影响。长日照能够提高白花前胡香豆素及黄酮醇合成途径关键酶基因PAL、4CL、F6’H、BMT、CYP450的表达水平,这可能是光强影响前胡有效成分积累的主要原因之一[15-17]。因此,在实际生产过程中,应充分考虑光照对前胡药用成分代谢的作用机制,以期定向筛选出适宜的光照培养条件。
3.3 抽薹与未抽薹前胡甲素和乙素含量变化
抽薹开花对伞形科药材的根部木质化及其药用成分的积累都有显著影响[16-18]。白花前胡的生长周期为两年,第1年进行营养生长,第2年进行生殖生长。进入生殖生长后,根部开始木质化。因此,作为药材生产的白花前胡只能当年采收[19]。在第8次采样点(7月19日)之后获得的抽薹样本逐渐增多,抽薹后前胡由营养生长迅速进入生殖生长,9月份以后植株不再长高,营养生长期根系发达,主根肉质肥大。由于生态环境、生理条件等情况不同而使其营养生长期和生殖生长期的长短不相统一。一般将营养生长阶段的前胡称为“母前胡”,将生殖生长阶段的前胡称为“公前胡”,母前胡质地柔软、气味香浓品质较好,公前胡质地坚硬、气味较淡一般不做药用,故有“雄前胡,须拣去勿用”的说法。前胡在野生状态下可生长多年以后才抽薹开花,而在栽培情况下,其个体发育时间大大缩短,一般在第2年抽薹开花,少部分甚至第1年就开始抽薹开花[20]。因此必须充分了解白花前胡生物学特性,阐明其抽薹开花的内在规律,寻求既科学又经济的方法,使二年生变为多年生延长其开花时间,以保证根部药材的采收质量。
3.4 不同组织部位前胡甲素和乙素含量变化及转化规律
本试验中前胡甲素、乙素含量在不同组织部位的差异明显,根部前胡甲素含量显著高于茎和叶片,其中前胡甲素在叶片的含量显著高于茎部。前胡甲素含量在不同部位的顺序从大到小为:根>叶>茎。根组织中的前胡乙素含量显著高于茎部和叶片,叶片的乙素含量显著高于茎部,前胡乙素含量在不同部位的顺序从大到小为:根>叶>茎。由于香豆素类成分主要积累于前胡根中,其入药部位也是根。有参考文献研究表明,白花前胡甲素和白花前胡乙素在前胡早薹前后的比例发生显著变化,早薹前后两者的比例关系呈现一降一升的现象[21-22]。本实验结果表明,抽薹开花后根部的前胡甲素和乙素含量逐渐减少,关于前胡甲乙素是否存在根组织向地上部分的转运及其调控机制有待进一步地研究。

