干旱胁迫下外源水杨酸对野生大豆生理特性的影响
张秀玲,孙 颖,孟 岩,牟文玉,祝岩岩,赵若铭,戴忠民,2,崔培培,2
(1.德州学院生命科学学院,山东德州253023;2.山东省高校生物技术与生物资源利用重点实验室,山东德州253023)
干旱是制约植物生长发育的重要环境因子之一,随着全球气候变暖,越来越多的地区受到了干旱灾害的严重影响[1]。我国约有52.5%的土地处于干旱半干旱地区,在半湿润地区也经常遭受旱灾的影响[2]。研究表明,在遭受干旱逆境胁迫时,植物叶片相对含水量降低,因水分亏缺新陈代谢发生紊乱[3],植物体内自由基形成与清除之间的平衡遭到破坏,自由基清除系统的能力降低,自由基在体内积累,可使蛋白质氧化,生物膜造成伤害,导致植物损伤甚至死亡[4]。干旱胁迫导致光合速率下降,作物减产[5]。
水杨酸(Salicylic acid,SA)是一种广泛存在于植物体内的小分子酚类物质,在植物的许多生理过程中起调控作用。大量的研究发现,SA不仅有诱导植物产生抗病性的作用,还能提高植物对干旱、低温、病害、盐害胁迫的抗性[1,6]。SA作为植物应对胁迫反应的重要信号分子,可参与呼吸代谢及抗氧化防御系统的调节,清除过量自由基,减轻逆境胁迫对植物的伤害[7-9]。
野生大豆(Glycinesoja)是栽培大豆的近缘种[10],拥有极其宝贵的遗传基因,具有耐盐碱、抗寒、抗病等优良性状,在农业育种上可利用野生大豆进一步培育优良的大豆品种。目前,通过使用外源SA调控野生大豆抗旱性响应的研究少见报道。本试验用聚乙二醇(PEG-6000)溶液模拟干旱胁迫,研究不同浓度水杨酸喷施对干旱胁迫下野生大豆生理特性的变化规律,为深入研究野生大豆抗旱机制,充分开发利用野生大豆资源,强化植物抗旱性提供理论依据,为农作物抗旱的化学调控提供参考。
1 材料与方法
1.1 材料
野生大豆种子2018年10月上旬采收于山东省德州市岔河岸边,野生大豆单优群落。土壤系黄河冲积物,年降雨量600~700 mm,地理位置为北纬36°24′~38°0′,东经115°45′~117°24′,具显著的大陆性气候特征。年平均日照时数2 592 h,日照率为60%,太阳总辐射量为124.8 Kcal/cm2。
1.2 试验设计
用0.1%HgCl2表面消毒10 min,无菌水冲洗干净,然后将种子放置在铺有两层消毒滤纸的培养皿中,于25℃恒温培养箱中催芽,保持滤纸湿润。3 d后野生大豆胚根突破种皮,将野生大豆种植于石英砂:营养土为1:1的混合培养土中,温室内盆栽培养,光照时间为14 h,昼夜温度25±1℃,湿度为70~80%,盆高27 cm,直径为30 cm。每盆6株,待幼苗长至30 cm时,选取长势相同的盆栽幼苗进行处理,期间正常肥水管理。
试验共有处理:(1)CK(空白对照,无干旱胁迫且无水杨酸处理);(2)0(10%PEG-6000溶液);(3)0.5(10%PEG溶液+0.5 mmol/L SA);(4)1(10%PEG溶液+1 mmol/L SA);(5)1.5(10%PEG溶液+1.5 mmol/L SA);(6)2(10%PEG溶液+2 mmol/L SA)6个处理,每个处理3个重复,随机排列。试验先进行10%PEG模拟干旱处理,每天9:00用微型喷雾器向野生大豆幼苗叶片喷施,喷至所有叶片滴液为度,每次每盆叶面均匀喷施10 mL,对照处理植株喷等量清水,连续处理4 d;第5 d起每2 d喷施水杨酸1次,共喷施2次,每次每盆用量10 mL。水杨酸处理结束后3 d采集同一部位真叶,测定生理生化指标[22]。
1.3 测定方法
用NBT光化还原法测定超氧化物歧化酶(Su‑peroxide dismutase,SOD)活性[11];用愈创木酚显色法测定过氧化物酶(Peroxidase,POD)活性[12];用紫外分光光度法测定过氧化氢酶(Catalase,CAT)活性[11];采用硫代巴比妥酸法测定丙二醛(Malondial‑dehyde,MDA)和可溶性糖(Soluble sugar)含量[13];采用酸性茚三酮法测定脯氨酸含量[14];采用考马斯亮蓝(G-250)法测定可溶性蛋白含量[14]。
2 结果与分析
2.1 SA对干旱胁迫下野生大豆叶片抗氧化酶活性的影响
由图1A可知,与对照相比,干旱胁迫对照的野生大豆,POD活性提高了51.72%,表明干旱胁迫诱导了POD活性上升。施加SA后,不同浓度的SA处理提高了POD活性,随着SA浓度的增加,POD活性呈现先上升后下降的趋势,在施加SA为0.5、1.0、1.5、2.0 mmol/L浓度下,相比干旱胁迫对照处理,POD活性分别上升了12.16%、16.60%、28.86%、4.9%。这说明SA处理明显提高了干旱胁迫下野生大豆的POD活性,1.5 mmol/LSA处理效果最显著。
由图1B所示,相比对照处理,干旱胁迫对照下的野生大豆CAT活性升高了50.7%。这说明干旱胁迫下,野生大豆CAT活性增强,随着SA浓度的增加,CAT活性呈现先上升后下降的趋势。CAT活性均低于干旱胁迫对照处理,同时又都高于对照处理,比对照处理分别提高了4.69%、5.47%、35.94%、17.13%,1.5 mmol/L SA处理效果最明显。
由图1C可知,与对照相比,干旱胁迫对照下SOD活性升高了26.46%,随SA浓度梯度增加SOD活性呈基本上升趋势,在SA为0.5、1.0、1.5、2.0 mmol/L浓度处理下,均高于对照处理,与对照差异显著,且均低于干旱胁迫对照,分别比对照处理提高 了10.08%、21.96%、21.99%、20.10%,其 中1.5 mmol/L的SA处理达到最大值,高于干旱胁迫对照,差异不显著。
因此,外源SA能通过提高叶片POD活性增强抗氧化能力;通过提高野生大豆叶片SOD活性,增强清除超氧自由基能力;施加不同浓度SA对三种抗氧化酶活性影响不同,低浓度SA未能提高CAT活性,高浓度SA提高了CAT活性,增加了清除过氧化氢的能力,从而增强了野生大豆抗旱能力。
2.2 SA对干旱胁迫下野生大豆叶片丙二醛的影响
由图1D可知,与对照处理相比,干旱胁迫对照野生大豆MDA含量增加了45.61%,显著高于对照。喷施外源SA后,随SA浓度增加,MDA含量呈先降后升的趋势,在0.5、1.0、1.5、2.0 mmol/L SA浓度下,分别比干旱对照下降16.55%、39.95%、40.55%、19.93%,均显著低于干旱胁迫对照下MDA含量。试验结果显示,在1.5 mmol/L SA浓度下MDA含量为最低。
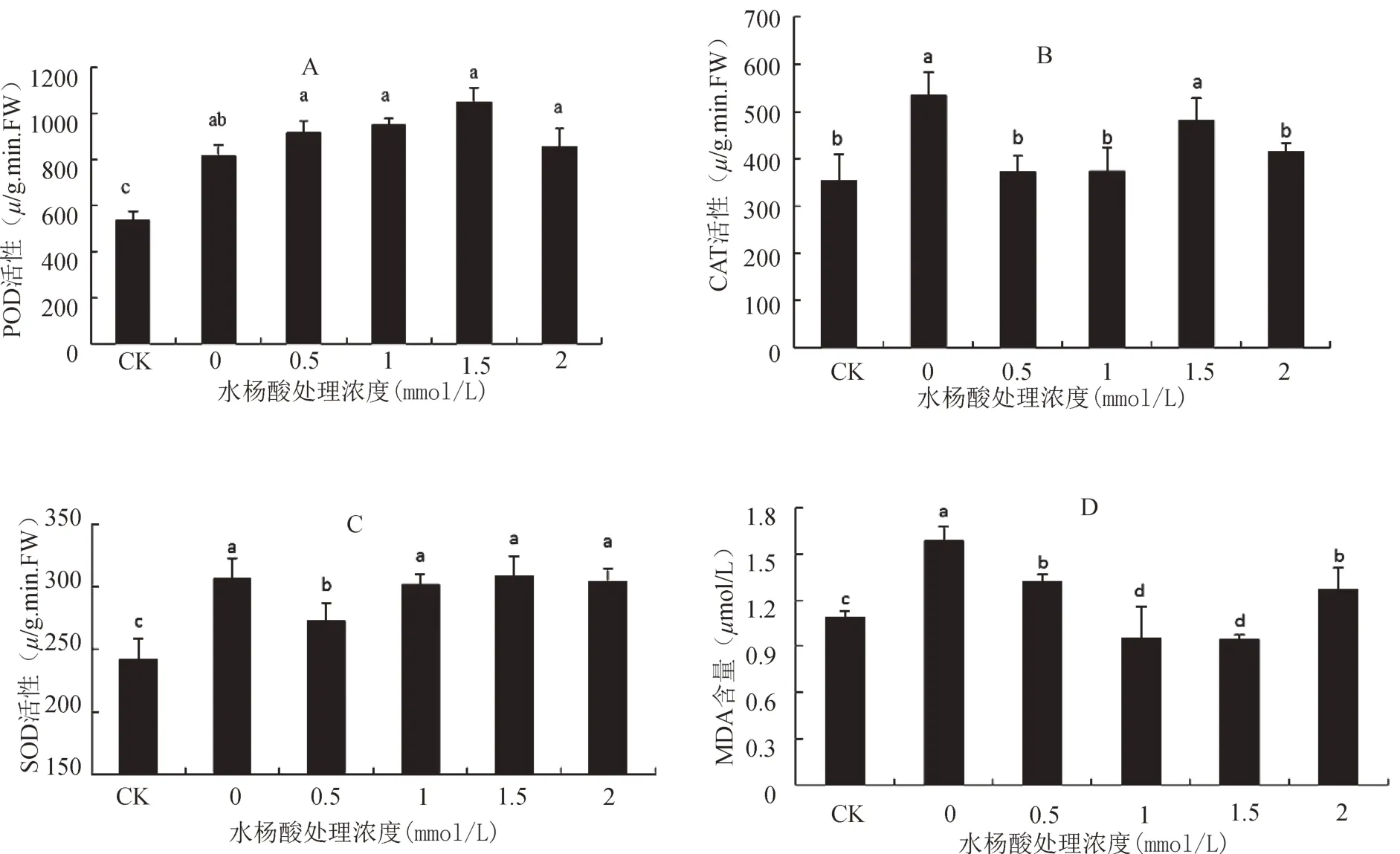
图1 SA对干旱胁迫下野生大豆抗氧化酶活性和丙二醛含量的影响Fig.1 Effects of SA on antioxidant enzyme activity and malondialdehyde
2.3 S A对干旱胁迫下野生大豆渗透调节物质含量影响
由图2A可知,相比对照,干旱胁迫对照野生大豆可溶性糖含量增加了11.32%。这说明干旱胁迫能促进野生大豆可溶性糖合成,以减轻干旱胁迫造成的伤害。在喷施外源SA情况下,随SA浓度增加,可溶性糖含量基本呈现下降的趋势。在0.5、1.0、1.5、2.0 mmol/L SA浓度下,分别比干旱胁迫对照下降6.78%、24.58%、33.90%、47.46%,其中1~2 mmol/L SA浓度处理,与对照和干旱胁迫对照,均差异显著。原因可能是野生大豆产生了一些干旱胁迫诱导蛋白,蛋白的合成会消耗糖的含量,所以可溶性糖的含量降低。
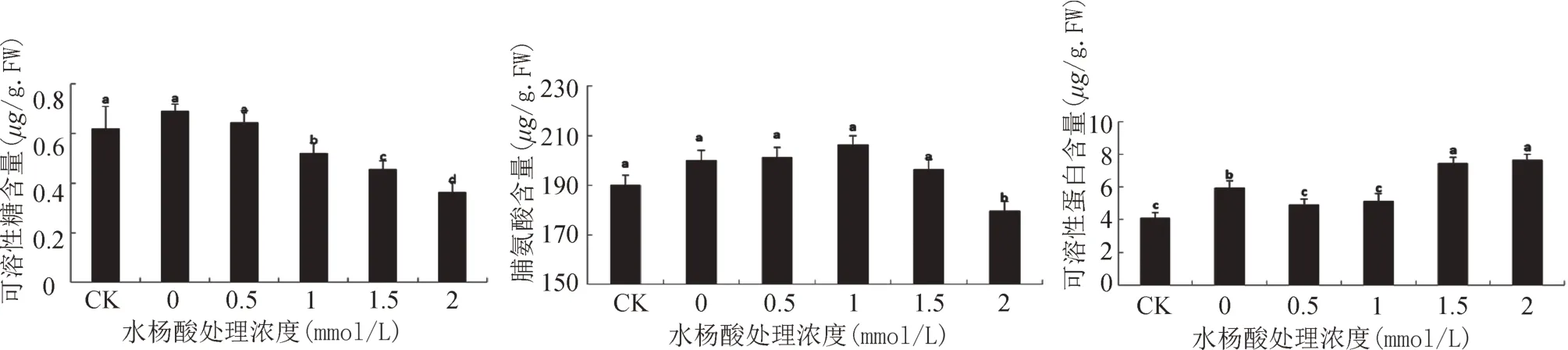
图2 SA对干旱胁迫下野生大豆渗透调节物质含量的影响Fig.2 Effects of concentration of SA on content of osmotic adjustment
由图2B可知,与对照处理相比,干旱胁迫对照野生大豆中脯氨酸含量提高了5.19%。随SA浓度的增加,脯氨酸含量的变化趋势是先上升后下降,当SA浓度为1.0 mmol/L时,比对照提高了8.41%,达到野生大豆中最大值。在除浓度为1.5、2.0 mmol/LSA处理之外的其它浓度处理中野生大豆中脯氨酸含量均高于干旱胁迫对照。因此,适宜浓度的SA可促进野生大豆中脯氨酸的积累。
由图2C可知,相比对照处理,干旱胁迫对照可溶性蛋白含量增加了44.47%,与对照差异显著,说明干旱胁迫促进了可溶性蛋白合成。随着SA浓度的增加,可溶性蛋白含量呈现上升的趋势,在1.5、2.0 mmol/L SA浓度下,比对照提高了25.53%和28.53%,显著高于对照和干旱对照。这表明适宜浓度的SA能明显促进野生大豆中可溶性蛋白的合成。
3 讨论与结论
3.1 外源SA处理对干旱胁迫下野生大豆抗氧化酶活性的影响
逆境影响植物体内活性氧代谢系统的平衡,增加活性氧的产量,并进一步启动膜脂脱脂作用,破坏膜结构。SOD、CAT和POD是植物体内酶促防御系统的关键保护酶[15],在清除超氧自由基、防止膜质过氧化、维护细胞膜正常代谢起到了重要作用[16]。SOD的主要功能是催化植物组织的歧化反应,使超氧自由基发生歧化反应产生O2和H2O2[17],产生的过氧化氢再由POD和CAT分解成水和氧气。POD可清除胞浆和线粒体中的H2O2,CAT可以使H2O2发生歧化生成水和氧分子。本试验中,干旱胁迫下野生大豆中SOD、POD、CAT活性均增加,随着外源SA喷施浓度的增加,野生大豆SOD、POD、CAT活性均呈现先上升后下降的趋势,这与马明莉[17]、覃泳智[18]、孙军利[19]对逆境胁迫下酶活性变化的研究结果一致。外源SA能刺激和诱导抗氧化酶SOD、POD和CAT活性,使其在逆境胁迫下处于较高的活性状态,从而更有利于清除H2O2,维持细胞膜完整性和稳定性,提高野生大豆抵御干旱的能力[19]。
3.2 外源SA处理对干旱胁迫下野生大豆丙二醛含量的影响
MDA是膜脂过氧化的产物,其含量高低可用来表示植物细胞膜损伤程度[20-21]。本研究中,干旱胁迫下野生大豆叶片中MDA含量明显增加,适量浓度SA处理显著抑制了MDA的累积,以1.5 mmol/L效果最好,这与单长卷对小麦幼苗、可静对研究黑果枸杞结果相似[22,16]。
3.3 外源S A处理对干旱胁迫下野生大豆渗透调节物质含量的影响
渗透调节是植物适应干旱胁迫的一种重要方式,而可溶性蛋白和游离脯氨酸是重要的渗透调节物质。植物细胞可溶性蛋白的积累有利于植物抵抗逆境伤害,维持植物细胞的渗透势[16]。本试验结果表明,干旱胁迫下可溶性蛋白含量增加,随着喷施外源SA浓度的增加,蛋白质含量呈现增加的趋势,这与何舒怀对广东润楠的研究结果类似[23];植物细胞脯氨酸含量的高低也是衡量植物抗逆性强弱的指标,含量越高,植物对逆境的渗透调节能力越强[24]。游离脯氨酸可清除活性氧、防止细胞脱水。野生大豆叶片中脯氨酸含量在干旱胁迫下高于对照,当SA浓度为1.0 mmol/L时,较单独干旱处理提高8.41%,达到最大值。这说明野生大豆在干旱胁迫下能积累脯氨酸来改变细胞渗透势,从而改变自身的渗透调节能力以提高抗旱能力。毛培利对刺槐的研究表明,可溶性糖在干旱胁迫初期是主要的渗透调节物质,在脯氨酸胁迫后期起主要作用[25]。可溶性糖是合成其它有机溶质的碳架和能量来源,可以增大细胞原生质浓度,进而增强植物的抗旱性[26]。本试验结果表明,干旱胁迫下可溶性糖含量升高,随着外源SA浓度增加,可溶性糖含量下降,可能是由于蛋白的合成消耗糖的所致。
综上所述,SA能够通过提高SOD、POD活性和脯氨酸、可溶性蛋白的含量,增强野生大豆幼苗的抗氧化及抗渗透胁迫能力,抑制膜脂过氧化,从而一定程度上缓解了干旱胁迫对野生大豆带来的伤害。SA处理有一定的浓度效应,以1.5 mmol/L的浓度对野生大豆的缓解效果最为明显。

