不同套种模式北柴胡的化学差异研究
李香串,吕鼎豪,李震宇,曲继旭,张豆豆,董晓丽,张文静
(1.山西省医药与生命科学研究院,山西太原030006;2.山西大学中医药现代化研究中心,山西太原030006;3.山西省药品检查中心,山西太原030006)
2020年版《中国药典》(一部)规定柴胡为伞形 科植物柴胡(BupleurumchinenseDC.)或狭叶柴胡(BupleurumscorzonerifoliumWilld.)的干燥根[1]。柴胡性苦味平,具有透表泄热、疏肝解郁、升阳举陷的作用,为治疗少阳证的要药[2]。柴胡是大宗药材,野生资源已经不能满足市场的需求,栽培柴胡日渐成为主流的商品药材。
栽培柴胡多以种子繁殖为主,田间播种后2个月左右出苗,生产中普遍存在出苗不齐、成苗率低、苗期杂草危害严重等问题,影响了药材的产量与质量。柴胡套种栽培是当前一种常见的生态种植模式,其优点是高杆作物能为苗期柴胡提供适当遮荫,同时能起到改善光热资源的合理分配,抑制杂草生长,增加土壤环境多样性,减少病虫害的发生和除草剂的使用,有利于增产增收。田间试验结果表明,当遮阴度为80%,有效光照为6 000~8 500 lx时,适合柴胡幼苗生长发育,柴胡出苗率最高。山西气候干旱,地形多以高原、山地为主,玉米、谷子是山西的主要粮食作物,从南到北均有分布种植。经检测玉米、谷子地的平均遮阴度分别为78%和85%,满足柴胡生长发育特点和环境条件的要求,适合与柴胡套种。目前玉米/柴胡、谷子/柴胡套种作为代表性的粮药套作生态种植模式已在山西省范围内得到了广泛应用。
基于UPLC-MS的代谢组学技术利用高通量的检测手段结合多元统计对植物提取物进行全面分析,具有整体观的研究思路,适合对中药材等复杂体系进行分析[3]。目前,已经用于多种药用植物的化学差异比较,如黄芩叶[4]、牡丹皮[5]、款冬花[6]等。本研究采用基于UPLC-MS的代谢组学技术,对“谷子/柴胡套种”和“玉米/柴胡套种”两种套种模式下北柴胡的化学成分进行比较,从化学组成角度阐明两种套种模式下北柴胡的化学差异,为北柴胡的生态种植模式研究提供参考。
1 材料与方法
1.1 仪器与试剂
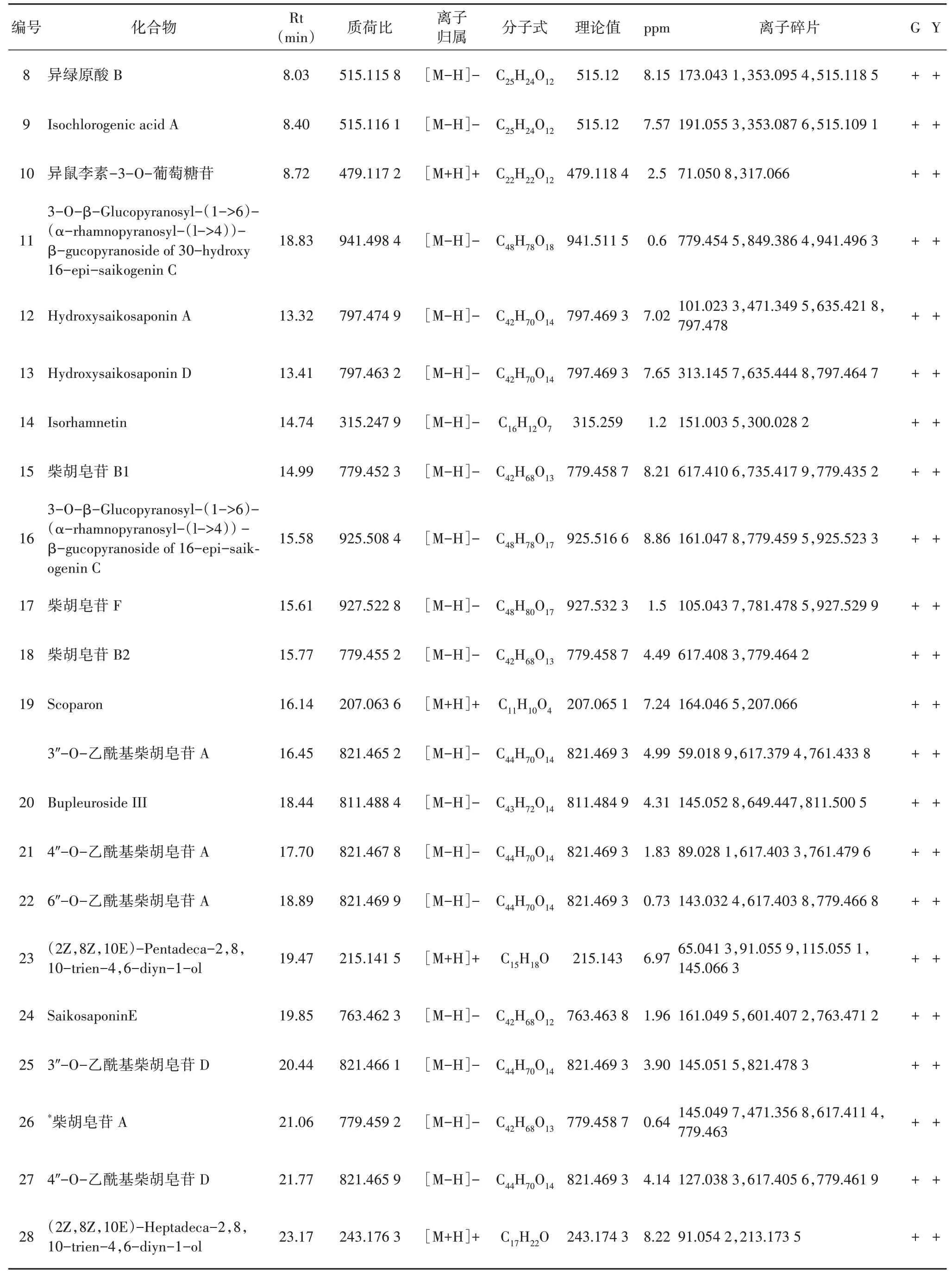
ExionLC™AD-超高效液相色谱仪(美国ABSci‑ex公司);Triple TOF 5600+-四极杆飞行时间质谱仪(美国AB Sciex公司);Agilent 1260-液相色谱仪(美国Agilent公司);KQ-300型-超声波清洗器(昆山市超声仪器有限公司);BSA124S-分析天平(德国Sar‑torius公司);超纯水;甲酸、乙腈(色谱纯,美国Ther‑mo公司);甲醇(分析纯,天津市大茂化学试剂厂)。对照品柴胡皂苷A(批号:17050105,质量分数≥98%),柴胡皂苷D(批号:17050106,质量分数≥98%)购于成都曼思特生物科技有限公司。
1.2 样品
谷子/柴胡套种柴胡药材(G1、G2、G3),玉米/柴胡套种的柴胡药材(Y1、Y2、Y3)(生长年限3年)采收于山西省灵石县,经山西大学秦雪梅教授鉴定为柴胡为伞形科植物柴胡(B.chinenseDC.)的干燥根。
1.3 柴胡皂苷A、柴胡皂苷D的含量测定
备样方法和色谱条件参照2020版《中国药典》柴胡项下柴胡皂苷A、柴胡皂苷D的含量测定方法[1]。色谱柱:Diamonsil II C18(4.6 mm×250 mm,5µm)色谱柱;流速:1.0 mL/min;柱温:25℃;进样量为20µL。
1.4 超高效液相色谱-四极杆飞行时间质谱联用分析
1.4.1 供试品溶液的制备
取北柴胡药材粉碎(过四号筛),称取细粉2.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇10 mL,密塞,称定重量,超声(功率200 W,频率40 kHz)处理30 min,放冷,摇匀,用甲醇补足失重,摇匀,滤过,过0.22µm微孔滤膜过滤,得供试品溶液。
1.4.2 色谱和质谱条件
色谱柱采用Waters Acquity UHPLCHSST3 col‑umn(2.1 mm×100 mm,1.8µm);流动相:0.1%甲酸水(A)-0.1%甲酸乙腈(B);梯度洗脱:0~15 min,10%~40%B;15~28 min,40%~75%B;28~33 min,75%~95%B;33~35 min,95%~95%B;35~37 min,95%~10%B。柱温35℃,流速0.3 mL/min,进样量3µL。
质谱条件 电喷雾离子源(ESI)分别采用正负离子模式分别扫描,离子源参数如下:喷雾电压-4 500 V(负离子),5 500 V(正离子),离子源温度550°C,喷雾气(Gas 1)55 psi,加热气(Gas 2)55 psi,气帘气(CUR)30 psi,去簇电压(DP)60 V。扫描模式采用TOF MS-IDA-Production scan,一个循环由一个TOF MSscan(累计时间0.25 s)和最多10个IDAProduct ion scan(累计时间0.09 s)组成。TOF MS扫描范围为m/z100~1 500,Product ion scan扫描范围为m/z50~1 250,二级碰撞能量(CE)为(40±20)eV。
1.5 数据处理分析
通过查阅文献,建立柴胡化学成分数据库,采用Sciex OS软件进行峰提取、峰匹配分析处理,与文献报道的柴胡化学成分的精确分子量,同位素峰进行匹配,进一步结合文献报道的质谱裂解规律以及对照比对二级质谱碎片进行鉴定。将超高效液相色谱-飞行时间质谱(Ultra‑high performance liquid chromatography‑triple time of flight mass spectrometry)鉴定的各个化合物的峰面积所得到的数据矩阵,导入SIMCA-P 13.0软件中进行主成分分析(Principal component analysis,PCA),判断各样品的聚集情况;然后用正交偏最小二乘判别分析(Orthogonal partial least-squares discriminant analysis,OPLS-DA)分析组间差异代谢物,并通过S-plot、变量重要性投影值(Variable importance on projection,VIP)值和t检验筛选确定。
1.6 GNPS分子网络的构建与注释
将两组北柴胡样本的UHPLC-Triple TOF MS原始数据转换为“mzXML”格式后分组上传至GNPS在线平台(https://gnps.ucsd.edu)[3]。设定参数“Mini⁃mumcosinescore”、“Minimummatchedfragment ions”、“NetworkTopK”,建立分子网络,同一集群中的化合物均属于同类化学成分。通过“View Spectra Families”功能可将分子网络可视化,一个节点表示一个化合物,节点的颜色代表化合物所属组别,蓝色外圈的节点为与GNPS数据库匹配的化合物。
2 结果与分析
2.1 柴胡皂苷A和柴胡皂苷D的含量测定
根据《中国药典》规定的方法,分别对2种套种模式的北柴胡中柴胡皂苷A和柴胡皂苷D进行含量测定(表1)。谷子/柴胡套种的北柴胡药材中,柴胡皂苷A的含量范围为0.12%~0.13%,柴胡皂苷D为0.18%~0.19%,总含量为0.30%~0.32%;玉米/柴胡套种的北柴胡药材中,柴胡皂苷A的含量范围为0.15%~0.16%,柴胡皂苷D为0.22%~0.23%,总含量为0.37%~0.39%,均达到《中国药典》要求。
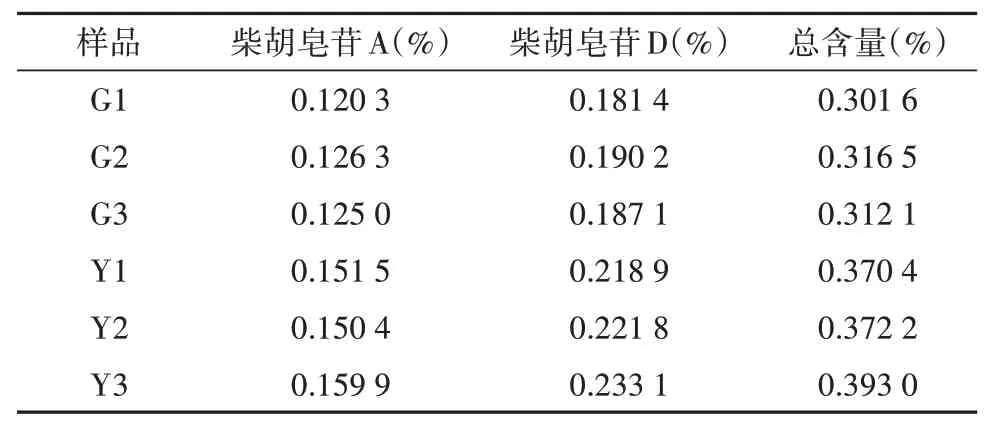
表1 不同套种模式下北柴胡中柴胡皂苷A、D的含量Table 1 Contents of saponins A and Din B.chinense under different intercropping patterns
对两种套种模式的北柴胡进行t检验分析。由图1可见,玉米/柴胡套种的北柴胡药材中的柴胡皂苷A和柴胡皂苷D的含量显著高于谷子/柴胡套种(P<0.01)。
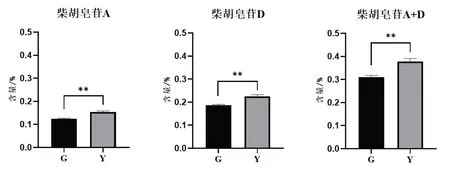
图1 柴胡皂苷在不同套种模式下的含量比较Fig.1 Comparison of content of saikosaponins in different interbreeding modes
2.2 北柴胡化学成分定性分析
采用UHPLC-Triple TOFMS对北柴胡中的化学成分进行定性分析,分别获得正负离子模式下的一级、二级质谱数据,总离子流图如图2所示。对于有对照品的化合物,通过比对色谱保留时间,一级和二级质谱信息进行确证,并分析其裂解规律。根据文献报道[7-11]的柴胡化学成分分子式、质谱裂解规律进行分析,共鉴定42种化合物,主要包括18个皂苷类成分,6个多炔类成分,4个黄酮类成分,9个有机酸类成分及5个其他类成分(表2)。其中谷子/柴胡套种的北柴胡药材中共鉴定42个化合物,玉米/柴胡套种的北柴胡药材中共鉴定41个化合物。两种北柴胡含有的化学成分种类接近,但仍有不同之处。如黄酮类成分Kaempferol-7-O-rhamnoside仅在谷子/柴胡套种的北柴胡药材中检测到。
图2 北柴胡的甲醇提取物在正(A)、负离子(B)模式下的总离子流图Fig.2 Total ion current diagram of methanol extract of B.chinense in positive(A)and negative(B)modes
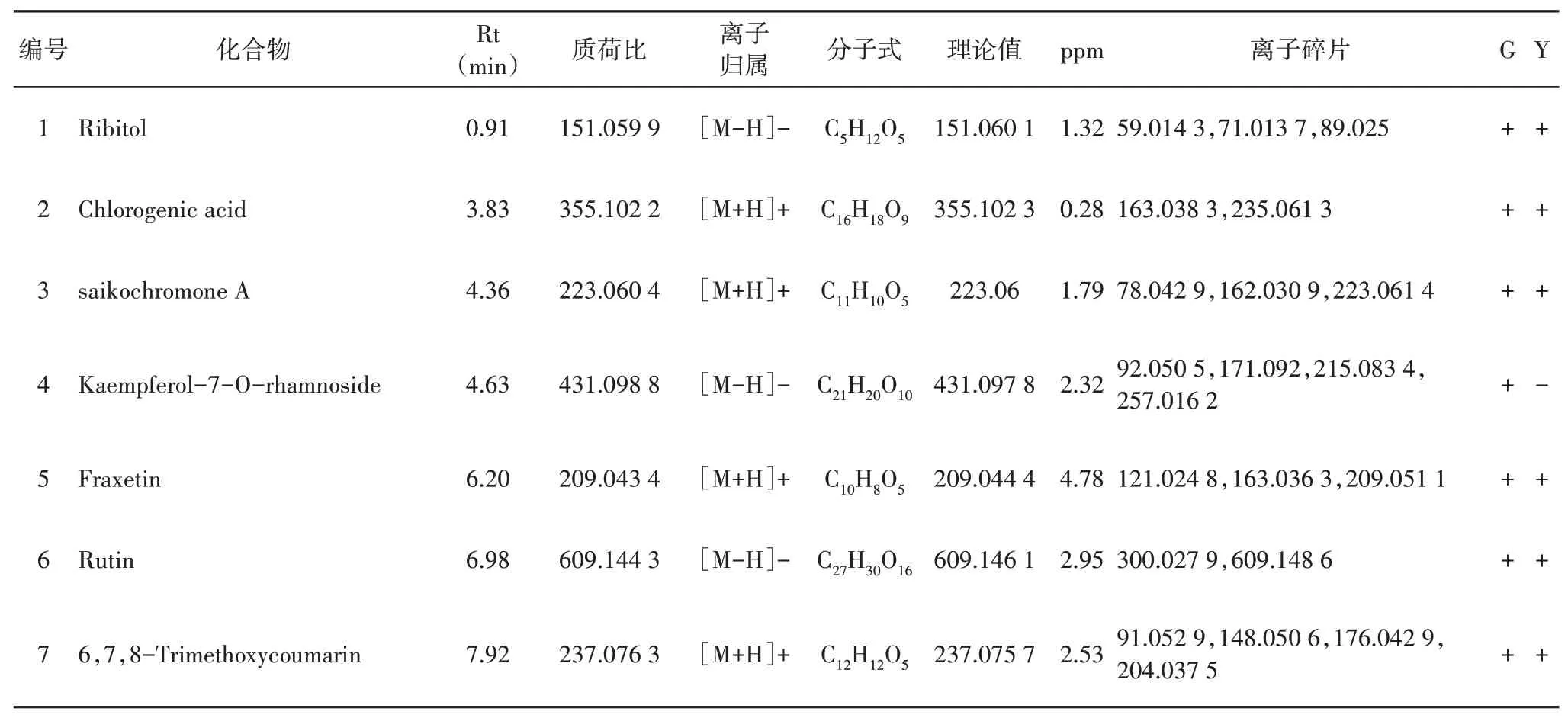
表2 不同套种模式下北柴胡中化学成分Table 2 Chemical constituents of B.chinense under different interbreeding modes
续表
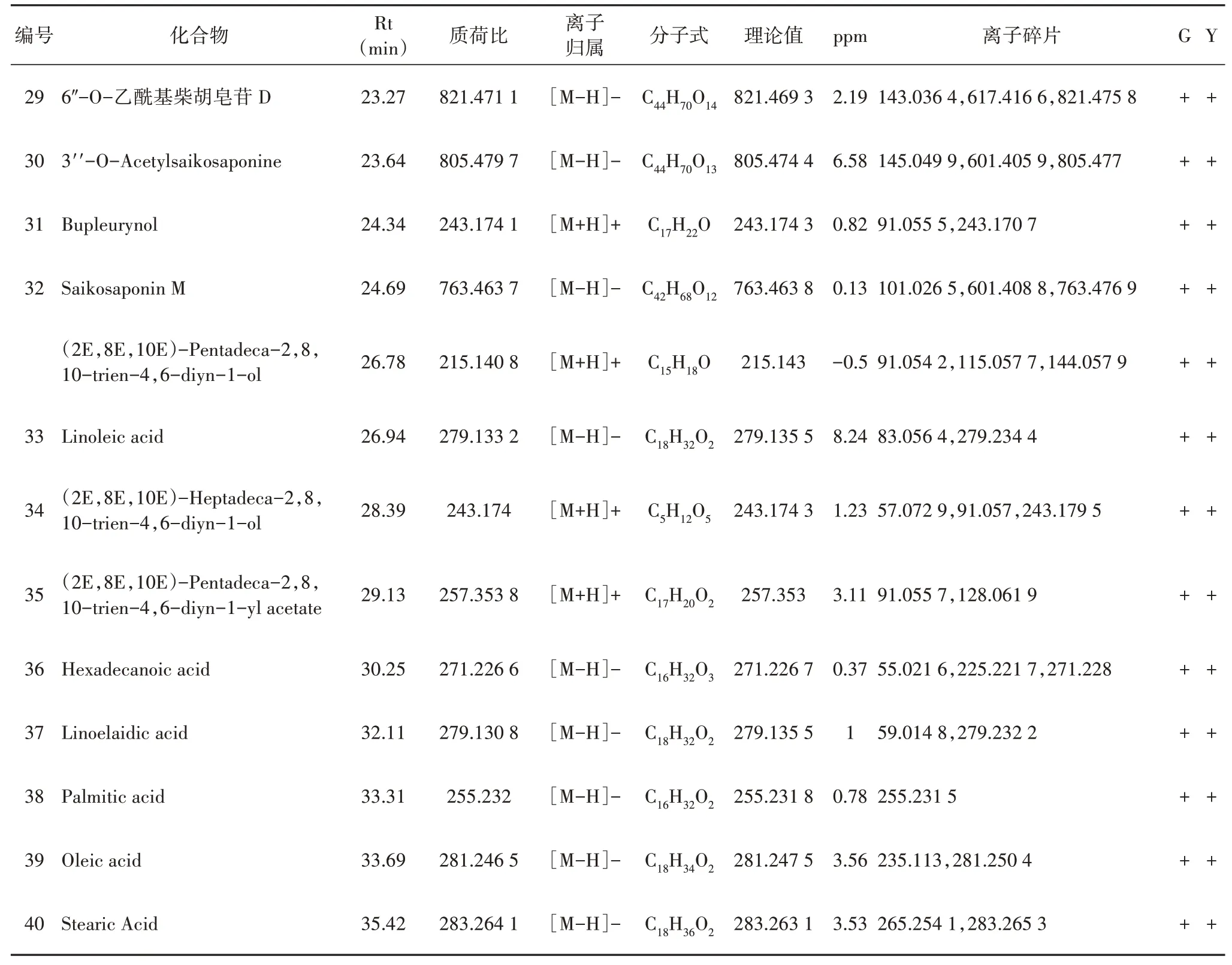
续表
2.3 多元统计分析
进一步对不同套种模式下的北柴胡药材进行多元统计分析。首先进行主成分分析,由第一主成分(PC1=0.534)和第二主成分(PC2=0.257)构建的散点图(图3A)可见,不同套种模式下的北柴胡可明显分离。为了进一步确定两种套种模式下的北柴胡的差异化学成分,采用有监督的模式识别OPLSDA模型对数据进一步分析(图3B)。PLS-DA模型验证排列实验中,左端任何一次随机排列产生的R2、Q2均低于右端,证明模型有效[12]。OPLS-DA模型CV-ANOVA验证的P值(P=0.049 9)小于0.05,证明两组之间的差异具有统计学意义。
两组北柴胡的差异成分通过S-plot图(图3D)和VIP值(VIP>1)相结合分析确定13个差异成分,包括:异绿原酸A、6″-O-乙酰基柴胡皂苷A、绿原酸、Isorhamnetin、Linoelaidic acid、Oleic acid、(2Z,8Z,10E)-Heptadeca-2,8,10-trien-4,6-diyn-1-ol、(2E,8E,10E)-Pentadeca-2,8,10-trien-4,6-diyn-1-yl acetate、(2E,8E,10E)-Pentadeca-2,8,10-trien-4,6-diyn-1-ol、(2E,8E,10E)-Heptadeca-2,8,10-trien-4,6-diyn-1-ol、Ribitol、Rutin和Scoparon。
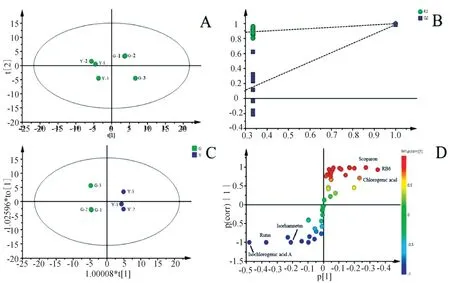
图3 北柴胡样本化学成分PCA散点图(A),排列实验模型验证(B),OPLS-DA散点图(C),S-plot图(D)Fig.3 PCA(A),Experimental model validation(B),OPLS-DA(C),S-plot(D)of the chemical composition of B.chinense samples
进一步对两组间的13个差异成分进行t检验,如图4所示,与谷子/柴胡套种的北柴胡药材相比,玉米/柴胡套种模式下的柴胡样本中,6″-O-乙酰基柴胡皂苷A、绿原酸、Linoelaidic acid、(2Z,8Z,10E)-Heptadeca-2,8,10-trien-4,6-diyn-1-ol、(2E,8E,10E)-Pentadeca-2,8,10-trien-4,6-diyn-1-yl ace‑tate、(2E,8E,10E)-Pentadeca-2,8,10-trien-4,6-diyn-1-ol、(2E,8E,10E)-Heptadeca-2,8,10-trien-4,6-diyn-1-ol和Scoparon含量较高,而异绿原酸A、Isorhamnetin、oleic acid、Ribitol和Rutin含量较低,其中11个成分的差异具有统计学差异。
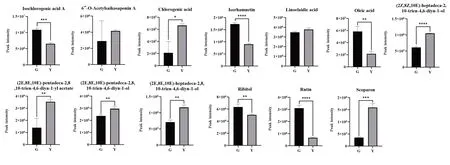
图4 柴胡差异代谢物在不同套种模式下的峰面积比较(n=3)Fig.4 Comparison of peak area of different metabolitesof B.chinense under different interplanting modes(n=3)
2.4 基于GNPS分子网络的柴胡皂苷比较
柴胡皂苷是柴胡的特征化学成分,采用两组北柴胡样本的UHPLC-Triple TOFMS负离子模式数据构建皂苷类化合物GNPS分子网络分子网络图(图5)。该网络图共有91个节点,代表91个皂苷类化合物,其中有8个皂苷类成分只存在于谷子/柴胡套种的北柴胡样本中,8个皂苷类成分只存在于“玉米/柴胡套种”的北柴胡中,其余成分在均存在于两组北柴胡样本中。
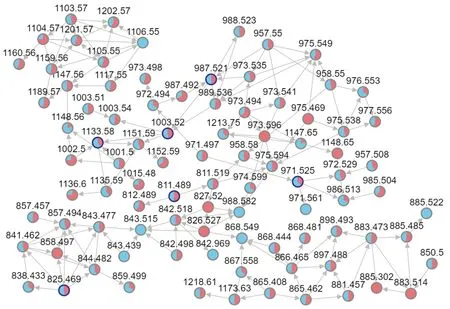
图5 北柴胡样本皂苷类化合物的分子网络图Fig.5 Molecular network diagram of saponins in B.chinense samples
3 结论与讨论
本研究采用柴胡皂苷含量测定,结合基于UH‑PLC-Triple TOFMS的代谢组学技术、以及GNPS分子网络比较分析了谷子/柴胡套种和玉米/柴胡套种两种种植模式下北柴胡的化学差异。结果显示,玉米/柴胡套种的北柴胡药材中的柴胡皂苷A和柴胡
皂苷D的含量均高于谷子/柴胡套种。采用UH‑PLC-Triple TOF MS共鉴定42种化学成分,其中谷子/柴胡套种的北柴胡药材中共鉴定42个化合物,玉米/柴胡套种的北柴胡药材中共鉴定41个化合物。通过代谢组学技术进一步筛选出13个差异化学成分,其中6″-O-乙酰基柴胡皂苷A、绿原酸、Linoelaidic acid、Scoparon,以及多炔(2Z,8Z,10E)-Heptadeca-2,8,10-trien-4,6-diyn-1-ol、(2E,8E,10E)-Pentadeca-2,8,10-trien-4,6-diyn-1-yl ace‑tate、(2E,8E,10E)-Pentadeca-2,8,10-trien-4,6-diyn-1-ol、(2E,8E,10E)-Heptadeca-2,8,10-trien-4,6-diyn-1-ol在玉米/柴胡套种模式下的北柴胡药材中含量较高,而异绿原酸A、Isorhamnetin、Oleic acid、Ribitol和Rutin在谷子/柴胡套种模式下北柴胡药材中含量较高。GNPS分子网络结果显示,两种套种模式下皂苷类成分的种类接近,但仍有明显差异。综上,不同套种模式的北柴胡药材虽然皂苷类指标成分均符合《中国药典》的规定,但不同的农作物套种模式会对北柴胡药材的化学组成产生一定影响,这种差异产生的机制还需要进一步深入研究。

