无籽刺梨多糖纳米粒制备工艺优化及表征
付阳洋,杨 敏*,汤陆扬,杨培昕,彭黔荣,谢有超
(1.贵州大学药学院,贵州贵阳550025;2.贵州中烟工业有限责任公司技术中心,贵州贵阳550009;3.贵州大学化学与化工学院,贵州贵阳550025)
无籽刺梨[RosesterilisS.D.Shi],又名金刺梨、光枝刺梨等,系蔷薇科蔷薇属多年生落叶丛生灌木。在贵州安顺、兴仁等地居多,是贵州省特有刺梨品种。因其果实成熟后,果皮刺脱落,种子败育,被称为无籽刺梨。无籽刺梨果实比普通刺梨果实稍小,但果肉占比大,可食率比高。此外,其果肉粗纤维不发达,风味独特,糖分含量比刺梨高13.3%,单宁含量比刺梨低71.7%,因此,无籽刺梨果实口感甜而不涩,更适合于风味饮品的开发[1-3]。研究表明,无籽刺梨果肉还富含类黄酮、三萜、维生素和氨基酸等多种对人体有益的微量元素[4-5],具有抗氧化、抗衰老和增强免疫力等功效[6]。
聚乳酸羟基乙酸共聚物(Poly lactic-co-glycolic acid,PLGA)是由两种单体乳酸和乙醇酸随机聚合而成,其纳米粒作为药物载体,生物相容性好,具有良好的生物降解性,无刺激性,毒副作用小,经酯键断裂降解为乳酸和羟基乙酸,通过三羧酸循环被代谢为二氧化碳和水从体内排出[7]。在降解时,PLGA纳米粒表面会逐渐产生微孔,使药物暴露在纳米粒表面逐渐溶解释放,达到长效缓释目的[8]。此外,PLGA作为最常用的生物相容性和生物可降解聚合物之一,具有良好的成囊和成膜的性能,被FDA批准为最常用的纳米材料之一,正式作为药用辅料收录进美国药典[9]。
到目前为止,有较多国外文献报道将多糖包载于PLGA纳米粒中,如Luo等[10]制备了山药多糖PLGA纳米粒,发现山药多糖PLGA纳米粒比游离山药多糖更有效的促进淋巴细胞增殖和触发T淋巴细胞向T h细胞转化。Wu sim an等[11]将A l h ag e蜂蜜多糖包封于PL GA纳米粒中能够有效的提高Alhage蜂蜜多糖的免疫效果。Gu等[12]将当归多糖封装于PLGA纳米粒中,与PLGA建立了一个纳米粒药物递送系统,使当归多糖的免疫增强作用得到了显著改善。但是,未见有关无籽刺梨多糖纳米制剂的报道。故在前期实验的基础上,选取使用较为广泛的PLGA为纳米载体,采用双乳化溶剂蒸发法制备了无籽刺梨多糖PLGA纳米粒,并以多糖包封率为考察指标,通过单因素试验和响应面对制备工艺进行优化。以期为刺梨多糖制剂的研发提供参考。
1 仪器与试剂
1.1 试验仪器
紫外可见分光光度计(UV-5500PC,上海元析仪器有限公司);电子天平(BSM220.4,上海精卓电子天平有限公司);电热鼓风干(101-2AB,天津泰斯特仪器有限公司);离心机(Cence@H1650R,湘仪离心机仪器有限公司);一体式超纯水系统(PF1XXXXM1,上海威立雅水处理技术有限公司);超声波清洗器(SY-180,上海宁商超声仪器有限公司);激光粒度仪(NanoBrook Omni,美国布鲁克海文仪器公司);高分辨率透射电子显微镜(JEM-2100(UHR),日本电子株式会社仪器有限公司)。
1.2 试验药材与试剂
PLGA(上海源叶生物技术有限公司);无籽刺梨(贵州省盘县);泊洛沙姆P188(贵阳四面体化工有限公司);丙酮(贵阳四面体化工有限公司);所有化学品和试剂均为分析级。
2 方法
2.1 纳米粒的制备
采用双乳化-溶剂蒸发法[10]制备载药纳米粒和空白纳米粒:首先将多糖溶解到去离子水中(20 mg/mL),形成W1。再将PLGA分散到丙酮中得到O,通过超声作用将W1乳化到O中,超声功率为130 W,超声时间2 s、间隔时间3 s,形成PE。制备0.7%(W/V)的P188溶液,得到W2。在超声功率为150 W,超声时间2 s、间隔时间3 s作用下,将PE乳化到W2中,得到水包油包水(W/OW)的多糖纳米乳液。通过旋转蒸发仪在56℃下,旋蒸除去粗纳米乳液中残留的有机溶剂。随后通过以3500 r/min离心10 min,在上清液中收集多糖PLGA纳米粒。采用同样方法制备内水相中不含多糖的空白PLGA纳米粒。
2.2 包封率和载药量的测定
采用低温高速离心法测定包封率(Encapsula‑tion efficiency,EE)和载药量(Drug loading,DL)。在4℃下以12000 r/min离心30 min分离纳米粒和游离多糖,在上清液中通过硫酸-苯酚法测定游离多糖的含量[11]。将收集的多糖PLGA纳米乳液冷冻干燥,计算纳米粒的总质量。多糖EE计算如公式(1)所示,DL计算如公式(2)所示。
(1)EE%=[(总药量-游离药物量)/总药量]×100%
(2)DL%=[(总药量-游离药物量)/纳米粒总量]×100%
2.3 单因素试验
考察了四个单因素:内水相W1与有机相O的体积比、初级乳PE与外水相W2的体积比、泊洛沙姆P188的浓度和PLGA浓度对多糖PLGA纳米粒包封率的影响。
2.4 优化设计
在单因素试验的基础上,运用Design Expert 8.0.6软件程序,根据Box-Behnken中心组合实验设计原理,采用三因素三水平的响应面分析法,以内水相W1与有机相O的体积比(X1)、初级乳PE与外水相W2的体积比(X2)、泊洛沙姆P188的浓度(X3)为自变量,以多糖PLGA纳米粒的包封率为响应值,通过响应曲面分析(Response Surface Analysis,RSA),对纳米粒的制备工艺进行优化。试验因素与水平设计见表1。
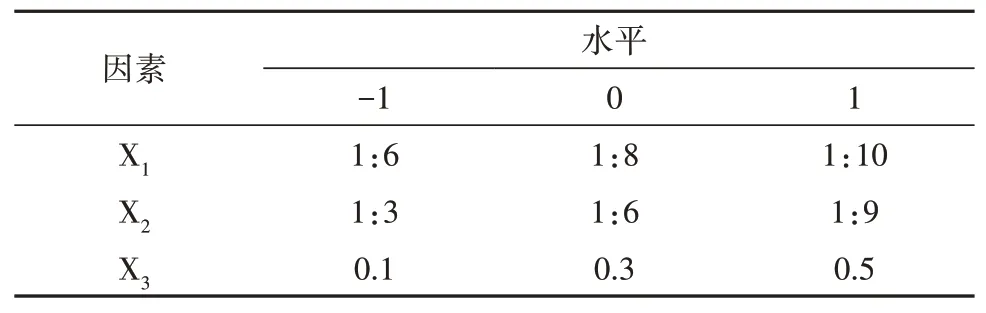
表1 响应面分析因素与水平编码表Table 1 Response surface analysis factors and levels coding table
2.5 多糖PLGA纳米粒的表征
利用透射电镜观察了纳米粒子的形貌。将多糖PLGA纳米粒冻干粉用蒸馏水溶解稀释,置于铜网上,磷钨酸染色后,透射电镜观察其形态特征[13];利用激光粒度分析仪测定多糖PLGA纳米粒和空白纳米粒的粒径、粒度分布和Zeta电位。
3 结果与分析
3.1 单因素试验结果
通过单因素试验发现,内水相W1与有机相O的体积比、初级乳PE与外水相W2的体积比和P188的浓度对多糖PLGA纳米粒的包封率影响较大,而PLGA的浓度对其包封率影响甚微。四个因素对包封率的影响如下所述。
3.1.1 内水相W1与有机相O的体积比对多糖PLGA纳米粒的包封率的影响
固定初级乳PE与外水相W2的体积比1:9和P188的浓度0.7%。如图1所示,当内水相W1与有机相O的体积比为1:8时,包封率有最大值,且随着有机相O体积增大时,包封率呈现先上升后下降的趋势。

图1 内水相W1与有机相O的体积比对多糖PLGA纳米粒的包封率的影响Fig.1 The influence of the volume ratio of internal water phase W1 to organic phase Oon the encapsulation efficiency of polysac‑charide PLGA nanoparticles
3.1.2 初级乳PE与外水相W2的体积比对多糖PLGA纳米粒的包封率的影响
固定内水相W1与有机相O的体积比1:10和P188的浓度0.7%。如图2所示,当初级乳PE与外水相W2的体积比为1:8时,包封率有最大值,随后包封率逐渐下降。
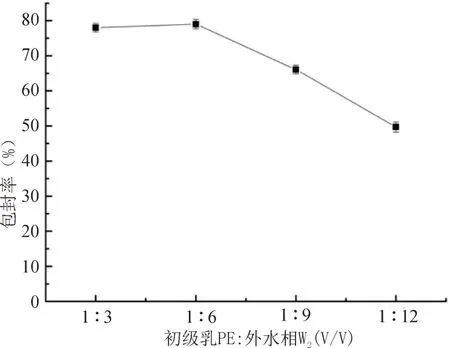
图2 初级乳PE与外水相W2的体积比对多糖PLGA纳米粒的包封率的影响Fig.2 The influence of the volume ratio of the primary milk PEto the outer water phase W2 on the encapsulation efficien‑cy of polysaccharide PLGA nanoparticles
3.1.3 P188的浓度对多糖PLGA纳米粒包封率的影响
固定内水相W1与有机相O的体积比1:10和初级乳PE与外水相W2的体积比1:9。如图3所示,随着P188浓度的增大,包封率逐渐下降,且在P188浓度为0.3%时包封率最大。

图3 P188的浓度对多糖PLGA纳米粒的包封率的影响Fig.3 The effect of P188 concentration on the encapsulation efficiency of polysaccharide PLGA nanoparticles
3.1.4 PLGA的浓度对多糖PLGA纳米粒包封率的影响
固定内水相W1与有机相O的体积比1:10、初级乳PE与外水相W2的体积比1:9和P188浓度0.7%。如图4所示,PLGA浓度的改变对包封率的影响甚微。
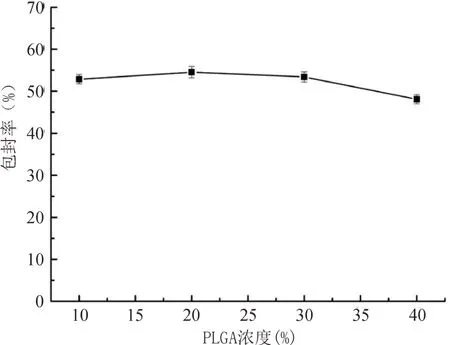
图4 PLGA的浓度对多糖PLGA纳米粒的包封率的影响Fig.4 The effect of PLGA concentration on the encapsulation efficiency of polysaccharide PLGA nanoparticles
3.2 优化设计
3.2.1 响应面试验结果
根据Box-Behnken设计进行了17组实验,其中5组中心点重复,结果见表2。利用Design Expert 8.0.6软件对表2试验数据进行二次多项回归拟合及对所得数据进行ANOVA分析,试验结果表明,RSSPLGA NPs的包封率与因素X1、X2和X3的二次多项回归方程为:


表2 试验设计及其结果Table 2 Experimental design and its results
该模型和模型系数的显著性检验结果如表3所示。可知,模型F=10.51,P<0.01,极显著,失拟项为P=0.3293(P>0.05),不显著,决定系数R2=0.9311,模型校正系数R2Adj=0.8425,说明本试验所选用的二次方程模型具有较高的显著性,可用于预测多糖PLGA纳米粒的制备工艺。由表3可知,各因素中一次项X3对多糖包封率线性效应显著(P<0.05),二次项中X12、X22是显著(P<0.05)。此外,由F值知,各因素对无籽刺梨多糖包封率影响为X3>X1>X2。

表3 回归模型的方差分析Table 3 ANOVA of regression models
3.2.2 响应面的优化与预测
利用Design-Expert 8.0.6软件绘制2个因素的交互作用对多糖PLGA纳米粒包封率影响的响应面及等高线,结果如图5所示。可知,因素X3对多糖PLGA纳米粒包封率的影响最为显著,其3D曲线最陡峭,其次为因素X1,最后是因素X2。再次,P188浓度与包封率呈反比关系,P188浓度减少,包封率增加,符合单因素试验结果。而内水相W1与有机相O的体积比和初级乳PE与外水相W2的体积比对包封率的影响为先增加后下降的趋势,因此,该两因素需选择在合理范围内。最后,由响应面法优化出多糖PLGA纳米粒最佳制备工艺条件,即X1=1:8.36,X2=1:7.07,X3=0.12%(W/V),在此参数下预测多糖PLGA纳米粒包封率为97.32%。

图5 各因素交互作用对多糖PLGA纳米粒包封率影响的响应面图和等高线图Fig.5 Response surface plot and contour plot of the influence of the interaction of various factors on the encapsulation rate of polysac‑charide PLGA nanoparticles
3.2.3 工艺验证
结合实际操作,将优化后的工艺参数调整为内水相W1:有机相O的比例为1:8,初级乳PE和外水相W2的比例为1:7,泊洛沙姆P188的浓度为:0.10%(W/V),重复3次的包封率分别为95.10%、96.02%、94.12%,平均包封率为95.08%,相对误差为2.31%,实际值与预测值基本吻合,表明了模型对多糖PLGA纳米粒制备工艺条件优化的可行性与准确性。
3.3 多糖PLGA纳米粒的表征
多糖PLGA纳米粒和空白PLGA纳米粒的透射电镜图如图6所示。由图知,多糖PLGA纳米粒和空白PLGA纳米粒均为近似球形,具有较光滑的表面,且为尺寸均匀的颗粒。此时,两种纳米粒子粒径相近约为110 nm。

图6 多糖PLGA纳米粒(A)和空白PLGA纳米粒(B)的透射电镜图Fig.6 TEM images of polysaccharide PLGA nanoparticles(A)and blank PLGA nanoparticles(B)
多糖PLGA纳米粒和空白PLGA纳米粒粒径大小与分布如图7所示,其平均粒径、多分散系数和Zeta电位如表4所示。由表知,载药后的纳米粒子粒径略微增大,多分散系数降低,且Zeta电位绝对值有所提高,表明整个体系更加趋于均匀与稳定。此外,由透射电镜与激光粒度仪所得纳米粒粒径有一定差别,透射电镜测得粒径约为110 nm,激光粒度仪测得粒径约为220 nm。这是由于两种测试方式的区别造成的,透射电镜是对纳米粒进行脱水处理,而激光粒度仪分析的纳米粒为水合的[10]。

图7 多糖PLGA纳米粒(A)和空白PLGA纳米粒(B)的粒径分布图Fig.7 The particle size distribution of polysaccharide PLGA nanoparticles(A)and blank PLGA nanoparticles(B)

表4 多糖PLGA纳米粒和空白PLGA纳米粒的粒径、多分散系数和Zeta电位值Table 4 Particle size,polydispersity coefficient and Zeta po‑tential of polysaccharide PLGA nanoparticles and blank PLGA nanoparticles
4 结论
植物多糖是天然的高分子聚合物,具有多种生物活性,如抗氧化、抗肿瘤、防治糖尿病和降血脂等[14-17],而多糖纳米制剂的开发不仅能提高其稳定性和生物利用度,还具有靶向性好、生物相容性高的优势[18]。因此,选取无籽刺梨多糖为原料,通过双乳化溶剂蒸发法制备了多糖PLGA纳米粒。在单因素的基础上,利用响应面法对工艺条件优化,得到其制备工艺参数为内水相W1和有机相O的比例为1:8,初级乳PE和外水相W2的比例为1:7,泊洛沙姆P188的浓度为0.1%(W/V)。在该工艺条件下,多糖PLGA纳米粒呈粒径均匀的球形,表面较光滑,包封率高。以空白纳米粒作为对比,发现多糖PLGA纳米粒较空白PLGA纳米粒粒径有所增大,多分散系数减小、Zeta电位绝对值增大,表明多糖PLGA纳米粒体系更加趋于稳定。通过对无籽刺梨多糖PLGA纳米粒的制备工艺进行优化与表征,以期为无籽刺梨多糖纳米制剂的研发与规模化制备提供实验参考。

