亚砷酸钠对小鼠肝细胞AML12损伤的作用机制*
赵哲仪, 王正蓉, 方兴艳, 王甜, 罗昭逊, 谢婷婷*
(1.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 2.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 3.贵州医科大学附属医院 产前诊断中心, 贵州 贵阳 550004; 4.山东省立第三医院 检验科, 山东 济南 250031; 5.贵州医科大学 儿科学院, 贵州 贵阳 550004)
砷(arsenic,As)是一种分布广泛且具有致癌作用的类金属元素,被世界卫生组织认定为危害全球公众健康的十大化学物质之一[1-2]。As及其化合物常通过皮肤系统、呼吸系统或胃肠道系统进入体内导致肝脂肪变性、肝纤维化、肝硬化及肝癌等一系列肝脏疾病[3-4]。尽管已有研究表明氧化应激、脂肪变性及凋亡过程参与As致肝损伤疾病的发生发展,但相关机制尚未完全阐明[5-6]。法尼醇X受体(farnesoid X receptor,FXR)与小异二聚体伴侣(small heterodimer partner,SHP)属于核受体超家族成员,其所构成的信号通路不仅参与调节肝脏糖脂、胆汁酸等营养物质的新陈代谢,还与肝细胞氧化应激、凋亡密切相关[7-8],但目前尚未见有关As影响肝细胞FXR-SHP信号通路的相关报道。因此,本研究以小鼠肝细胞株AML12为对象、亚砷酸钠(sodium arsenite,NaAsO2)为处理因素,探究As对肝细胞氧化应激、脂肪变性、凋亡以及FXR-SHP通路的影响,以期为进一步阐明As致肝损伤机制提供依据。
1 材料与方法
1.1 实验材料
1.1.1细胞来源和主要药物 小鼠正常肝细胞AML12(中国科学院细胞库),NaAsO2(美国Merck)。
1.1.2主要试剂和仪器 2.5 g/L胰蛋白酶溶液、DMEM/F-12培养基、磷酸盐缓冲溶液(phosphate buffer saline,PBS)(美国Gibco公司),胎牛血清(美国Corning公司),青霉素和链霉素(美国Hyclone),细胞冻存液、油红O染色试剂盒、蛋白提取试剂盒及聚丙烯酰胺凝胶制备试剂盒(北京索莱宝),化学发光试剂盒(美国Millipore),TB Green Premix Ex TaqTMⅡ和Prime-ScriptTMRT reagent Kit with gDNA Eraser(日本TaKaRa),二辛可宁酸法(bicinchoninicacid,BCA)蛋白浓度测定试剂盒(上海碧云天),兔抗小鼠FXR单克隆抗体(美国Novus),兔抗小鼠SHP单克隆抗体(美国Affinity),兔抗小鼠Bax单克隆抗体(武汉三鹰),兔抗小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(英国Abcam)。
1.2 研究方法
1.2.1细胞培养、NaAsO2处理及分组 AML12细胞于含10%胎牛血清(fetal bovine serum,FBS)、1%青霉素-链霉素溶液的DMEM/F-12培养基中,5%CO2、37 ℃恒温条件下培养;取处于对数生长期的AML12细胞接种于6孔板中,待细胞融合率达80%时,弃原培养基,换含0、10、15、20、25及30 μmol/L NaAsO2的培养基继续培养24 h,对应设置为6个浓度组。以不含NaAsO2为对照组,其余各浓度为实验组。
1.2.2化学比色法检测细胞内丙二醛(malondialdehyde,MDA)含量 消化收集各组细胞,按100 ∶1的比例加蛋白裂解液、蛋白酶抑制剂提取各组总蛋白,并用BCA法检测各组蛋白浓度;按照试剂盒说明书配制相应的MDA检测体系,100 ℃水浴保温60 min,10 000 r/min常温离心10 min;吸取上清液200 μL于96孔板中,测定各组样本于波长450、532及600 nm处的吸光度,并计算每克样本质量中MDA的含量;每组样本均设置3个复孔,并重复3次实验。
1.2.3油红O染色法检测细胞内脂滴含量 各组细胞完成NaAsO2染毒处理后,弃去原培养基,PBS清洗细胞2次,按试剂盒说明书步骤对细胞进行固定及染色,加PBS覆盖细胞于倒置显微镜下观察并采集图像,使用Image pro plus 6.0软件分析细胞内脂滴光密度值。
1.2.4实时荧光定量PCR(reverse transcription realtime fluorescence quantitative PCR,RT-qPCR)检测细胞FXR和SHPmRNA表达 TRIzol法提取各组细胞的RNA,去除基因组DNA后合成cDNA。根据美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)提供的基因组序列设计引物(表1),并按照试剂说明书配制RT-qPCR反应体系,反应条件设为 ∶95 ℃预变性2 min,95 ℃变性5 s、60 ℃退火及延伸30 s、共40个循环。扩增完成后进行熔解曲线分析产物特异性。以GAPDH和次黄嘌呤鸟嘌呤磷酸核糖转移酶1(hypoxanthine-guanine phosphoribosyltransferase 1,HPRT1)为双内参基因,采用2-ΔΔCt计算出目的基因的相对表达量。每个样本重复检测3次,实验同时设无反转录酶对照和非模板对照。

表1 基因引物序列Tab.1 Gene primer sequence
1.2.5Western blot法检测细胞FXR、SHP及Bax蛋白表达 按100 ∶1的比例配制蛋白裂解液、蛋白酶抑制剂混合溶液提取各组细胞的总蛋白,并用BCA法测定蛋白浓度。将蛋白样本与5×十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)上样缓冲液按照1 ∶4比例充分混匀,置于100 ℃金属浴中加热8 min;各组蛋白均以上样量40 μg进行SDS-PAGE电泳分离,再转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上;经50 g/L牛血清白蛋白(bovine serum albumin,BSA)封闭2 h,吐温-Tris盐缓冲液(tris-buffered saline with tween20, TBST)洗膜3次、10 min/次,分别加兔抗小鼠FXR(1 ∶1 000)、SHP(1 ∶1 000)、Bax(1 ∶1 000)及GAPDH抗体(1 ∶10 000),4 ℃孵育过夜;TBST洗膜3次、10 min/次,加辣根过氧化物酶标记的山羊抗兔IgG二抗(1 ∶10 000),室温孵育2 h,TBST洗涤3次、10 min/次,采用化学发光(electrochemiluminescence,ECL)显影;采用Image J软件处理并分析图像,以GAPDH为内参照计算各目的蛋白的相对表达水平。
1.3 统计学分析
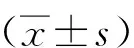
2 结果
2.1 MDA含量
化学比色法检测各组AML12细胞内MDA含量发现,与对照组相比,10~30 μmol/L NaAsO2组AML12细胞内MDA含量升高(P<0.05)。见图1。
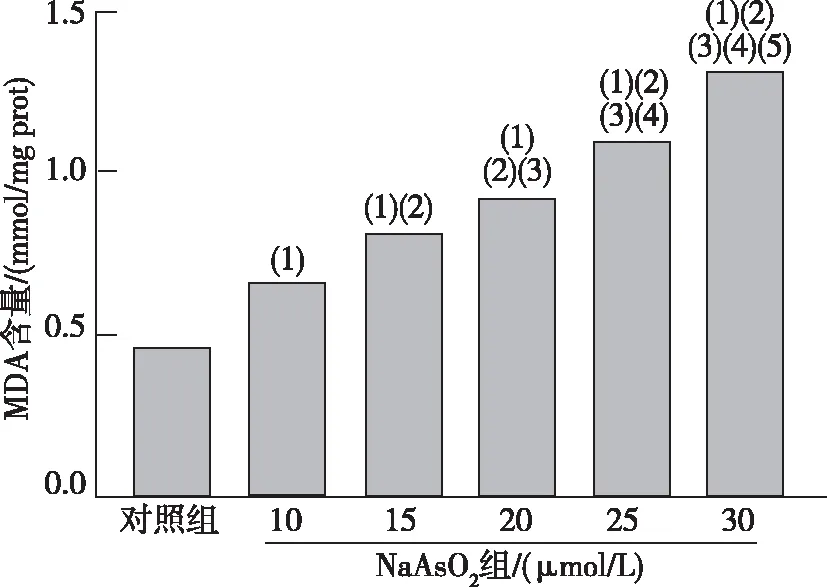
注:(1)与对照组比较,P<0.05;(2)与10 μmol/L NaAsO2组比较,P<0.05;(3)与15 μmol/L NaAsO2组比较,P<0.05;(4)与20 μmol/L NaAsO2组比较,P<0.05;(5)与25 μmol/L NaAsO2组比较,P<0.05。图1 各组AML12细胞中MDA含量Fig.1 The contents of MDA in hepatocyte AML12 of each group
2.2 脂滴含量
油红O染色结果表明,对照组AML12细胞轮廓清晰、胞浆内只见少许的橘黄色脂滴,其余NaAsO2组AML12细胞轮廓模糊、胞浆内存在大量绕核分布的橘黄色脂滴;与对照组相比,15~30 μmol/L NaAsO2组AML12细胞内脂滴含量增加,差异均有统计学意义(P<0.05)。见图2。
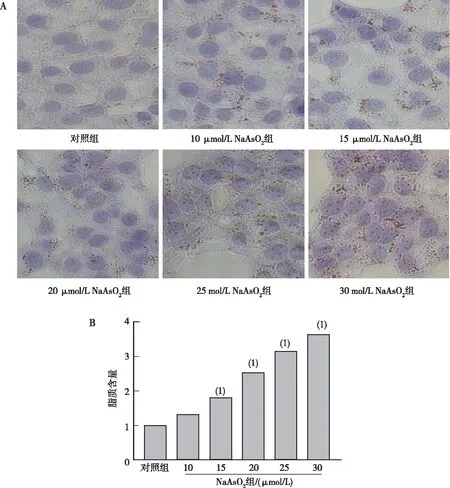
注:A为油红O染色法检测脂滴含量的结果(400×),B为脂滴含量的定量结果;(1)与对照组比较,P<0.05。图2 各组AML12细胞中的脂质含量Fig.2 The contents of lipid in hepatocyte AML12 in groups with different concentrations of NaAsO2
2.3 FXR和SHP mRNA的表达
RT-qPCR结果表明,与对照组相比,10~30 μmol/L NaAsO2组AML12细胞内FXR、SHPmRNA相对表达量下降,差异均有统计学意义(P<0.05)。见图3。
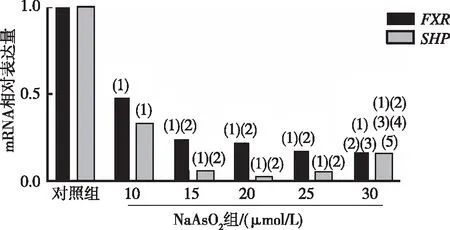
注:(1)与对照组比较,P<0.05;(2)与10 μmol/L NaAsO2组比较,P<0.05;(3)与15 μmol/L NaAsO2组比较,P<0.05;(4)与20 μmol/L NaAsO2组比较,P<0.05;(5)与25 μmol/L NaAsO2组比较,P<0.05。图3 各组AML12细胞中FXR和SHP mRNA的表达Fig.3 Expression of FXR and SHP mRNA in hepatocyte AML12 with different concentrations of NaAsO2
2.4 FXR、SHP及Bax蛋白表达
Western blot结果显示,与对照组相比,10~30 μmol/L NaAsO2组AML12细胞内FXR蛋白相对表达量降低(P<0.05),20~30 μmol/L NaAsO2组AML12细胞内SHP蛋白相对表达量降低(P<0.05),25~30 μmol/L NaAsO2组AML12细胞内BAX蛋白相对表达量增高(P<0.05)。见图4。

注:A为Western blot检测FXR、SHP及Bax蛋白的结果,B为FXR、SHP及Bax蛋白表达的定量结果;(1)与对照组比较,P<0.05;(2)与10 μmol/L NaAsO2组比较,P<0.05;(3)与15 μmol/L NaAsO2组比较,P<0.05;(4)与20 μmol/L NaAsO2组比较,P<0.05;(5)与25 μmol/L NaAsO2组比较,P<0.05。图4 各组AML12细胞中FXR、SHP及Bax蛋白的表达Fig.4 Expression of FXR, SHP, and Bax proteins in hepatocyte AML12 with different concentrations of NaAsO2
3 讨论
国内外已有研究发现,As可诱导肝细胞发生氧化应激、脂肪变性及凋亡,但其具体机制尚未阐明[9-11]。当机体发生氧化应激时,体内的氧化系统和抗氧化系统失衡会产生大量的活性氧使生物大分子发生过氧化从而导致组织细胞损伤[12]。此外,氧化应激还能通过促进脂质积累与细胞凋亡参与多种肝脏疾病的发生发展[13-14]。MDA是活性氧与生物膜的磷脂、膜受体相关的脂肪酸侧链等大分子物质发生脂质过氧化反应而生成的产物,其含量对评价氧化应激损伤尤为重要[15]。Bax作为B细胞淋巴瘤-2家族的促凋亡分子,可通过增强线粒体的通透性使得大量凋亡因子被释放,从而激活凋亡执行程序[16]。本研究通过体外构建As暴露肝细胞模型发现,随着NaAsO2质量浓度的增加,AML12肝细胞内MDA、脂滴含量及Bax蛋白相对表达量逐渐增加,提示As可以明显诱导AML12肝细胞发生氧化应激、脂肪变性及凋亡。
FXR和SHP均属于核受体超家族成员,在肝脏、胃肠道中表达丰富[17-18]。FXR作为配体依赖性的转录因子可通过结合SHP基因启动子区域的FXR结合位点,促进SHP基因的转录表达[19-20]。研究发现,FXR-SHP通路不仅可抑制肝脏脂肪的合成、降低肝脏中甘油三脂的含量,还与细胞氧化应激、凋亡存在密切联系[21-23]。在多种不同细胞系的研究中均发现,FXR和SHP能通过上调抗氧化酶以抵御氧化应激损伤[24-25]。而FXR和SHP在细胞凋亡中的作用存在争议,Lv等[23]发现FXR和SHP在胃癌上皮细胞中的表达量高于正常上皮细胞,且通过抑制FXR信号通路可使促凋亡分子半胱氨酸蛋白酶3和BAX的表达量升高。Haga等[26]发现激活FXR可上调SHP及抗凋亡蛋白B细胞淋巴瘤-2、B细胞淋巴瘤-xL的表达,从而抑制肝细胞发生凋亡;但Miyazaki等[27]发现上调FXR和SHP的表达可促进结肠腺癌细胞发生凋亡。本研究结果显示,NaAsO2可致AML12细胞中FXR、SHP的mRNA及蛋白表达量下调,提示As可能通过下调FXR-SHP信号通路,影响与氧化应激、脂代谢及凋亡相关靶基因的表达,从而导致肝损伤,但具体生物学机制有待深入研究。
综上所述,NaAsO2能导致AML12细胞发生氧化应激、脂肪变性及凋亡,其机制可能与As抑制FXR、SHP的表达相关。本研究仅初步探讨了FXR-SHP信号通路在As致肝损伤中的表达变化,还需利用干预实验进一步验证该信号通路在As致肝损伤过程中的具体作用。

