载Survivin-siRNA 和蛇床子素阳离子脂质体纳米粒的制备工艺优化
孙起超,白皓天,李娅兰,孟健男,郭雨薇,王 锐
(1.黑龙江中医药大学附属第一医院,2.黑龙江中医药大学,黑龙江哈尔滨 150040)
siRNA,是双RNA 分子类,又称为小干扰RNA。小干扰RNA 是一种双链小RNA 分子,由dsDNA 通过加工而成。Dicer 酶可以识别dsRNA并将其解包装在siRNA 中,这是一定长度和结构的RNA,即siRNA[1-3]。siRNA 具有细胞分子量大、转染效率低、细胞靶向性差、且在人体血液组织或者人体细胞质中大量存在时容易被人体肾小球滤过和人体内源酶所抑制降解,甚至可能会产生强烈的皮肤炎症反应以及较低的生物利用率等缺点[4,5]。蛇床子素是中药蛇床子中的一种脂溶性成分,研究证实其具有一定调节免疫和抑制肿瘤生长的作用[6]。阳离子脂质体对于siRNA 的细胞包封率相对较高,具有良好的细胞防御阴离子的能力和较强的细胞血清化学稳定性[7,8]。阳离子脂质体在体内可以减少药物毒性的同时也有细胞亲和性和靶向性。脂质体还能同时装载水溶性物质和脂溶性物质[9],由于siRNA 为水溶性物质,蛇床子素为脂溶性物质,利用阳离子脂质体这一优点,可以制备载siRNA 与蛇床子素阳离子脂质体纳米粒。本文利用阳离子脂质体可以同时装载脂溶性和水溶性成分的特性,采用薄膜分散法制备了载Survivin-siRNA 和蛇床子素阳离子脂质体纳米粒,采用单因素和正交实验法对其制备工艺进行优化。
1 材料与方法
1.1 材料
旋转蒸发仪OSB-2200(日本EYELA 株式社会),超声细胞破碎仪(美国SONICS 公司),酶联免疫检测仪SYNERGY H1(美国伯腾仪器有限公司),电位粒径仪Nano-ZS90(英国马尔文公司)。
DOTAP(上海斯信生物有限公司,批号:RD-01173),胆固醇(国药集团化学试剂有限公司,批号:20130618),透明质酸(上海源叶生物科技有限公司,批号:H02N8J47121),鱼精蛋白(上海源叶生物科技有限公司,批号:Z31O8H47046),siRNA/FAM-siRNA(苏州吉玛基因股份有限公司),DEPC(北京博奥拓达科技有限公司,CAS:1609-47-8),DSPE-PEG2000(上海源叶生物科技有限公司,批号:P31M8S32960)。蛇床子素(西安绿天生物技术有限公司)性状:白色精细粉末,水分:≤1.00%,重金属:≤10 ppm,砷盐:≤2 ppm,含量:≥98.0%。本品按《中国药典》2020 版附录有关项目检验方法。符合规定,可供药用。
1.2 实验方法
1.2.1 试剂配制 0.1%DEPC 水:取去离子水1 000 mL,精确加入DEPC 1 mL,保鲜膜密封瓶口,磁力搅拌过夜,配置成0.1% DEPC 水。200 μg/mL 鱼精蛋白:精确称取鱼精蛋白2 mg,放入处理过的10 mL容量瓶中,加入0.1%DEPC 水溶解定容。200 μg/mL透明质酸:精确称取透明质酸2 mg,放入处理过的10 mL 容量瓶中,加入0.1%DEPC 水溶解定容。10 mg/mL DSPE-PEG 2000:精确称取二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(LDSPE-PEG 2000)50 mg,放入处理过的5 mL 容量瓶中,加入0.1% DEPC 水溶解定容。
1.2.2 制备工艺 称取处方量的DOTAP 和胆固醇于100 mL 圆底烧瓶中,加入合适的氯仿溶解。待溶化完全,置于旋转蒸发仪上除去有机溶剂,直至脂质体在容器壁上形成一层薄膜。放置于真空干燥箱内完全除去有机溶剂。加入适量的0.1% DEPC水洗下薄膜。超声处理30 min,加入处方量蛇床子素,再按处方所需时间进行超声处理,细胞破碎仪下超声60 s,再缓慢过0.45 μm 微孔滤膜,重复过滤5~10 次,得到乳白色均匀混悬液。将载SurvivinsiRNA 从冰箱中取出,4 000 r/min 离心1 min,加入适量0.1% DEPC 水震荡充分溶解均匀。将siRNA溶液与等体积的透明质酸混合,震荡均匀,加入适量的鱼精蛋白,室温静置10 min 后,即制成HA-siRNA-鱼精蛋白复合物。将配置好的饱和蛇床子素的阳离子脂质体与HA-siRNA-鱼精蛋白复合物充分混合,室温静置10 min,加入适量的DSPE-PEG 2000,在50 ℃的水浴锅中放置10 min。即制成载Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒。
1.2.3 单因素考察实验
1.2.3.1 考察膜材比对包封率的影响 固定其他条件不变,使得DOTAP 与胆固醇的质量比为5∶1、4∶1、3∶1、2∶1、1∶1,按照“1.2.2”项下制备载蛇床子素脂质体,考察脂质体包封率的变化。
1.2.3.2 考察药脂比对包封率的影响 固定其他条件不变,制备蛇床子素与脂质体的质量比为1∶3、1∶4、1∶5、1∶6、1∶7 时,按照“1.2.2”项下制备载蛇床子素脂质体,考察脂质体包封率的变化。
1.2.3.3 考察超声时间对包封率的影响 固定其他条件不变,改变超声时间分别为40、50、60、70、80 min,按照“1.2.2 项下”制备载蛇床子素脂质体,考察脂质体包封率的变化。
1.2.3.4 考察旋蒸温度对包封率的影响 固定其他条件不变,改变旋蒸温度分别为20、30、40、50、60 ℃,按照“1.2.2”项下制备载蛇床子素脂质体,考察脂质体包封率的变化。
1.2.4 正交实验法优化蛇床子素脂质体处方工艺根据单因素实验分析结果旋蒸温度对蛇床子脂质体包封率的影响不显著(P>0.05),因此以单因素考察实验为依据,设定膜材比(A)、药脂比(B)、超声时间(C)为考察因素,以蛇床子素包封率(Y)为评价指标,采用L9(34)正交实验表,每个因素设置3 个水平。分别用代码1、2、3 表示,实验因素与水平安排见表1。
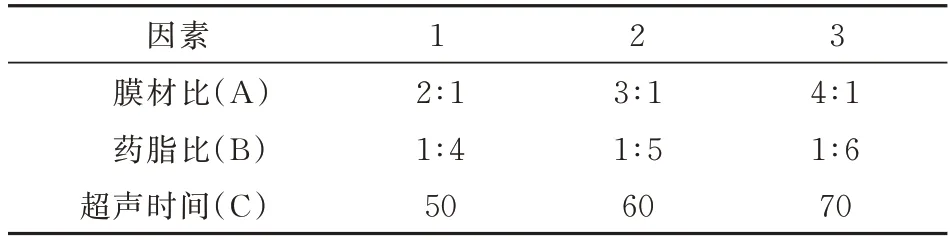
表1 正交实验法的因素水平表Tab 1 Factor level table of orthogonal experiment
1.2.5 HA-siRNA 与鱼精蛋白体积比考察 按照HA-siRNA 与鱼精蛋白的体积比为0.80∶1.00、0.85∶1.00、0.9∶1.00、0.95∶1.00、1.00∶1.00、1.05∶1.00 的比例,量取相应的HA-siRNA 和鱼精蛋白,分别加入到预先标记好的离心管中振荡混匀,在室温下放置10 min,通过电位粒径仪测定各复合物的粒径和Zeta 电位。
1.2.6 HA-siRNA-鱼精蛋白复合物与脂质体比例考察 取无酶原离心管,分别加入含有25 μg Survivin-siRNA 的HA-siRNA-鱼精蛋白复合物并进行标记,按照标记分别加入10、20、30、40、50、60、70 μL 的阳离子脂质体,将HA-siRNA-鱼精蛋白复合物与已配置好的阳离子脂质体均匀混合,在室温下静置10 min,通过电位粒径仪测定所得脂质体纳米粒的粒径和电位大小。
1.2.7 脂质体纳米粒包封率测定方法的建立1.2.7.1 标准曲线的建立 将荧光标记的SurvivinsiRNA(FAM-Survivin-siRNA)溶解在适量的0.1% DEPC 水中制备成FAM-siRNA 储备溶液。取0.1% DEPC 水将储备液分别稀释成0.05、0.10、0.15、0.20、0.25、0.30 μg/μL 不同浓度梯度的标准溶液。在492 nm 条件下,通过酶联免疫检测仪测定各组吸光度值。
1.2.7.2 精密度试验 按照最佳工艺条件下制备FAM-Survivin-siRNA 溶液,在492 nm 条件下测定吸光度值,平行测定5 次,记录吸光度值。
1.2.7.3 重复性试验 按照最佳工艺条件下制备6 份共载FAM-Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒溶液,在492 nm 条件下分别于0、15、30、45、60、75 min 时测定,记录吸光度值。
1.2.7.4 加样回收率试验 按照最佳工艺条件下制备已知浓度的6 份共载FAM-Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒溶液,分别加入标样,按“1.2.7.1”项下测定吸光度值,计算FAM-SurvivinsiRNA 浓度,计算样品加样回收率。
1.2.7.5 含量测定 按照最佳工艺条件下制备共载FAM-Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒。取适量的溶液进行离心,取上清液,在492 nm条件下,采用多功能酶标仪测定吸光度值,根据标准曲线计算出游离FAM-Survivin-siRNA 浓度,记为C。
载药量计算公式:载药量=微粒制剂中所含有的药物÷微粒制剂的总量×100%
包封率计算公式:EE(%)=(M-C×V)÷M×100%。其中EE 是包封率,V 是样品体积,M 是溶液中总的FAM-Survivin-siRNA 的含量。
2 结果
2.1 膜材比对包封率的影响
膜材比在5∶1 至3∶1 的范围内随比例降低而升高。但随后又进而降低,见表2。膜材比为4∶1、3∶1、2∶1 时脂质体的包封率较高,故选取4∶1、3∶1、2∶1 为膜材比的3 个水平。
表2 膜材比对包封率的影响()Tab 2 Influence of film to material ratio on encapsulation rate()
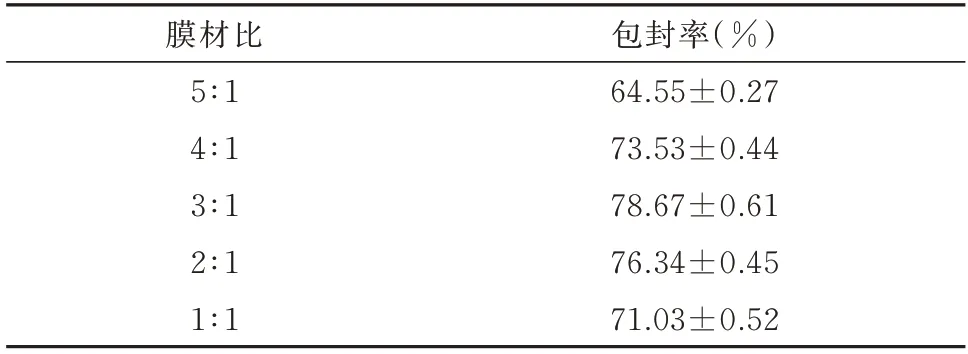
表2 膜材比对包封率的影响()Tab 2 Influence of film to material ratio on encapsulation rate()
2.2 药脂比对包封率的影响
药脂比越大,包封率越大;反之,包封率越小,见表3。综合考虑载药量以及包封率两种指标,选择1∶4、1∶5、1∶6 为药脂比的3 个水平。
表3 药脂比对包封率的影响()Tab 3 Influence of drug to lipid ratio on encapsulation rate()

表3 药脂比对包封率的影响()Tab 3 Influence of drug to lipid ratio on encapsulation rate()
2.3 超声时间对包封率的影响
当超声时间在40~60 min 内,包封率随时间的增大而增大。60 min 后包封率逐渐降低,见表4。超声时间为50、60、70 min 时脂质体的包封率较高,故选择50、60、70 min 为超声时间。
表4 超声时间对包封率的影响()Tab 4 Influence of ultrasonic time on encapsulation rate()

表4 超声时间对包封率的影响()Tab 4 Influence of ultrasonic time on encapsulation rate()
2.4 旋蒸温度对包封率的影响
旋蒸温度在达到30 ℃之前,包封率随温度的升高而上升,30 ℃后包封率随温度的升高而降低,见表5。旋蒸温度为20、30、40 ℃时脂质体的包封率较高,在30 ℃时包封率最高,故选择30 ℃为最佳的旋蒸温度。
表5 旋蒸温度对包封率的影响()Tab 5 Influence of rotary steam temperature on encapsulation rate()
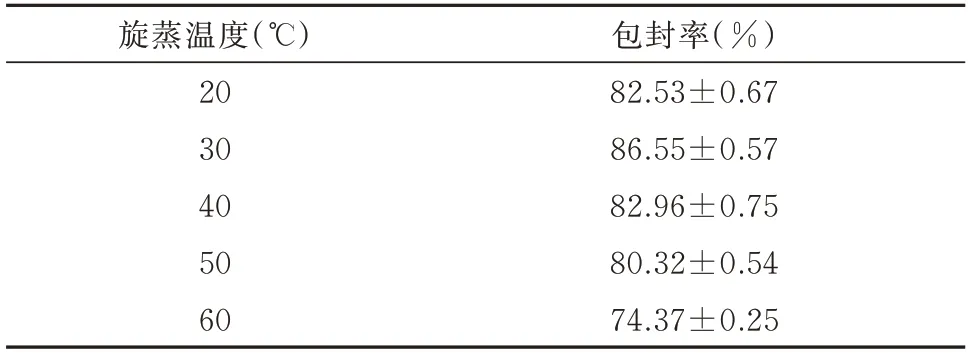
表5 旋蒸温度对包封率的影响()Tab 5 Influence of rotary steam temperature on encapsulation rate()
2.5 正交实验结果分析
正交实验设计结果和方差分析分别见表6 和表7,由表6 可得,C 的极差R 最大,其次是B、A。由于因素的极差越大,对包封率的影响程度就越高,因此A、B、C 3 个因素对包封率影响的大小依次为:C>B>A,即超声时间>膜材比>药脂比。从各因素水平看(K 值分析),A 因素为K2>K1>K3,B 因素为K2>K1>K3,C 因素为K3>K1>K2。由表3 方差结果分析显示,A、B、C 都对包封率有一定影响,其中C 对包封率有显著影响。由上述分析可以确定的最优方案为:膜材比为3∶1,药脂比为1∶5,超声时间为70 min。

表6 正交实验安排结果Tab 6 Arrangement results of orthogonal experiment
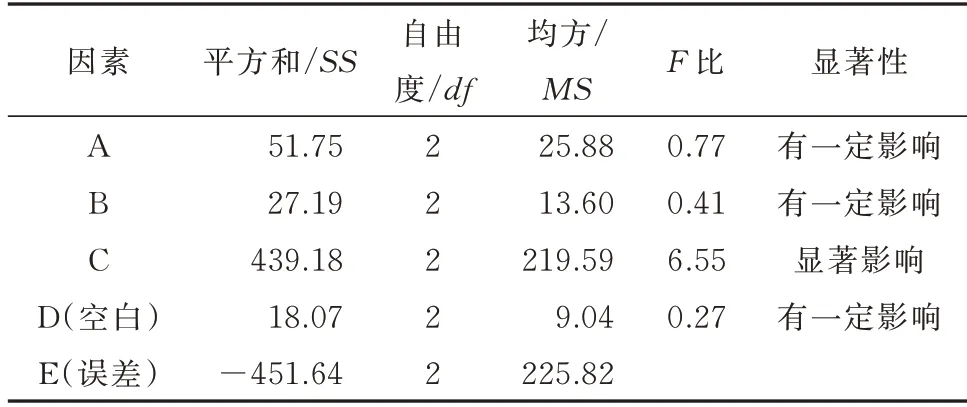
表7 方差结果分析Tab 7 Analysis of variance results
2.6 HA-siRNA 与鱼精蛋白的体积比例
当HA-siRNA-鱼精蛋白体积比为0.9 时,复合材料粒径最大,一般为中性。随着HA-siRNA 比重的增加,复合物的粒径和Zeta 电位迅速减小,见表8。因此,笔者认为1.0 是HA-siRNA 和鱼精蛋白的最佳体积比,在这个比例下,复合物是一个小的负电荷粒子。

表8 HA-siRNA 与鱼精蛋白复合物的粒径和电位Tab 8 Size and potential of HA-siRNA and protamine complexes
2.7 HA-siRNA-鱼精蛋白复合物与脂质体的比
随着脂质体量的增加,总粒径呈现先增大后减小的趋势,而Zeta 电位则持续增大。50 μL 为最佳阳离子脂质体合成量;合成的纳米颗粒粒径为127.1 nm,Zeta 电位为43 mV,见表9。
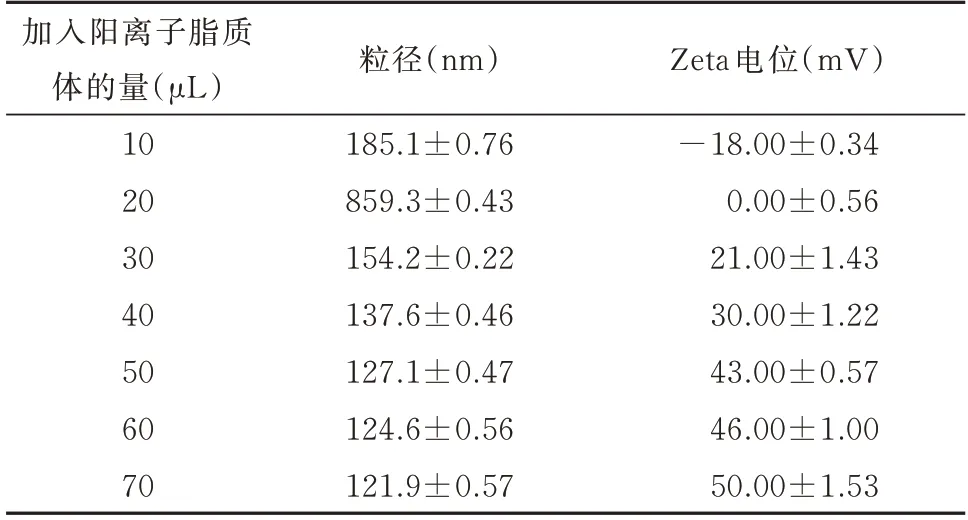
表9 HA-siRNA-鱼精蛋白复合物与不同量脂质体结合的粒径和电位Tab 9 Size and potential of HA-siRNA-protamine complex binding with different amounts of liposomes
2.8 最佳工艺
采用薄膜分散法,称取DOTAP 与胆固醇的质量比为3∶1,加入到圆底烧瓶中加入适量的三氯甲烷,30 ℃旋蒸直到瓶底形成一侧脂质体薄膜,真空干燥2 h 除去有机溶剂,加入10 mL 去离子水,超声处理30 min,按照蛇床子素与脂质体的比为1∶5,加入处方量的蛇床子素,超声70 min,得到乳白色载蛇床子素脂质体。
取冻存的S urvivin-siRNA,4 000 r/min 离心1 min,加入DEPC 水震荡摇晃使其溶解。取含有25 μg Survivin-siRNA 的溶液加入等质量的透明质酸溶液混合,室温静置10 min 形成HA-siRNA。以HA-siRNA 与鱼精蛋白的体积比为1∶1 进行混合,室温静置10 min,形成HA-siRNA 鱼精蛋白复合物。在配置好的H A-siR N A 鱼精蛋白复合物中加入50 μL 的载蛇床子素脂质体,室温静置10 min。加入50 μL DSPE-PEG 2000,在50 ℃水浴锅中静置10 min。载Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒制备完成。
2.9 最佳工艺验证
按照正交实验法挑选出最佳的载蛇床子素脂质体的制备工艺,按照最佳工艺制备平行三次测定包封率,并将实测值与预测值进行比较,计算两值之间的误差。实验结果见表10。

表10 验证实验结果表Tab 10 Verification experimental results
结果分析:载蛇床子素脂质体包封率的预测值与实际值的相对偏差小于5%,证明该工艺准确可靠,重复性良好,正交实验所建立的方法预测性良好。
2.9.1 脂质体纳米粒的表征
2.9.1.1 脂质体纳米粒的电位与粒径 按照最佳工艺条件下制备的载Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒样品,分别取适量样品加入比色皿和样品池中,用电位粒径仪测定粒径和电位。通过最佳工艺进行5 次测定,制得的载S urvivin-siRN A 与蛇床子素阳离子脂质体纳米粒的粒径为(132.3±0.2)nm,电位为(43.15±0.05)mV。
2.9.1.2 透射电镜观察脂质体纳米粒的外观 按照“2.8 项下”最佳工艺制备共载Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒,取5 μL 滴加在铜网上,室温静置至干燥。将铜网置于透射电镜下观察脂质体的形态。观察结果见图1。如图所示,共载Survivin-siRNA+蛇床子素阳离子脂质体纳米粒呈不规则的类圆形。

图1 脂质体透射电镜图Fig 1 Transmission electron microscopy of liposomes
2.9.2 脂质体纳米粒包封率的检测
2.9.2.1 标准曲线的制作 按“1.2.7.1”项下方法,以吸光度为纵坐标,FAM-Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒溶液为横坐标,建立标准曲线,结果见表11、图2。

表11 不同浓度标准溶液吸光度值Tab 11 Absorbance values of standard solutions of different concentrations
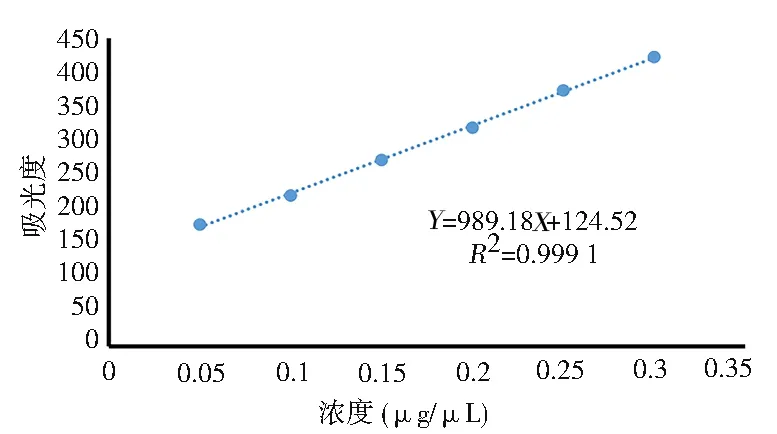
图2 标准曲线Fig 2 Standard curve
绘制成吸光度(Y)对于FAM-Survivin-siRNA浓度(X)的标准曲线,得到标准曲线方程:Y=989.18X+124.52(R2=0.999 1)。结果表明,吸光度与FAM-Survivin-siRNA 浓度在0.05~0.30 μg/μL 范围内呈良好的线性关系。
2.9.2.2 精密度试验结果 按照“1.2.7.1”项下方法制备FAM-Survivin-siRNA 溶液,“1.2.7.2”项下方法在492 nm 条件下测定吸光度值,平行测定5 次,结果RSD=1.28%(n=5),结果表明精密度良好。
2.9.2.3 重复性试验结果 按照最佳工艺条件下方法制备6 份共载FAM-Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒溶液,“1.2.7.3”项下方法在492 nm 条件下测定吸光度值,结果RSD=1.80%,表明重复性良好。
2.9.2.4 加样回收率试验结果 按“1.2.7.1”项下测定吸光度值,“1.2.7.4”项下计算FAM-Survivin-siRNA浓度,试验所得平均回收率为97.09%,RSD 值为1.58%,表明该方法准确度良好。
2.9.2.5 含量测定结果 按“1.2.7.5”项下方法进行检测,检测结果见表13。
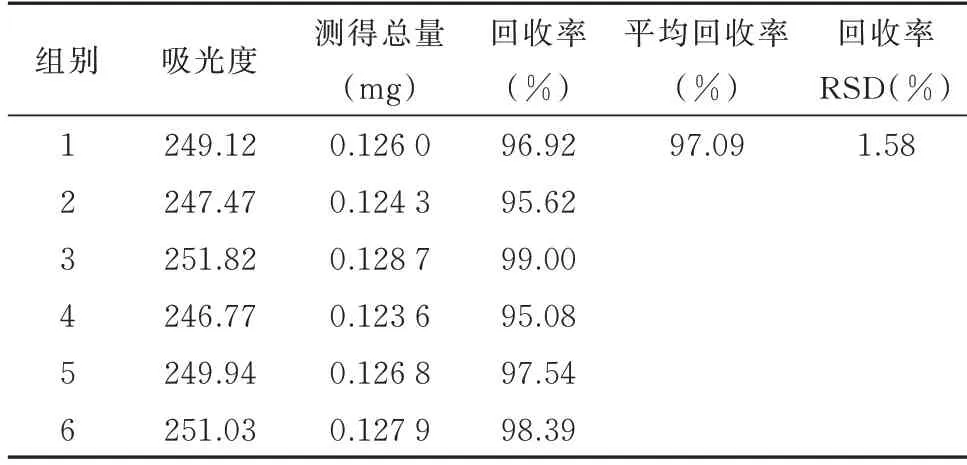
表12 加样回收率测定结果Tab 12 Determination results of recovery of added sample
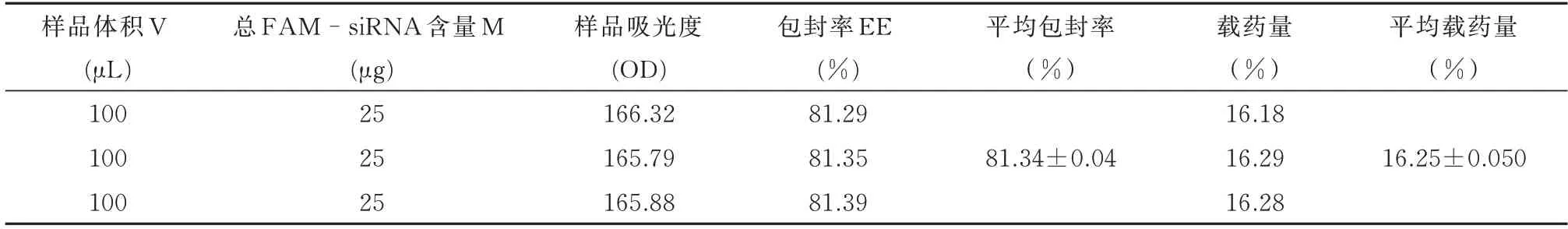
表13 载Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒包封率Tab 13 Encapsulation rate of Survivin-siRNA and osthol cationic liposome nanoparticles
根据测定结果计算得,载FAM-Survivin-siRNA 与蛇床子素阳离子脂质体纳米粒的包封率为(81.34±0.04)%,证明Survivin-siRNA 在脂质体中具有较好的包封率。
3 讨论
阳离子脂质体是被广泛使用的一种非病毒载体,具有磷脂双分子层结构,由于细胞膜带负电,阳离子脂质体与细胞膜有较强的亲和力,利于阳离子脂质体进入细胞内进行药物运输。制备脂质体常用的薄膜分散法[10,11],它主要是将磷脂和胆固醇等成膜材料直接溶于少量有机溶剂,真空旋蒸除去多余的有机溶剂至圆底烧瓶底部形成一层脂质体分散薄膜,使用蒸馏水和其他介质加热水化脂质体分散薄膜,得大单室的脂质体,再经超声可得不同粒径的脂质体[12]。它具有制备简单、包封率较高等优点。在制备脂质体时注意,为防止siRNA 酶解,需要将所用的实验器材用0.1% DEPC 水进行过夜浸泡,并进行高温灭菌后使用。采用电荷自主装原理,将带负电荷的siRNA 与带正电荷的阳离子脂质体通过电负荷的作用结合在一起,但是siRNA 的分子量太小,当其单独与阳离子脂质体结合时会不稳定的产生聚合作用。因此,选择透明质酸与siRNA形成带负电的共轭物在与带正电荷的鱼精蛋白通过电荷作用自主装形成HA-siRNA 鱼精蛋白复合物[13]。在测定载Survivin-siRNA 与蛇床子素脂质体纳米粒的包封率时应注意siRNA 易降解,在使用酶标仪进行检测时,标准液应现配现用,迅速完成。
粒径是影响脂质体在体内被动靶向作用的重要理化因素[14]。有研究发现,粒子粒径在100 nm 时具有高透膜性,100~200 nm 内具有较高的透膜性,而大于500 nm 时很难透过上皮细胞膜[15-17]。Zeta 电位是用来评估脂质体稳定性大小的重要指标之一[18-20]。通常情况下,Zeta 电位的绝对值通常大于60 mV 的这个时候脂质体处于最稳定的状态;Zeta电位的绝对值在30~60 mV 时比较稳定;但是当Zeta 电位的绝对值通常低于30 mV 时,脂质体不稳定且容易迅速发生凝聚。

