不同人抗狂犬病病毒抗体检测方法分析*
王兆胜,梁振山,李梦檀,李林蔓,彭小婉,崔为国
(1.郑州市惠济区人民医院公共卫生科,郑州 450044;2.河南省疾病预防控制中心,郑州 450016)
狂犬病是严重危害我国人民群众身体健康和生命安全的传染性疾病之一,目前尚无特效治疗药物,病死率几乎100%。中国每年狂犬病发病人数排世界第二位,狂犬病疫苗使用量为全球第一位[1]。世界卫生组织(WHO)规定,人体狂犬病病毒中和抗体(rabies virus neutralizing antibody,RVNA)水平≥0.5 IU·mL-1时,其抗体水平可提供足够的免疫保护作用;当RVNA水平<0.5 IU·mL-1时,抗体水平尚未达到保护水平,需接种疫苗进行加强免疫[2]。对于免疫低下或服用免疫制剂的狂犬病疫苗接种者,在接种疫苗后检测RVNA水平,可及时发现可能的狂犬病疫苗免疫失败者。因此,RVNA水平的检测对预防狂犬病有至关重要的作用。
目前有多种人抗狂犬病病毒抗体检测方法。本研究运用世界卫生组织推荐的RVNA检测的标准方法快速荧光灶抑制试验(rapid fluorescent focus inhibition test,RFFIT)[3]和酶联免疫吸附试验(enzyme linked immunosorbent assy, ELISA)、胶体金检测方法(colloidal gold, CG),分别对同一批样品进行了对比试验,以RFFIT作为金标准比较不同诊断方法之间的差异性,报道如下。
1 对象与方法
1.1 对象 为接种狂犬疫苗全程免疫的182例犬伤患者,抽取血液进行检测。
1.2 方法
1.2.1 试剂盒 由北京博雅晟康医学科技有限公司生产的狂犬病中和抗体检测试剂盒(RFFIT,批号:BYPH191009001)。由郑州亿特生物技术有限公司(简称亿特)生产的狂犬病毒抗体(IgG)检测试剂盒(ELISA,批号为201701011),北京万泰生物药业股份有限公司(简称万泰)生产的人狂犬病病毒IgG抗体测定试剂盒(ELISA,批号:20180201),北京中检安泰诊断科技有限公司生产的人狂犬病毒IgG抗体检测试剂盒(CG,批号:20170601)。
1.2.2 RFFIT检验原理 将样品和标准品做系列稀释,分别与狂犬病病毒悬液混合,感染敏感细胞,在规定的时间内用荧光抗体染色并观察荧光灶减少的情况,以测定样品效价。
1.2.3 实验前准备材料 ①细胞准备:准备生长良好的BSR/BHK-21细胞,使用前消化调整细胞密度至1×106个·mL-1。②病毒准备:将CVS-11病毒种子用细胞培养液稀释至80%~95%感染量,滴度不得小于106FFU·mL-1,病毒现用现配。
1.2.4 操作步骤 ①在96孔细胞培养板中每孔加入100 μL细胞培养液。②在A1-E1每孔分别加入50 μL待检样品,F1-H1每孔分别加入50 μL标准参考品及阴、阳性内控品,即为1∶3稀释度,用移液器反复吹打充分混匀。③吸取A1-H1孔中试液50 μl移至A2-H2孔,成为1∶9的稀释度,反复吹打充分混匀。④重复3操作,将试液系列稀释至A12-H12孔,A12-H12孔中多余的50 μL试剂弃掉。⑤向每孔加入50 μL狂犬病毒(80%~95%感染量),混匀后37 ℃孵育1 h。⑥加样后30分钟准备1×106个·mL-1细胞悬液,第5步结束后,向96孔培养板中每孔加入50 μL细胞悬液,5%二氧化碳37 ℃条件下培养24 h。⑦待培养结束弃培养液,并尽量扣干。每孔加入洗液200 μL清洗,并扣干。⑧每孔加入预冷至4 ℃的固定液50 μL,4 ℃固定30 min,弃去固定液,挥发干燥充分。⑨加入混合好的检测液,50 μL孔,37 ℃避光孵育30 min,打开荧光显微镜预热。⑩孵育完成后弃上清,向每孔中加入200 μL洗液,连续清洗3次,清洗完后扣干。每孔中加入50 μL封闭液,均匀铺底后即可观察。荧光显微镜下判断细胞感染量,计算样品滴度。
1.2.5 亿特狂犬病毒抗体(IgG)检测试剂盒(ELISA) 微孔上包被的狂犬病毒抗原,可与待测样本中特异性抗体反应,形成抗原-抗体复合物被吸附到固相上,再加入酶标记的抗人IgG。洗涤后,加入显色剂显色,为阳性;加入显色剂不显色,为阴性。当人血清或血浆中的狂犬病毒抗体(IgG)≥0.5 IU·mL-1以上,具有免疫保护水平。
1.2.6 万泰人狂犬病病毒IgG抗体测定试剂盒(ELISA) 本试剂盒采用间接法ELISA原理。在微孔条上预包被的狂犬病毒抗原可与样品中的狂犬病毒抗体结合,洗板后加入酶标试剂进行二次温育。当样品中存在HRV-IgG抗体时,将形成“包被抗原一抗体一酶标二抗”复合物。若样品中无HRV-IgG抗体时,不显色。通过酶标仪检测吸光度(A值),用校准品浓度值与A值拟合双对数曲线,计算样品中 HRV-IgG抗体含量,≥0.5 IU·mL-1时,达到保护作用。
1.2.7 安泰公司生产的人狂犬病毒IgG抗体检测试剂盒(CG) ①本方法是采用胶体金免疫层析原理,在硝酸纤维素膜上的检测线包被重组狂犬病毒抗原,在质控线包被山羊抗小鼠IgG多克隆抗体,在金标垫上包被胶体金标记的小鼠抗人IgG单克隆抗体。②结果判定。阴性:只在质控线(C)位置出现一条红色条带。阳性:质控线(C)和检测线(T)位置出现两条红色条带。无效:质控线(C)位置没有出现红色条带。
1.2.8 评价指标 为了更好地说明不同检测方法的可靠性,研究中利用RFFIT检测结果与亿特公司ELISA、万泰公司ELISA、CG进行对比分析。见表1。
表1 评价检测方法和金标准关系的模式表
假阴性率=c/(a+c)×100%
假阳性率=b/(b+d)×100%
一致率=(a+d)/n×100%
Kappa值=(Po-Pe)/(1-Pe)
Po:实际一致率=(a+d)/n
Pe:理论一致率=(a+b)(a+c)+(c+d)(b+d)/n2
Kappa一致性检验的评定标准:Kappa>0.8,表明两种方法检测结果几乎完全一致;0.8≥Kappa>0.6,两种方法检测结果为高度的一致性;0.6≥Kappa>0.4,两种方法检测结果为中等的一致性;0.4≥Kappa>0.21,两种方法检测结果为一般的一致性;Kappa≤0.20,两种方法检测结果为极低的一致性。
1.3 统计学处理 本研究数据采用Excel录入信息,用IBM SPSS 19.0统计软件进行处理分析。
2 结果
2.1 不同检测方法的结果 分别用四种检测方法对182份人血清标本进行抗狂犬病病毒抗体检测,RFFIT检出的阳性样品数为175份,阴性为7份;亿特ELISA检出的阳性样品数为171份,阴性为11份;万泰ELISA检出的阳性样品数为181份,阴性为1份;CG检出的阳性样品数为166份,阴性为16份。与金标准相比,亿特ELISA的假阴性率为2.86%、假阳性率为14.29%;万泰ELISA的假阴性率为0.57%、假阳性率为100.00%;CG假阴性率为6.29%、假阳性率为28.57%。从结果中可以发现,万泰ELISA的敏感性较高,亿特ELISA的特异性好。亿特ELISA与RFFIT的一致率为96.70%,K值为0.65;万泰ELISA与RFFIT的一致率为95.70%,K值为0.01;CG与RFFIT的一致率为92.86%,K值为0.40。从一致率方面分析,亿特ELISA、万泰ELISA、CG与RFFIT检测结果的一致率都高于92.00%;从Kappa值方面分析,亿特ELISA与RFFIT的K值为0.65,介于0.61~0.80,二者具有高度的一致性;CG与RFFIT的K值为0.40,介于0.21~0.40,二者具有一般的一致性;万泰ELISA与RFFIT的K值为0.01,介于0.00~0.20,二者具有极低的一致性。见表2。
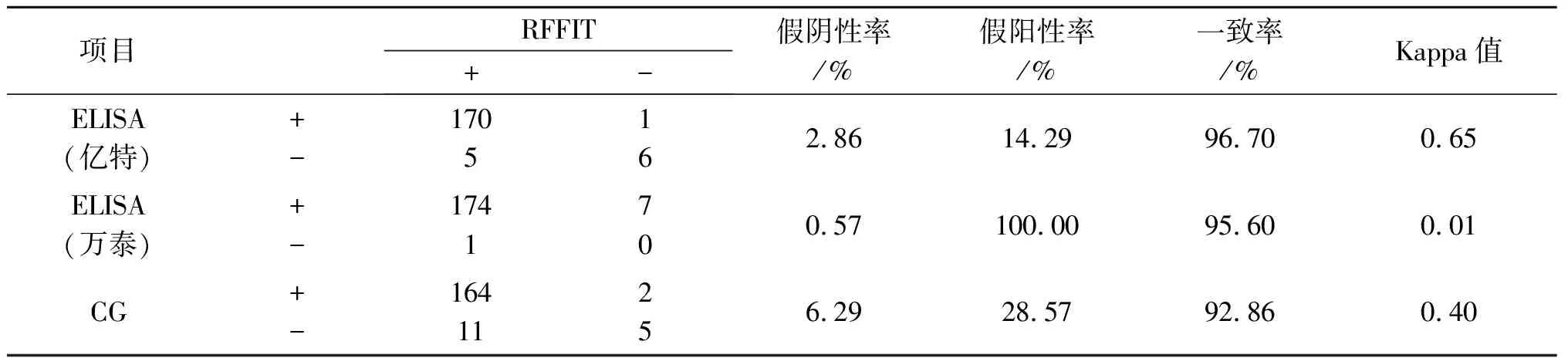
表2 RFFIT与亿特ELISA、万泰ELISA和CG检测同一批血清标本的抗狂犬病病毒抗体结果
2.2 不同人抗狂犬病病毒抗体检测方法的比较 在四种人抗狂犬病病毒抗体检测方法中,RFFIT是WHO标准检测方法,可信度强,但检测条件要求和成本比较高;ELISA和CG要求的检测条件和成本比较低、操作简便、便于推广,但准确性低于RFFIT。综合不同检测方法的特点,可用CG和ELISA进行初筛,用RFFIT进行确证。见表3。

表3 不同狂犬病毒抗体检测方法的比较
3 讨论
从2021年12月25日在北京举办的2021年动物致伤防治高峰论坛获知,中国每年有4 000多万人被犬、猫所伤,因动物致伤而进行狂犬病预防处置的人数超过1 000万,人接种狂犬病疫苗、注射免疫球蛋白和伤口医疗处置的费用超过70多亿元[4]。我国每年大量人群接种狂犬病疫苗后,由于受多种因素影响,不能使所有接种者产生足够的保护性抗体,因此,进行抗体检测非常必要。
不同人抗狂犬病病毒抗体检测方法各有特点[5]。世界卫生组织推荐RFFIT来体外评估血清中RVNA[6-7]。此方法需要昂贵的FITC 标记的狂犬病病毒抗体,实验周期较长,需要在人工显微镜下观察;实验用到高致病性的狂犬病病毒CVS-11株作为攻击病毒,涉及生物安全,只能在生物安全水平3级(BSL-3)的实验室中进行。由于受实验室应用条件、成本高等条件所限难以推广。因此,找到一种简单便捷,准确高的检测方法很有必要。
ELISA是常用的检测狂犬病病毒抗体的方法之一,在20世纪70年代由CLIQUET等[8]建立。目前ELISA法基本上采用间接法,该法可通过检测RABV糖蛋白抗体,从而测定其中和抗体效价。BLANCOUJ等[9]研究表明,ELISA检测RABV糖蛋白抗体的结果与RFFIT法相比,具有较好的一致性。FEYSSAGUET等[10]研究显示,PLATELIA RABIESII检测试剂盒的敏感性达到98.4%,其特异性达到99.4%,在敏感性和特异性方面与RFFIT 方法无差异。本研究结果发现,亿特公司、万泰公司的两种ELISA与金标准RFFIT的一致率均为92.00%以上,检查结果与吕新军等[11-12]报道的ELISA检测法的结果比较接近。运用ELISA法测定的是抗狂犬病病毒糖蛋白抗体滴度与使用病毒中和试验测定的结果有一定的相关性[13-17]。
安泰公司的CG与RFFIT的一致率均为92.00%以上。然而,此种检测方法只能定性检测抗体的有或无,不能定量测定抗体效价,也不能特异性检测中和抗体。中国CDC病毒所卢学新报道的“基于量子点技术的狂犬病病毒抗体免疫层析检测方法”[18],初步建立了基于量子点技术的狂犬病抗体免疫层析方法,可对不同物种的狂犬病病毒抗体进行检测,初步完成了抗体滴度定量检测。不足之处是检测的为狂犬病总抗体,不能区分保护性抗体。需进一步扩大样本量和样本种类,验证此方法的性能。其展望进一步探究中和抗体和总抗体间的相关比例,通过检测总抗体完成对狂犬病中和抗体滴度的判定。
ELISA、CG与RFFIT相比具有实验条件要求低、操作便捷、时间快、成本低等优点,主要用于大范围狂犬病病毒抗体筛查,特别适合基层医疗卫生单位使用。CG操作简单,可以现场检测,但是易受检验人员主观影响,不易准确判断等不足之处,根据其特点可以作为一个早期筛查的手段。
综合以上分析结果,建议在人抗狂犬病病毒抗体检测过程中,首先利用CG进行初步筛选,然后利用ELISA法进一步检测。如果条件允许,最好用RFFIT法进行确诊。不同检测方法的联合应用,具有较好的社会经济价值。

