结核分枝杆菌H37Ra感染的THP-1细胞TGF-β1、Smad2、Smad3、TNF-α、IL-6 mRNA表达变化
王立楠,李艳宁,刘建,屈昱良,,郭乐,杨宗强,牛宁奎
1 宁夏医科大学总医院骨科,银川 750004;2 宁夏医科大学;3 宁夏医科大学临床医学院宁夏临床病原微生物重点实验室
结核病是由结核分枝杆菌(MTB)感染导致的一类慢性传染性疾病,据2020年全球结核病报告显示,虽然结核病发病率在逐年下降,2018-2019年期间的结核病发病率较上一年减少了2.3%,但目前它仍是世界上十大死亡疾病原因之一,中国结核病患者总人数占全球结核病患者总人数的8.4%,位居世界第三位。因此,迄今为止,结核病还是我国重点防控的传染病之一。当MTB 通过呼吸道、破损的皮肤、消化道进入患者体内后,巨噬细胞作为人体内最为重要的免疫效应细胞,具有强大的吞噬能力,是机体抵御MTB进入机体的第一道重要防线[1]。巨噬细胞吞噬MTB 后可启动凋亡、自噬等免疫相关机制清除和防御MTB,还可作为抗原提呈细胞启动T 细胞介导的细胞免疫应答和B 细胞介导的体液免疫应答[2]。在结核病中,转化生长因子-β(TGF-β)是一类在结构上相似的转化生长因子,分为TGF-β1、TGF-β2 和TGF-β3 三种亚型[3],其中75%为TGF-β1,由多种细胞产生,可发挥免疫抑制、抗炎、促进成纤维细胞和巨噬细胞聚集、组织损伤修复及骨组织的修复与重建等作用[4]。Smads 蛋白是TGF-β 家族从细胞膜受体到细胞核的胞内信号转导分子[5]。TGFβ1 对下游信号通路的调控包括依赖于Smads 蛋白的经典通路途径和不依赖于Smads蛋白的非经典通路途径,其中经典途径为主要调控通路[6]。TGF-β1主要是通过Smad2/3 来发挥其抗炎作用,Smad2/3在TGF-β1/Smads 经典信号通路中处于重要位置[7]。在结核病中,感染MTB 菌量不同引起的机体免疫反应强弱也不同,TGF-β1/Smads经典信号通路的激活程度是否与MTB感染的细菌量有关,被激活的TGFβ1/Smads 经典通路主要在MTB 感染后的哪个时间阶段发挥主要作用的研究甚少。2020年1月—2021年6月,本研究观察了MTB H37Ra 在不同感染时间和不同感染复数下感染THP-1 细胞后TGF- β1/Smads 经典信号通路中的关键基因TGF-β1、Smad2、Smad3及炎症因子肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)基因表达变化,为进一步探究TGF-β1/Smads经典信号通路在MTB感染的巨噬细胞中可能的作用机制提供理论依据。
1 材料与方法
1.1 细胞、试剂、仪器及来源 THP-1 巨噬细胞、MTB H37Ra 均由本实验室液氮罐及-80 ℃冰箱保存;RPMI 1640 培 养 基 购 自Biological Industries 公司;胎牛血清购自Gemini 公司;罗氏改良培养基购自赛诺特生物公司;TRIzol 试剂购自Invitrogen 公司;基因序列从NCBI 网站Gene Bank 网站获取,由NCBI Primer-BLAST 在线网站设计基因正反引物序列,由上海生工生物工程公司负责合成引物;逆转录试剂盒与实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂盒购自大连宝生物TaKaRa 公司;荧光定量PCR 仪购自美国ABI 公司(Applied Biosystems 7600 系统);双光束紫外可见分光光度计购自北京普析通用仪器有限公司;超声细胞粉碎机购自宁波新艺超声设备有限公司。
1.2 THP-1巨噬细胞、MTB H37Ra的培养 从液氮罐中取出THP-1 细胞,在37 ℃水浴中快速解冻细胞,在含有10% 胎牛血清(FBS)的RPMI1640 培养基、37 ℃、5% CO2细胞培养箱中培养,每48 h在显微镜下观察细胞状态和浓度,使用牛鲍计数板进行细胞计数,培养细胞浓度至1×106/mL时,接种细胞至6孔板中,每孔2 mL,然后加入终浓度为100 ng/mL佛波酯,继续培养24 h,THP-1 细胞由单个圆形细胞转变为形态不规则,具有伪足的贴壁细胞,弃去六孔板中培养基,用磷酸缓冲盐溶液(PBS)清洗2 遍,每孔加入不含抗生素的10% FBS 的RPMI1640 培养基2 mL,待用。
从低温-80 ℃冰箱中取出生长在改良罗氏培养基表面的MTB H37Ra,移至生物安全柜进行操作。在培养箱中解冻30 min,待培养基表面的菌落可被挑下时,挑取适量H37Ra 菌团,转移至高压灭菌过的玻璃组织均浆器中,加入5 mL PBS,反复研磨均匀后,用巴氏吸管转移至新的改良罗氏培养基斜面,置于37 ℃、5% CO2培养箱中培养2~3 周后,可见培养基斜面生长散落的黄色菜花状菌落,用接种环刮取长势良好的单个菌落的细菌,置于5 mL EP 管中,然后加入2 mL PBS;将EP 管置于冰上,用细胞超声破碎仪将成团的细菌处理为单个的菌,设置条件:功率5 W、工作15 s、停15 s,总时间5 min;超声结束后200 g 10 min低速离心,吸取上层菌悬液转移到新的5 mL EP 管中,使用紫外分光光度仪在OD600 波长条件下,检测H37Ra 菌悬液OD600 值,带入公式CFU=3.26×107×OD600 + 6.89×105,计算得到H37Ra菌悬液浓度[8-9],待用。
1.3 THP-1 细胞中MTB H37Ra 的加入方法 在前期处理好的THP-1 细胞中加入H37Ra 菌液(观察组),根据六孔板中每孔THP-1细胞数量和感染复数(MOI)即细菌与细胞的比例加入相对应量的H37Ra菌悬液,调整MOI 为1∶1、10∶1、100∶1(即MOI=1,10,100),继续置于37 ℃、5% CO2培养箱中培养6 h后更换新鲜的不含抗生素10% FBS 的RPMI1640 培养基2 mL,更换前用PBS 洗去未进入THP-1 细胞内的H37Ra,继续培养至24 h;在感染复数MOI=10 的条件下,置于37 ℃、5% CO2培养箱中,在共培养6 h后更换新鲜的不含抗生素的10% FBS RPMI1640 培养基2 mL,然后继续培养至12 h,24 h 后收集细胞。对照组均为未感染H37Ra的细胞。
1.4 MTB H37Ra 感染的THP-1 细胞中TGF-β1 mRNA、Smad2 mRNA、Smad3 mRNA、TNF-α mRNA、IL-6 mRNA 检测 采用qRT-PCR 法 根据共培养时间的不同,按时间弃去六孔板中培养基,用PBS清洗2~3遍,每孔加入1 mL TRIzol按照参考说明书步骤提取每孔中细胞总RNA,使用Nanodrop 2000检测提取总RNA 的浓度及纯度,确保OD260/OD280:1.8~2.4,OD260/OD230:1.5~2.4,浓度均大于50 ng/μL。总RNA 质检合格后,利用反转录试剂盒对总RNA 进行反转录获得cDNA,使用StepOnePlus Real-Time PCR System、qRT-PCR 法检测TGF-β1 mRNA、Smad2 mRNA、Smad3 mRNA、TNF- α mRNA、IL-6 mRNA。 TGF- β1 的 上 游 引物:5’GGACCAGTGGGGAAC ACTAC3’,下 游 引 物 序 列:5’AGAGTCCCTGCATCTCAGAGT3’,目标片段大小为123 bp;Smad2 的上游引物:5’GATGCCTGTTGTTTGCCCAG3’,下游引物序列:5’TCTGCCAAAGTGACAGGTCC3’,目标片段大小为138 bp;Smad3 的上游引物:5’TGCTGGTGACTGGATAGCAG3’,下游引物:5’GCTGCAAGGTGAAGATG TCA3’,目标片段大小 为105 bp;TNF- α 的 上 游 引 物:5’CACAGTGAAGTGCTG GCAAC3’,下 游 引 物:5’GATCAAAGCTGTAGGCCCCA3’,目 标 片 段 为75 bp;IL-6 的 上 游 引 物:5’GCTCCTGGTGTTGCCTGCTG3’,下游引物:5’GTTCTGAAGAGGTGAGTGGCTGTC3’,目标片段大小为101 bp;GAPDH 的上游引物:5’CAGGAGGCATTGCTGATGAT3’,下游引物:5’GAAGGCTGGGG CTCATTT3’,目标片段大小为138 bp。由上海生工生物公司合成。按20 μL 反应体系在冰盒上依次添加以下试剂:10 μL TB Green Premix Ex Taq II(Tli RNaseH Plus)(2×)、0.8 μL PCR Forward Primer(10 μmol/L)、0.8 μL PCR Reverse Primer(10 μmol/L)、0.4 μL ROX Reference Dye(50×)、6 μL无酶水及2 μL cDNA;反应条件:95 ℃30 s,95 ℃5 s、60 ℃30 s,40 个循环,95 ℃15 s、60 ℃60 s、95 ℃15 s 1 个循环。每个标本均设置3 个平行复孔,实验结果均重复3 次。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,根据2-ΔΔCT法计算目的基因的相对表达量。
1.5 统计学方法 采用SPSS23.0 统计软件。对数据进行SW 检验(Shapiro-Wilk),符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步组间比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 MTB H37Ra 不同感染复数和不同感染时间感染 的THP-1 细 胞 中TGF- β1、Smad2 mRNA、Smad 3 mRNA 表达 H37Ra 感染24 h 时,与空白对照比较,当MOI=1、10 、100 时,TGF-β1 mRNA 的相对表达量先升高后降低,在MOI=10 时表达最高(P均<0.05);Smad2 mRNA 的相 对 表 达 量降 低(P均<0.05);Smad3 mRNA 相对表达量升高(P均<0.05);TNF-α mRNA 和IL-6 MRNA 表达变化趋势基本一致,在MOI=1、10 时升高不明显(P均>0.05),MOI=100时升高(P均<0.05),见表1。
表1 不同感染时间H37Ra感染THP-1细胞后TGF-β1 mRNA、Smad2 mRNA、Smad3 mRNA表达(±s)
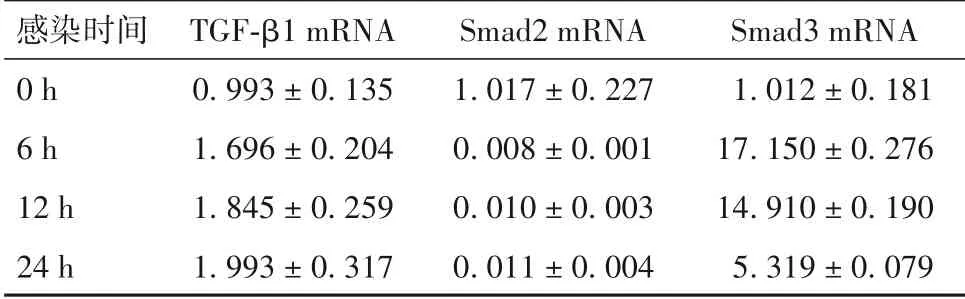
表1 不同感染时间H37Ra感染THP-1细胞后TGF-β1 mRNA、Smad2 mRNA、Smad3 mRNA表达(±s)
感染时间0 h 6 h 12 h 24 h TGF-β1 mRNA 0.993 ± 0.1351.696 ± 0.2041.845 ± 0.2591.993 ± 0.317 Smad2 mRNA 1.017 ± 0.2270.008 ± 0.0010.010 ± 0.0030.011 ± 0.004 Smad3 mRNA 1.012 ± 0.18117.150 ± 0.27614.910 ± 0.1905.319 ± 0.079
H37Ra MOI=10 时,随感染时间(T=6 h、12 h、24 h)延长,TGF-β1 mRNA 的相对表达量呈现升高趋势(P均<0.05);Smad2 mRNA 的相对表达量呈降低趋势(P均<0.05);Smad3 mRNA 相对表达量呈先升 高 后 降 低 趋 势,在T=6 h 最 高(P均<0.05);TNF-α mRNA 和IL-6 MRNA 表达变化趋势基本一致,呈先升高后降低趋势,在T=12 h 时最高(P均<0.05),详见表2。
表2 不同MOI H37Ra感染THP-1细胞后TGF-β1 mRNA、Smad2 mRNA、Smad3 mRNA表达(±s)

表2 不同MOI H37Ra感染THP-1细胞后TGF-β1 mRNA、Smad2 mRNA、Smad3 mRNA表达(±s)
MOI 01 10 100 TGF-β1 mRNA 0.993 ± 0.1351.282 ± 0.0611.876 ± 0.2531.008 ± 0.310 Smad2 mRNA 1.017 ± 0.2270.011 ± 0.0030.012 ± 0.0020.010 ± 0.002 Smad3 mRNA 1.012 ± 0.1814.872 ± 0.0284.912 ± 0.7877.594 ± 0.880
2.2 MTB H37Ra 不同MOI 和不同感染时间感染的THP-1细胞中TNF-α mRNA、IL-6 mRNA 表达 感染24 h时,观察组MOI=1时,TNF-α mRNA、IL-6 mRNA分别为5.628 ± 1.033、5.718 ± 1.335;MOI=10 时,TNF-α mRNA、IL-6 mRNA 分别为5.045 ± 0.109、5.016 ± 0.853;MOI=100 时,TNF- α mRNA、IL-6 mRNA 分 别 为39.210 ± 6.396、48.440 ±13.550。 对照组TNF-α mRNA、IL-6 mRNA 分别为1.025 ± 0.277、1.054 ± 0.413。随着MOI 的升高,观察组TNF-α mRNA 和IL-6 mRNA 表达变化趋势基本一致,在MOI=1、10时升高不明显(P>0.05),MOI=100时升高(P<0.05)。
在MOI=10 时,不同感染时间(T=6 h、12 h、24 h),观察组TNF-α mRNA 分别为13.400 ± 2.386、19.950 ± 2.925、5.066 ± 0.434,IL-6 mRNA 分别为13.760 ± 2.484、19.950 ± 1.374、4.931 ± 0.789。H37Ra MOI=10 时,随感染时间延长,TNF-α mRNA和IL-6 MRNA 表达变化趋势基本一致,呈先升高后降低趋势,在T=12 h时最高(P<0.05)。
3 讨论
MTB 是一种严格的细胞内寄生菌,当MTB 通过呼吸道、肠道、破损的皮肤等途径侵入机体后,巨噬细胞是其主要的宿主细胞,而巨噬细胞作为人体固有免疫的第一道防线,既可以通过自噬、凋亡和炎性小体等作用机制杀灭MTB,也可以作为抗原提呈细胞加工提呈抗原启动获得性免疫应答,巨噬细胞在识别分枝杆菌细胞壁成分后被诱导分泌TNF-α 和IL-6等因子调控免疫反应[10-12],TNF-α是一种促炎细胞因子,可以激活巨噬细胞,招募它们到感染部位,并调控结核肉芽肿的形成[13],导致组织坏死和空腔的形成[14]。IL-6 是一种单链糖蛋白细胞因子,能促进T 细胞和B 细胞的转运和增殖[15],从而提高机体对结核分枝杆菌的免疫作用。
MTB 在一定条件下会发生免疫逃逸,在宿主细胞内长期潜伏存活,并且把巨噬细胞作为其逃避机体免疫清除机制的一个重要屏障,避免被杀伤而滞留在巨噬细胞内,这些潜伏的MTB 会随着机体免疫力的变化随时启动开始生长,导致结核病的复燃,直接影响着结核病的发生、发展、预后及转归。在MTB 定植于身体某个部位导致结核病的发病时,结核性肉芽肿是诊断结核的主要病理特征之一[16],而巨噬细胞是结核性肉芽肿中最丰富的细胞类型,在组织中的结节、硬化及干酪样坏死中起关键作用,结核性肉芽肿中巨噬细胞极化的类型与肉芽肿的形成密切相关,巨噬细胞分化途径的不同是肉芽肿内病原菌是否播散的原因之一[17]。结核性肉芽肿的过度产生会紧紧包裹MTB,一方面防止了MTB 的播散,但也会使其逃避抗结核免疫,无法被机体免疫细胞发现和清除,MTB 长期存在于结核性肉芽肿中,处于休眠状态;当宿主免疫力降低时,MTB 也会再次开始繁殖、生长导致结核病的复发、再燃,TGF-β 是形成结核性肉芽肿的关键基因[18]。早期肉芽肿和晚期肉芽肿中的多核巨细胞、上皮样细胞均有不同程度的TGF-β1 表达[18]。
在结核免疫反应过程中,TGF-β1 可通过抑制T淋巴细胞的激活、抑制T 淋巴细胞的增殖及诱导T淋巴细胞凋亡,降低单核巨噬细胞活性,降低其吞噬结核分枝杆菌的能力,从而降低人体对结核分枝杆菌感染的抵抗力[18]。结核性肉芽肿是结核病主要的病理特征之一,巨噬细胞是结核性肉芽肿中最丰富的细胞类型,TGF-β1 是影响结核性肉芽肿形成的关键基因[19],早期肉芽肿和晚期肉芽肿中的多核巨细胞、上皮样细胞均有不同程度的TGF-β1 表达[20]。Smads 是TGF-β 家族从细胞膜受体到细胞核的重要胞内作用分子[21-22],TGF-β与胞膜表面的TGF-βRⅡ受体结合进一步使TGF-βRⅠ募集[23],使其下游的Smad2 和Smad3磷酸化并与Smad4形成异寡聚物复合物进入细胞核,与其他转录因子相互作用发挥生物学效应[24-26]。TNF-α 可由巨噬细胞内源性分泌,具有促进细胞凋亡的作用[27];IL-6 可抑制由MTB 感染引起的巨噬细胞自噬,其分泌量增加有利于MTB抑制机体先天性免疫应答[28]。
在本研究中,我们利用MTB H37Ra 在不同MOI及不同感染时间条件下感染THP-1 巨噬细胞,发现TGF- β1 mRNA 表 达 均 明 显 升 高,在MOI=10 时,TGF-β1 mRNA 的相对表达量最高,MOI=100 时,相对表达量下降,且发现已诱导贴壁的THP-1 巨噬细胞一半数量发生死亡,而MOI=10的THP-1巨噬细胞状态良好,考虑菌量过多导致细胞死亡,因此本研究在做不同时间感染模型时我们选择了MOI=10。在感染24 h 内,TGF-β1 mRNA 表达呈现出时间依懒性,在随着感染时间的延长表达水平持续升高,已有研究发现TGF-β1可降低巨噬细胞表面受体活性[29],降低其吞噬功能[30],诱导CD4+T细胞发生凋亡[31],抑制CD8+T 细胞功能[32],有利于MTB 逃避机体固有免疫和获得性细胞免疫系统的杀伤,在机体内存活和繁殖。Smad2 和Smad3 作为TGF-β1 信号通路下游细胞内的主要作用因子,当MOI >1 时,Smad 2 mRNA相对表达量显著降低,但Smad3 mRNA相对表达量升高,MOI 值越大表达量越多,且在MOI=10感染6 h 时表达量最高,之后逐渐下降,因此我们推测在H37Ra感染THP-1后,激活TGF-β信号通路,早期通过激活经典通路上调Smad3 mRNA 的表达,抑制Smad2 mRNA 的表达从而发挥免疫调控作用,晚期可能通过非经典通路抑制机体对MTB 的免疫反应。已有研究发现,在BCG 感染的THP-1 巨噬细胞中,TGF-β1 呈现高表达[33],且ROSAS-TARACO 等发现沉默小鼠肺内TGF-β1 基因可提高小鼠对MTB 的免疫能力,降低小鼠肺内MTB 数量,增加肺组织中TNF-α的表达,在感染早期可减轻肺组织的纤维化。TGF-β信号通路对细胞免疫和体液免疫均有抑制作用,通过下调TNF-α、IFN-γ、IL-1、IL-12 以及IL-6 等炎症因子的表达发挥免疫抑制作用[25]。本研究发现,TNF- α mRNA 和IL-6 mRNA 在MOI=100 感 染24 h后相对表达量均明显高于MOI=1、10,说明在一定范围内感染MTB 数量越多巨噬细胞免疫反应越强烈,分泌更多的促炎因子。在不同感染时间组中,感染12 h时TNF-α mRNA和IL-6 MRNA相对表达量最高,24 h 时明显下降,TNF-α 可促进巨噬细胞凋亡,而在12 h 后MTB 诱导的巨噬细胞早期凋亡情况已经趋于稳定,晚期凋亡和坏死的细胞在减少,MTB感染机体后12~24 h 时间段是MTB 发挥逃逸作用的关键时期;IL-6 可诱导T 细胞成熟,T 细胞为主的迟发型变态反应是机体清除MTB 的主要途径,IL-6 晚期表达下降会抑制T 细胞成熟,导致T 细胞无法杀伤结核菌或受结核菌感染的细胞,这也可能是导致MTB慢性感染的原因之一。
综上所述,相同感染时间,随着MOI 值增加,结核分枝杆菌H37Ra 感染的THP-1 巨噬细胞中TGFβ1 mRNA 表达先上调后降低,Smad2 mRNA 表达下调,Smad3 mRNA 表 达 上 调,TNF- α mRNA、IL-6 mRNA 相对表达量在MOI=100 时升高;MOI=10时,随着感染时间延长,结核分枝杆菌H37Ra 感染的THP-1 巨噬细胞中TGF-β1 mRNA 相对表达量升高,Smad2 mRNA 表达下调,Smad3 mRNA 表达先升高,6 h 后降低,TNF-α mRNA 和IL-6 mRNA 表达早期上调,12 h 后降低。说明结核分枝杆菌感染的细菌量与TGF-β1/Smads 经典信号通路的激活程度有关,结核分枝杆菌感染后的12 h 内TGF-β1/Smads经典信号通路发挥主要作用。但由于实验室生物安全条件限制,本研究使用MTB H37Ra 弱毒株感染THP-1 巨噬细胞与MTB H37Rv 强毒株存在一定差异,其次只在mRNA水平进行了研究,缺少在转录后蛋白水平的进一步验证。

