毛细支气管炎患儿血清IL-35、Th2类细胞因子水平变化及其意义
汪廉,孙明月,彭万胜
蚌埠医学院第一附属医院儿科,安徽 蚌埠 233004
毛细支气管炎是一种婴幼儿常见的呼吸系统疾病,临床上主要表现为喘息、气促及三凹征等[1],主要由呼吸道合胞病毒(RSV)感染引起。全球每年约有300 万儿童因患毛细支气管炎住院治疗,其中有6~20万儿童最终因其死亡[2]。毛细支气管炎与免疫反应密切相关,Th1/Th2 免疫失衡被认为是毛细支气管炎的主要发病机制,表现为免疫反应向Th2 型反应偏移,IL-4 等Th2 类炎症性细胞因子的水平升高[3]。
有研究表明,IL-35可促进调节性T 细胞(Tregs)的分泌,抑制Th2 类细胞因子介导的炎症反应[4]。IL-35 是由Tregs 及多种免疫调节细胞分泌的细胞因子,为p35 与EBI3 亚基结合形成的异二聚体,属于IL-12 家族[5-6]。IL-35 通过与T 细胞上的受体结合产生效应,在炎症性肠病、胶原诱导的关节炎及过敏性气道疾病等的发病过程中具有重要作用[7-9]。但目前国内关于IL-35 与毛细支气管炎关系的研究报道较少。本研究观察了毛细支气管炎患儿血清IL-35及Th2类细胞因子的水平变化,探讨了血清IL-35及Th2 类细胞因子之间的关系,并分析了二者对毛细支气管炎病情严重程度的诊断价值。
1 资料与方法
1.1 临床资料 选取蚌埠医学院第一附属医院2019年12月—2021年3月收治的诊断为毛细支气管炎的患儿68 例。纳入标准:符合《毛细支气管炎诊断、治疗与预防专家共识(2014年版)》[1]中毛细支气管炎的诊断标准。排除标准:①先天性气道发育畸形、先天性心脏病、免疫缺陷病、哮喘等;②合并细菌感染;③合并全身多系统、器官的损害;④近期使用免疫调节药物。根据《毛细支气管炎诊断、治疗与预防专家共识(2014年版)》[1],将患儿分为轻度组34例及中重度组34例,对照组选取我院儿科康复病房同期同年龄,近期无呼吸道感染临床症状,无其他系统感染史的儿童(诊断为发育指标延迟、全面性发育落后等的儿童)。由于中、重度毛细支气管炎的诊断标准较为接近,且中、重度组病例数相对轻度组少,故将其合并为一组。观察组年龄中位数为7 个月,对照组年龄中位数为11个月,两组年龄差异无统计学意义(P>0.05)。轻度组年龄中位数为6 个月,入院时的病程中位数为4 天,中重度组年龄中位数为8.5个月,入院时的病程中位数为3.5天,两组年龄、入院时的病程差异均无统计学意义(P均>0.05)。本研究经医院伦理委员会批准,患儿家属知情同意。
1.2 血清IL-35、Th2 类细胞因子的检测 患儿入院24 h 内,抽取空腹外周静脉血,静置半小时后,以3000 r/min 离心10 min,离心半径为10 cm,将血清分装在冻存管内,做好标记放入-20 ℃冰箱保存备用。采用ELISA 法检测血清中的IL-35 及Th2 类细胞因子,IL-35 试剂盒由Elabscience 公司生产,各Th2 类细胞因子试剂盒均由ABclonal 公司生产,操作严格按照说明书进行,反应终止后在ELISA 检测仪上,于450 nm 波长下,以空白对照孔调零后测各孔OD 值,用ELISA 数据分析软件计算对应样本浓度。
1.3 统计学方法 采用SPSS22.0 统计软件。计量资料采用Shapiro-Wilk 检验进行正态性检验,并进行方差齐性分析,如果数据呈正态分布,用±s表示,比较采用t检验;如果数据呈非正态分布,用M(P25,P75)表示,比较采用Mann-WhitneyU检验。计数资料比较采用χ2检验。细胞因子间相关性分析采用Spearman 相关。影响因素分析采用多元线性回归。诊断效能分析采用ROC。P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清IL-35、IL-4、IL-10、IL-13、IL-33 水平比较 观察组血清IL-35、IL-4、IL-10、IL-13、IL-33 水平 分 别 为10.55(9.00,12.11)、(7.73 ± 1.39)、(129.15 ± 17.80)、(741.00 ± 109.87)、31.21(24.92,38.38) pg/mL,对 照 组 分 别 为14.34(12.48,16.81)、(5.46 ± 1.17)、(158.58 ± 17.14)、(569.12 ±96.91)、52.92(45.18,60.45)pg/mL。与对照组比较,观察组血清IL-35、IL-10、IL-33 水平低,IL-4、IL-13水平高(P均<0.01)。
中重度组血清IL-35、IL-4、IL-10、IL-13、IL-33 水平 分 别 为(9.65 ± 1.74)、8.45(7.49,9.71)、(121.49 ± 17.26、(788.00 ± 95.80)、(29.21 ±7.75)pg/mL,轻度组分别为(11.52 ± 1.90)、6.93(6.29,7.45)、(136.80 ± 14.99)、(694.00 ± 103.81)、(34.09 ± 8.63)pg/mL。与轻度组比较,中重度组血清IL-35、IL-10、IL-33 水平低(P均<0.05),IL-4、IL-13水平高(P均<0.01)。
2.2 观察组血清IL-35与TH2类细胞因子之间及二者与病情之间的关系 血清IL-35与IL-10呈正相关(rs=0.291,P<0.05),与IL-4 呈负相关(rs=-0.251,P<0.05)。
以中重度毛细支气管炎为因变量(是=1,否=0),以IL-4、IL-10、IL-13、IL-33、IL-35为自变量(均以实际值赋值)进行回归分析。结果显示,IL-4、IL-10、IL-13、IL-33 是疾病严重程度的影响因素(P均<0.05)。见表1。
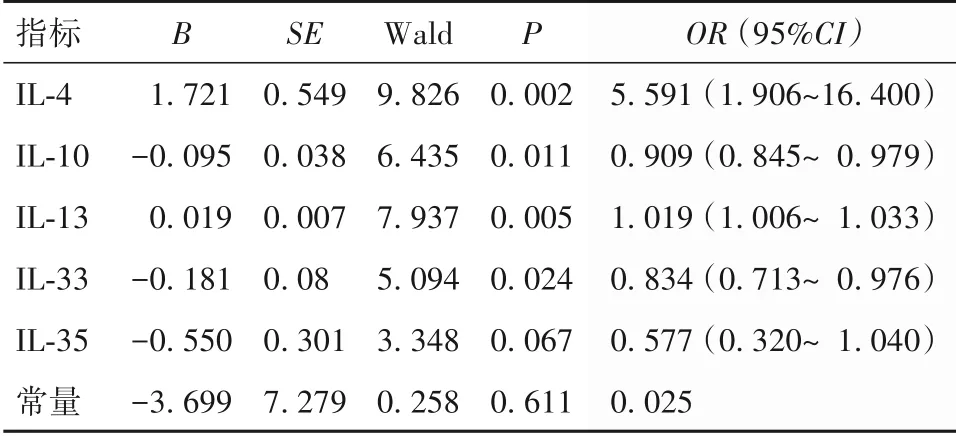
表1 观察组疾病严重程度的多元线性回归分析结果
2.3 血清IL-35、IL-4、IL-10、IL-13、IL-33 对中重度毛细支气管炎的诊断效能 IL-35 的诊断界值为10.53 pg/mL,曲线下面积(AUC)为0.760(95%CI:0.641~0.855,P<0.001),灵敏度为70.6%,特异度为70.6%;IL-4 的诊断界值为7.3 pg/mL,AUC 为0.827(95%CI:0.716~0.908,P<0.001),灵敏度为82.4%,特异度为73.5%;IL-10 的诊断界值为115.38 pg/mL,AUC 为0.712(95%CI: 0.589~0.815,P<0.001),灵 敏 度 为44.1%,特 异 度 为97.1%;IL-13 的 诊 断 界 值 为643 pg/mL,AUC 为0.739(95%CI:0.618~0.838,P<0.001),灵敏度为97.1%,特异度为41.2%;IL-33 的诊断界值为22.61 pg/mL,AUC 为0.635 (95%CI: 0.509~0.748,P<0.05),灵 敏 度 为26.5%,特 异 度 为100.0%,详见图1。
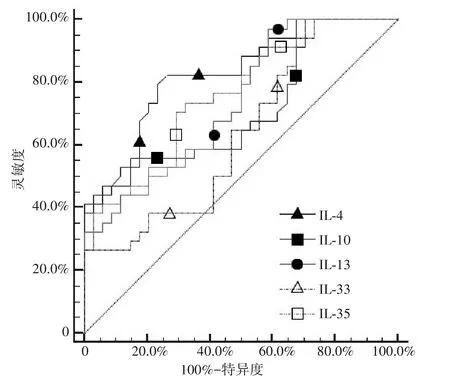
图1 血清IL-35、IL-4、IL-10、IL-13、IL-33诊断中重度毛细支气管炎的ROC
3 讨论
随着近年来毛细支气管炎发病率的上升,疾病免疫学方面的研究逐渐增多。研究认为,毛细支气管炎的发病过程与免疫反应密切相关,Th1/Th2 免疫失衡是毛细支气管炎的主要发病机制之一,主要表现为Th2 型免疫反应增强,Th1 型免疫反应减弱[3]。针对相关细胞因子的研究对诊断及治疗毛细支气管炎具有重要意义。
IL-35 主要由Tregs 细胞产生,IL-35 在T 细胞上有3 种受体,包括IL-12Rβ2同型二聚体、gp130 同型二聚体及IL-12Rβ2/gp130 异二聚体,IL-35 通过与T细胞上的受体结合,激活JAK1、JAK2、STAT1 及STAT4 信号转导通路,发挥生物学效应[6]。IL-35 可通过抑制细胞分裂G1期向S 期分化,抑制CD4+、CD8+T 细胞(Th1、Th17 等)的增殖,抑制Th1 类细胞因子及IL-17A 的分泌[10];可通过抑制GATA3 和IL-4的表达,抑制Th2 的增殖,抑制Th2 型免疫反应[11]。本研究发现,毛细支气管炎患儿血清IL-35 水平低,且中重度患儿较轻度患儿更明显,提示IL-35在毛细支气管炎中可能具有保护作用。通过研究细胞因子间相关性发现,IL-35与IL-10呈正相关,与IL-4呈正相关。ROC显示,IL-35对中重度毛细支气管炎具有较高的诊断效能,提示IL-35可用于辅助判断毛细支气管炎的严重程度。FAN 等[12]的研究发现,RSV 感染组患儿IL-35的水平较健康对照组升高。IL-35的水平变化存在争议。有证据表明,IL-10在RSV感染不同阶段中的表达有差异[13],且IL-35 与IL-10 存在相关性[12],因此,IL-35 可能存在类似的变化。廖廷彦等[14]的研究发现,RSV 感染的毛细支气管炎患儿入院后第2 天血清IL-35 的水平低于对照组,本研究的结果与其一致,说明IL-35 在RSV 感染不同阶段中的表达存在差异,可能是不同研究中IL-35水平差异产生的原因。
Th2 类细胞因子IL-4 是Th2 型免疫反应的特征性细胞因子,可抑制Th1 类细胞因子IFN-γ 的活性[3]。IL-10 由CD4+及CD8+T 细胞产生,参与RSV激活的免疫细胞产生的促炎细胞因子和趋化因子的调节。在毛细支气管炎中,IL-10缺乏可引起疾病严重程度增加,恢复延迟[13]。IL-13在哮喘的发病过程中具有重要作用,可促进IgE 的产生[15]。在呼吸道疾病中,IL-33 是哮喘等过敏性气道疾病的重要介质。IL-33 主要由组织细胞表达,包括上皮细胞、内皮细胞及成纤维细胞,在炎症感染时可由肥大细胞及树突样细胞表达[16]。IL-33 受体包括ST2 蛋白及IL-1 受体辅助蛋白,IL-33 与受体结合,通过MyD88、MAPK 及NF-κB 蛋白转导信号,参与机体的先天性免疫及适应性免疫[15-16]。当感染或组织损伤时,IL-33从坏死的细胞核释放到细胞外,促使2 型先天性淋巴细胞(ILC2s)刺激Th2类细胞因子IL-5、IL-13的分泌,免疫反应向Th2 偏移[17-18]。本研究发现,毛细支气管炎患儿血清IL-4、IL-13 水平高,IL-10、IL-33 水平低,且中重度患儿较轻度患儿更明显。多元回归分析显示IL-4、IL-10、IL-13、IL-33 均是疾病严重程度的影响因素,提示Th2 类细胞因子与疾病严重程度相关。ROC 显示,IL-4、IL-10、IL-13、IL-33 对中重度毛细支气管炎均具有较高的诊断效能,提示Th2类细胞因子可用于辅助判断毛细支气管炎的严重程度。FAN等[12]的研究发现,RSV感染组患儿IL-10的水平较健康对照组显著升高,中重度患儿血清IL-10的水平较轻度患儿显著降低。GAO 等[19]通过小鼠模型发现,RSV 感染小鼠的外周血Tregs 及IL-10 的水平低于健康小鼠。IL-10 的水平变化存在争议。SUN 等[13]的研究发现,在RSV 感染后的24 h 内,小鼠表现为细胞因子、趋化因子的表达增加,此时,IL-10 未诱导Th2 类细胞因子的产生,而在感染后的8~10 天,小鼠表现为Th2 类细胞因子的表达增加。在RSV 感染后的第6 天,IL-10 呈高表达,在第8 天,IL-10 的水平逐渐降低。因此,IL-10 在RSV 感染不同阶段中的表达差异可能是不同研究中IL-10 水平差异产生的原因。VU 等[17]研究发现,中重度RSV感染患儿的鼻咽分泌物IL-4、IL-13、IL-33 及ILC2s的水平较轻度患儿显著升高,多元回归分析显示IL-4(OR=9.67,95%CI:2.45~38.15,P=0.001)是疾病严重程度的影响因素。CHRISTIAANSEN 等[3]的研究发现,多数RSV 感染患儿Th1 及Th2 类细胞因子的水平升高,但IL-33 及Tregs 的水平降低。IL-33 的水平变化存在争议。CHRISTIAANSEN 等[3]认为,RSV感染时细胞凋亡而非坏死可能是IL-33水平变化的原因,IL-33 的降低使Tregs 募集减少,引起Tregs的水平降低,但该推论仍有待进一步证实。
综上所述,毛细支气管炎患儿血清IL-35、IL-10、IL-33 水平低,IL-4、IL-13 水平高,且中重度患儿较轻度患儿更明显。血清IL-35水平与IL-10呈正相关,与IL-4 呈负相关。Th2 类细胞因子是毛细支气管炎疾病严重程度的影响因素。IL-35 及Th2 类细胞因子可用于辅助判断毛细支气管炎的严重程度。随着对毛细支气管炎发病机制的研究,免疫治疗的重要性越发突出,针对相关细胞因子开发潜在的免疫治疗药物,对缓解毛细支气管炎的症状,缩短病程具有重要意义。本研究在设计上仍然存在一些缺陷。例如:患儿病原体的检出率较低,未能对引起毛细支气管炎的病原体进行具体划分,无法验证不同病原体对细胞因子水平的影响;患儿的年龄范围较广,未再进行准确分类,无法验证年龄对细胞因子水平的影响;针对患儿血清进行研究较呼吸道分泌物准确性差。以上均有可能对研究结果产生影响。下一步研究将筛选RSV 感染的毛细支气管炎患儿,观察疾病不同阶段血清IL-35 及Th2 类细胞因子的变化,探讨IL-35及Th2类细胞因子在疾病各阶段的作用。

