转化lSO 7439:2015含铜宫内节育器 技术要求与试验方法标准的解析
【作 者】钱心依
上海市医疗器械检验研究院,上海市,201318
0 引言
避孕药械特别是含铜宫内节育器(copperbearing intrauterine device,简称Cu-IUD),因其长效、简便、经济、可逆等特点,是育龄妇女使用最广泛的避孕方法。临床使用Cu-IUD类型繁多,规格多,涉及的标准有:GB 3156—2006《Ocu 宫内节育器》、GB 11236—2006《Tcu 宫内节育器》、GB 11235—2006《VCu 宫内节育器》、GB 11234—2006《宫腔形宫内节育器》。这系列强制性国家标准根据不同类型的宫内节育器规定了其组成、材料、型式、基本尺寸、配置、标示、要求、试验方法、检验规则、标志、包装、运输、贮存等具体要求,对规范该行业产品的生产,保证产品的质量起到了重要作用。
为有效规范所有类型的Cu-IUD的质量,有必要制定一份通用的强制性标准来保证Cu-IUD的安全性和有效性。国际化标准组织ISO/TC 157(局部避孕和性疾病预防器械标准化技术委员会)制定的ISO 7439《含铜宫内节育器 技术要求和试验方法》,以欧美注册上市的TC 380为基础,对Cu-IUD的质量提出了基本要求。基本涵盖了GB 3156—2006、GB 11236—2006、GB 11235—2006、GB 11234—2006四份国标中的基础通用内容,全国计划生育器械标准化技术委员会依据国家标准化法的精神以及强制性标准整合精简工作的要求,考虑国际采购规则,以转化ISO 7439:2015的方式来实现多标合一。在转化ISO 7439:2015时,根据我国企业的产品情况以及临床使用中积累的经验,对相应的指标进行了修改,修改的主要内容解析如下。
1 标准转化解析
《含铜宫内节育器 技术要求和试验方法》包含了含铜宫内节育器的基础通用要求。根据无源植入物的安全角度,结合IUD特点,从预期性能、设计属性、材料、设计评估、制造、灭菌、包装和制造商提供信息的要求等方面做了相应规定,并且增加了国内现行标准中没有的临床性能和临床评估要求,运用科学统计法,完善相应临床报告,便于不良反应统计分析原因等。
1.1 临床性能要求
IUD长时间植入人体,不可避免会发生危害健康的风险,其临床性能是一个重要的评估指标。ISO 7439:2015及我国国家计划生育委员会成立的宫内节育器指导委员会(1995年)讨论优选IUD的标准时都制定了临床性能中的具体数据(见表1)[1-3]。
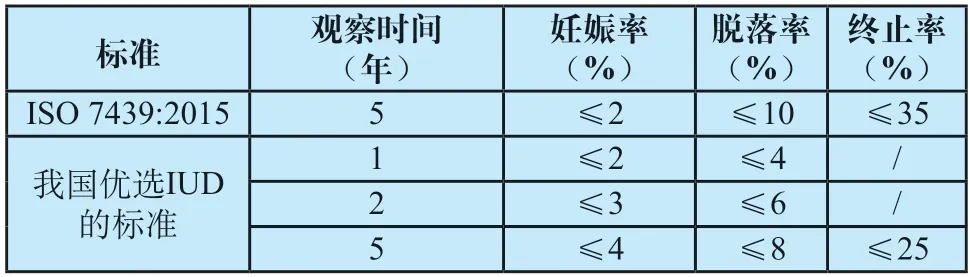
表1 IUD临床性能具体数据Tab.1 Clinical performance data of IUD
由表1可知,我国临床性能要求远远高于ISO。但我国数据较久远,目前临床要求由相关注册规章、指导原则等明确规定,纳入强制性国家标准略有不妥。新的IUD标准仅保留临床性能条款,删除具体数值要求,以指导生产商关注临床性能,后续将持续关注临床性能数据,进一步完善该条款。
1.2 铜的纯度
为了促使国际贸易更简便、更公平,ISO 7439:2015制定了基本技术指标。其规定“原材料铜的纯度达到99.9%”。而我国四份现行IUD标准中铜纯度的要求,除GB 11235要求达到99.98%外,均要求达到99.99%。
由此可见,目前我国IUD的最低铜纯度应≥99.98%,远高于ISO 7439:2015。国际卫生组织WHO采购IUD时,也要求“原材料铜的纯度需达到99.99%”。
为了符合国际采购需求,新的IUD标准保留铜纯度较高的要求。将铜表面可能存在的氧化现象,修改为“终产品上铜的纯度至少达到99.99%”。
1.3 尾丝
ISO 7439:2015是以欧美注册上市的TC 380为基础制定,该产品设计了尾丝,在使用时可方便检查其在宫腔内的位置,也可以自主取出,是一种比较人性化的设计。故ISO 7437:2015明确尾丝是必不可少的。但根据我国临床的研究数据,尾丝型IUD放置后其尾丝经宫颈管留置于宫颈之外,形成了对宫颈的长期慢性刺激,会增加慢性宫颈炎的发生率;表现为阴道分泌物增多,宫颈糜烂发生率较高[4];还有可能增加子宫内膜炎发生的风险,且随时间的延长子宫内膜炎的发生率更高[5]。在我国,开环型IUD需设置,闭环型IUD(如:O型、宫腔形等)不安装尾丝也可方便使用;且国内均由专业的医护人员用专业器具取出IUD。
因此,结合我国实际使用情况,新的IUD标准不强制要求包含尾丝,由企业自行根据产品的需求来决定,表述上改为“如需要”。
1.4 IUD的标称尺寸和放置器尺寸允差
ISO 7439:2015主要参照T Cu型,为了减少扩宫痛苦,对IUD的标称长度、标称宽度制定了具体数值。但我国实际使用期间,较多IUD还是通过扩宫的方式植入。国内的IUD种类较多,比如闭环的O型,为了更贴合子宫腔,设计时标称长度相对较短,而标称宽度相对较大。新的IUD标准并未在形状和外形尺寸上有较多的额定数据,最大限度给予制造商设计发展空间。仅要求IUD的形状应设计为适合在子宫腔内放置的形状,且外形尺寸由ISO 7439:2015中的额定数据修改为制造商自己设定。
同样,目前国内宫内节育器放置器的类型较多,比如内藏式放置器,是在放置节育器时,将横臂收缩后,节育器完全放入放置器外管内,这样节育器与妇女阴道不接触,更安全、方便。考虑到放置器外管尺寸超过了5mm,形状也不完全是圆形,也有椭圆形的。因此为了适应放置技术的发展,新的IUD标准将放置器尺寸允差由“±5%”修改为“±10%”。
1.5 抗拉力测试方法
ISO 7439:2015中的抗拉力测试方法主要适用于T Cu型IUD,对非T型的IUD不适用。而抗拉力测试是对评判其牢固度、预期性能及安全性能的重要指标,不可缺少。根据多种类型IUD设计属性的要求,新的IUD标准补充了非T型IUD的抗拉力测试方法。
1.6 稳定性
ISO 7439:2015中的保质期稳定性无法在体内进行测试,实际只能进行体外评估;而原条款测试方法与5.4中的抗拉力一致,具有重复性;在我国,稳定性研究通常不作为产品技术要求制定,在注册时以研究资料形式提供,避免了该强制性标准发布后企业不得不将稳定性研究列入产品技术要求。综合考虑,新的IUD标准将稳定性条款予以删除。
1.7 临床评价
ISO 7439:2015仅考虑风险分析和生物学评价原则进行评估。但目前根据GB/T 16886.1—2011 《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》中明确宫内节育器产品需考虑的生物相容性评价项目包括:细胞毒性、致敏、阴道刺激、材料介导的热原、急性全身毒性、亚慢性毒性、遗传毒性、植入后局部组织反应、生殖毒性。放置器需考虑的生物相容性评价项目包括:细胞毒性、阴道刺激、致敏等[6]。
而在临床评价条款中,ISO 7439:2015的参照的金属铜材料为Cu380,该材料对于中国人群并发症很高,并不适合作为对照材料。国内往往使用Cu220来作为替代材料。原文中引用的ISO 14155—1等同转化的YY/T 0297《医疗器械临床调查》并非注册审评的参考标准,且临床评价要求5年的数据,对于医疗器械上市前临床研究,随访时间太久。
综合以上,新的IUD标准增加了所需的生物相容性,对临床评价条款只保留一些总体原则,而临床评估的具体例数按我国相关的规定执行。将修改后或新设计的宫内节育器投放到市场之前,应进行特定方案的临床评估,临床评价报告应按YY/T 0297编写。
2 总结与思考
为了符合国际采购原则,且满足IUD的基础通用要求,通过转化的方式制定了强制性国家标准《含铜宫内节育器 技术要求与试验方法》,它包含IUD的预期性能、设计属性、制造、灭菌、包装和制造商提供的信息等方面,与ISO 7439:2015相比,保留IUD的型式、临床前评估、临床评价的总体原则,增加不含尾丝IUD的部分技术要求;修改了部分仅适用于T Cu的IUD的要求,后续制造商应根据自身产品的特点,对各项安全性综合性指标进行细化规定。
在标准转化过程中,TC169结合最新的临床研究证据等,以及各国对安全、性能等指标的管控要求,对ISO 7439:2015中应加以完善的内容已于2020年国际标准的复审期间提出了修改的建议。作为IUD的使用和输出大国,TC169将积极参与该ISO标准的修订工作,进一步完善相关技术条款,使我国产品能更好出口国际。
对于各种不同型号IUD及其特点,TC169将根据行业的发展需求,以推荐性行业标准的方式逐步细化并形成系列标准。2021年《含铜宫内节育器 固定式》标准已立项,后续还将制定T型、宫腔形、V型、O型等标准,为制造商提供更详细的产品指导。同时为IUD产品的检验和监管提供技术支撑。

