circ_0044516靶向miR-1281促进食管癌细胞增殖、抑制细胞凋亡①
徐 灵 艾明华 张 庆 彭小春 (长江大学医学部,荆州434000)
食管癌是消化道最常见的恶性肿瘤之一,也是癌症相关死亡的第六大原因。中国是世界食管癌高发地区之一[1]。根治性疗法,包括外科手术、化学疗法、放射疗法或组合疗法,对于改善食管癌患者生存结果非常重要,但食管癌具有高度恶性,晚期食管癌的五年生存率低于25%[2]。现阶段,食管癌进展的确切诊断、预后预测和潜在机制仍有待进一步阐明。许多研究表明,环状RNA(circular RNA,circRNA)在细胞生物事件的调节中发挥至关重要的作用,包括增殖、凋亡和转移[3-4]。在食管癌等多种人类癌症中,circRNA 通过竞争性内源RNA(com‑petitive endogenous RNA,ceRNA)机 制 发 挥 微 小RNA(microRNA,miRNA/miR)海绵的作用,从而削弱miRNA对其靶基因的抑制作用[5-6]。circ_0044516是一种在前列腺癌和胃癌中显著上调的circRNA,在前列腺癌和胃癌中作为致癌基因发挥作用[7-8]。除此之外,鲜见关于circ_0044516 的其他报道。miR-1281 被发现是急性髓系白血病细胞中circ_0000370 的潜在靶点之一,此外miR-1281 在胃癌组织中表达下调,上调其表达可抑制胃癌细胞的增殖和迁移[9-10]。但食管癌中miR-1281 与circ_0044516的关系仍不清楚。因此,本研究考察circ_0044516在食管癌组织中的表达情况,对circ_0044516 在食管癌Eca109 细胞增殖和凋亡中扮演的角色进行评价,并结合其与miR-1281 的关系探索circ_0044516的作用机制,为开发食管癌新型治疗靶标和生物标志物提供新视角。
1 资料与方法
1.1 资料
1.1.1 临床资料 新鲜的食管癌组织和相应的癌旁组织来自长江大学附属第一医院的39 例接受根治性切除术的患者(其中男24 例,女15 例,年龄50~75 岁,Ⅰ~Ⅱ期20 例,Ⅲ~Ⅳ期19 例)。所有患者术前均未接受过放疗或化疗。术后将所有食管癌和癌旁组织标本立即保存在液氮中。本研究经长江大学附属第一医院伦理委员会批准,所有患者在研究前均签署了知情同意书。
1.1.2 细胞与试剂 食管癌细胞株Eca109(中国科学院上海细胞库);si-NC、si-circ_0044516模拟物、miR-NC、miR-1281 模拟物、anti-miR-NC、miR-1281抑制物anti-miR-1281(上海GenePharma);细胞计数试剂盒-8(cell count kit-8,CCK-8,日本Dojindo);荧光素酶基因pGL3(上海Invitrogen);Dual-Luciferase Reporter Assay Kit(美国Promega);SYBR Green(美国Applied Biosystems);miRNA RT 试剂盒、miRNA qPCR 试剂盒(上海TIANGEN);活化的半胱氨酸蛋白酶(cleaved-cysteinyl aspartate specific proteinase,cleaved-caspase)3 兔单克隆抗体、cleaved-caspase9兔单克隆抗体、GAPDH 兔单克隆抗体(美国Ab‑cam);circ_0044516引物(上海Sangon Biotech)。
1.2 方法
1.2.1 细胞培养与分组 将含有100 U/ml 链霉素/青霉素和10%胎牛血清的RPMI1640 培养基置于37 ℃饱和湿度下的恒温培养箱中,该恒温箱含有5%CO2,在此条件下培养食管癌Eca109 细胞。转染前1 d,将接种于6孔板的食管癌Eca109细胞与不含抗生素的培养基一起培养过夜。当细胞覆盖培养板的60%~70%时,进行瞬时转染。si-NC组、si-circ_0044516组、miR-NC组、miR-1281组、si-circ_0044516+anti-miR-NC 组 和si-circ_0044516+anti-miR-1281 组按照转染试剂Lipo2000 说明操作,使用si-NC、sicirc_0044516、miR-NC、miR-1281模拟物、anti-miR-NC、anti-miR-1281 与Lipo2000 混合,转染细胞。4~6 h后,将混合物移出并用完全培养基替代,48 h后进行后续实验。
1.2.2 实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)测定circ_0044516和miR-1281表达 食管癌组织、癌旁组织和食管癌Eca109 细胞总RNA 使用Trizol 试剂提取,在对RNA样品进行浓缩和纯度测定后,将其进行反转录以合成cDNA 样品,以U6 和GAPDH 为内参。SYBR Green预混液在实时PCR扩增仪上进行PCR扩增。将miRNA RT试剂盒用于miRNA的PCR反应,将miRNA逆转录成cDNA后,按照miRNA qPCR试剂盒中的说明进行PCR反应。2-ΔΔCt法对circRNA和miRNA作定量分析。除circ_0044516以外的其他引物序列如下:miR-1281 F:5'-ACACTCCAGCTGGGTCGCCTCCTCC-3',miR-1281 R:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGGGAGAGG-3'[10];U6 F:5'-CTCGCTTCGGCAGCAGCACATATA-3',U6 R:5'-AAATATGGAACGCTTCACGA-3';GAPDH F:5'-GAAGAGAGAGACCCTCACGCTG-3',GAPDH R:5'-ACTGTGAGGAGGGGA‑GATTCAGT-3'。
1.2.3 CCK-8 法检测细胞增殖能力 将细胞以1×104个/孔 接 种 到96 孔 板 中,转 染 后,食 管 癌Eca109 细胞培养48 h,并向每个孔中添加10 μl CCK-8 溶液。在37 ℃下孵育90 min,使用全自动酶标仪在450 nm 处检测吸光度OD 值。OD 值与细胞增殖能力呈正比。
1.2.4 克隆形成实验测定克隆形成 转染48 h后,收集食管癌Eca109 细胞,将200 个细胞接种于6 孔板中,并在完全培养基中培养2 周。将克隆细胞用PBS 洗涤2 次,在2 ml 甲醇中固定20 min。吸出甲醇后,食管癌Eca109 细胞用0.1%结晶紫染色溶液染色20 min,用PBS 洗涤3 次,在光学显微镜下计数。
1.2.5 Western blot 测 定cleaved-caspase3 蛋 白 和cleaved-caspase9 蛋白表达 食管癌Eca109 细胞的蛋白在RIPA 裂解液中抽提。制备适当浓度的SDSPAGE 凝胶,每个泳道含50~80 μg蛋白。电泳后,采用湿转移法在冰上将蛋白转移到PVDF 膜上。转移膜后用Tris-HCl-Tween20缓冲盐溶液制备的5%脱脂奶粉封闭PVDF 膜1 h;加入1:1 000 稀释的一抗(分别为抗cleaved-caspase3、cleaved-caspase9和GAPDH的抗体),4 ℃过夜,洗涤后加入1:8 000 稀释的二抗,室温下孵育1 h。化学发光显影涂布,使用曝光装置获得蛋白条带,通过Image J 软件评估cleavedcaspase3、cleaved-caspase9表达。
1.2.6 流式细胞术测定细胞凋亡 测定细胞凋亡时,将食管癌Eca109 细胞(1×105个)与5 μl Annexin V-FITC 和5 μl 碘化丙啶(propidium iodide,PI)染色溶液在黑暗中孵育10~20 min,然后采用FACScan流式细胞仪检测,在FlowJo 软件中分析凋亡细胞占比。
1.2.7 荧光素酶报告实验分析circ_0044516 与miR-1281 的靶向结合 使用Circular RNA Interac‑tome 靶标预测软件预测circ_0044516 与miR-1281的相互作用。为了进行荧光素酶报告基因分析,扩增含miR-1281 结合位点的circ_0044516 野生型(WT)、突变型(MUT)片段,并将其克隆到荧光素酶基因pGL3,构建WT-circ_0044516、MUT-circ_0044516载体。使用Lipofectamine 2000 将150 ng 野生型载体或突变型载体与2 ng miR-1281 模拟物或miR-NC共转染食管癌Eca109 细胞。48 h 后,使用标准化为海肾荧光素酶活性的Dual-Luciferase Reporter Assay Kit检测荧光素酶活性。
1.3 统计学分析 应用SPSS22.0软件进行统计学分析,结果表示为±s。两组间差异通过t检验比较,不同组间差异通过单因素方差分析比较,组间两两差异通过SNK-q检测比较,P<0.05 为差异有统计学意义。
2 结果
2.1 circ_0044516 和miR-1281 在食管癌组织中异常表达 39例食管癌组织中circ_0044516表达量较相匹配的癌旁组织显著增加,miR-1281 表达量较癌旁组织显著降低(P<0.05),见图1。
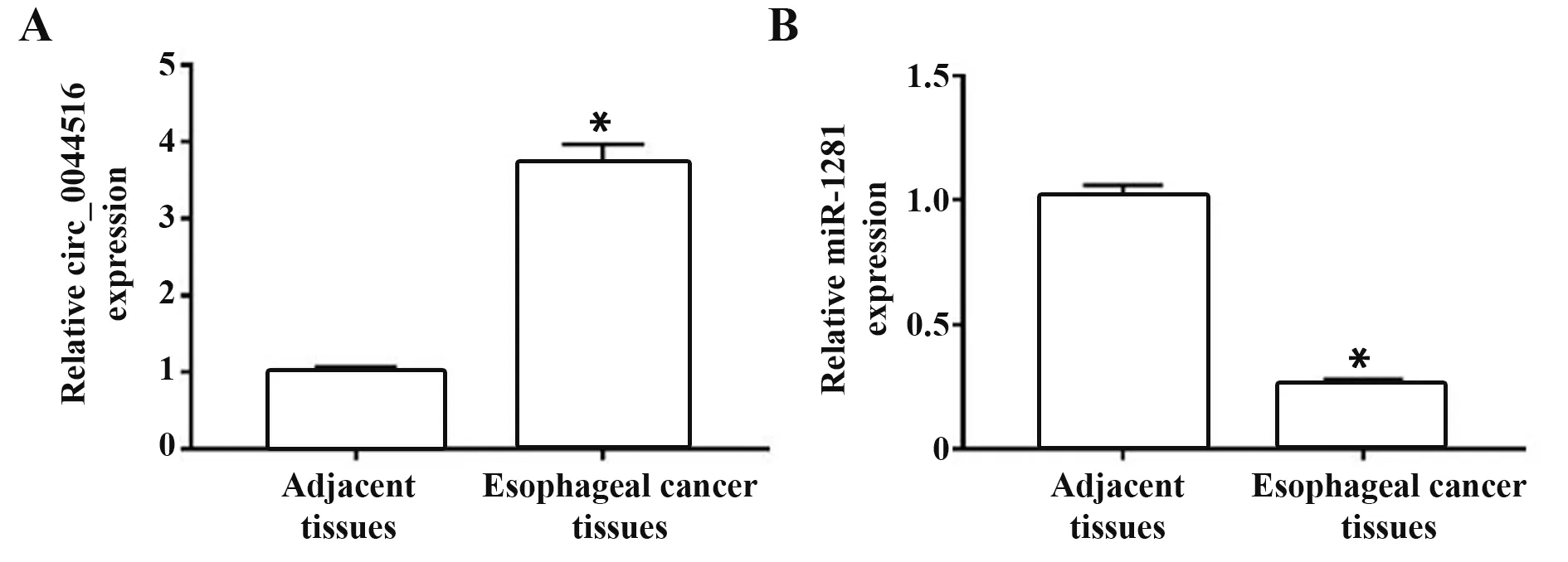
图1 circ_0044516 和miR-1281 在食管癌组织及癌旁组织中的表达Fig.1 Expressions of circ_0044516 and miR-1281 in esophageal cancer tissues and adjacent tissues
2.2 干扰circ_0044516 表达抑制食管癌Eca109 细胞增殖 在食管癌Eca109 细胞中转染si-circ_0044516 干扰circ_0044516 表达,si-circ_0044516 组Eca109 细胞中circ_0044516 表达量较si-NC 组显著降低,细胞增殖能力和平板克隆形成数也较si-NC组减少(P<0.05),见图2。
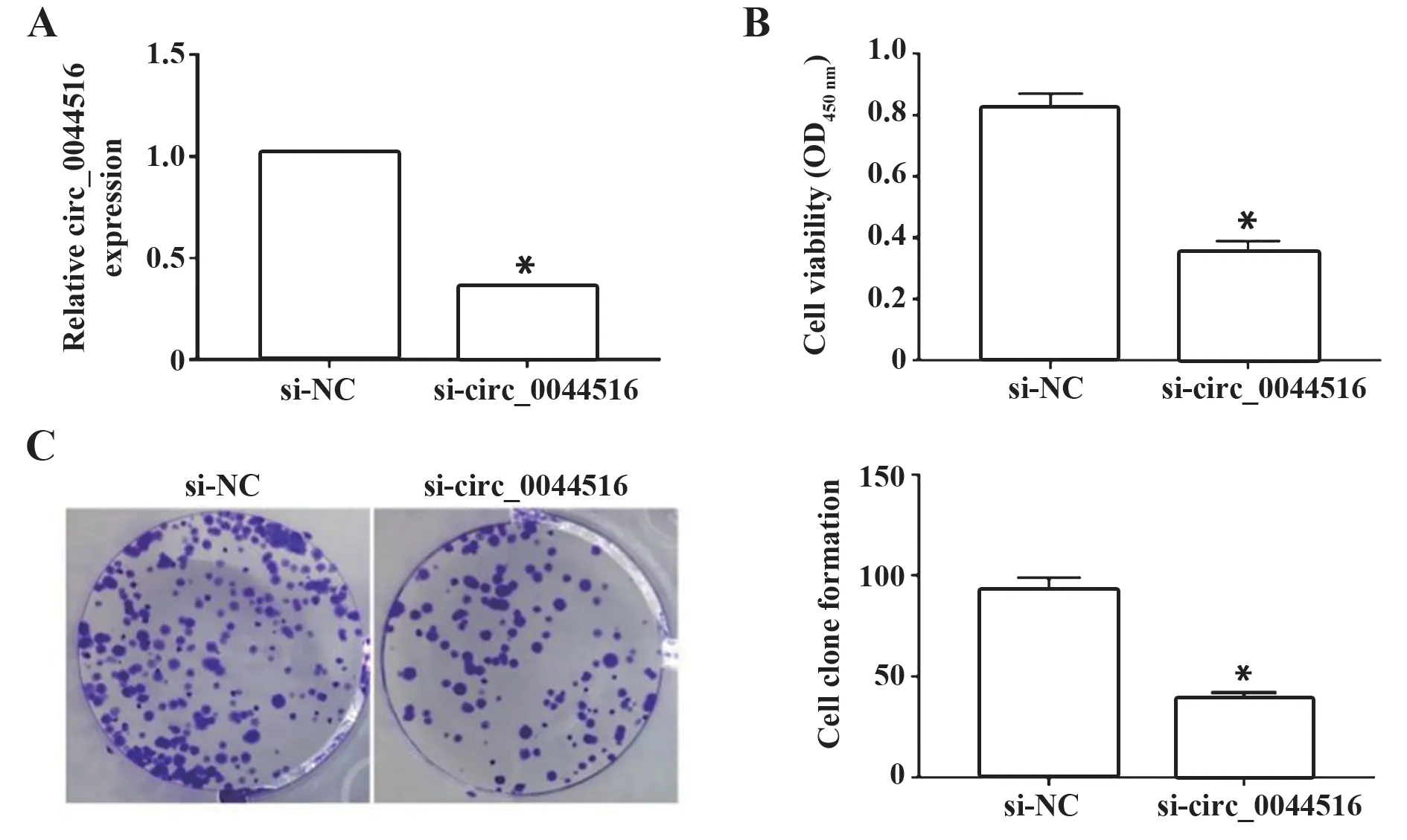
图2 干扰circ_0044516表达抑制食管癌Eca109细胞增殖Fig.2 Interference with expression of circ_0044516 inhibits proliferation of esophageal cancer Eca109 cells
2.3 干扰circ_0044516 表达促进食管癌Eca109 细胞凋亡 si-circ_0044516组食管癌Eca109细胞中凋亡率比si-NC 组升高了约3.09 倍(P<0.05,图3A),且cleaved-caspase3 蛋白和cleaved-caspase9 蛋白表达量均高于si-NC组(图3B)。
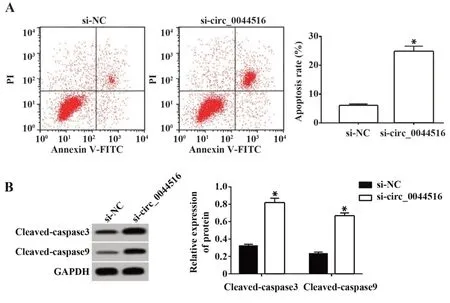
图3 干扰circ_0044516 表达对食管癌Eca109 细胞凋亡的影响Fig.3 Effect of interference with expression of circ_0044516 on apoptosis of esophageal cancer Eca109 cells
2.4 circ_0044516 靶向调控miR-1281 的表达 cir‑cular RNA Interactome 软件对circ_0044516 与miR-1281 的靶向结合位点进行预测,结果如图4A 所示。WT-circ_0044516 荧光素酶活性在miR-1281 组中较miR-NC组显著降低(P<0.05),而MUT-circ_0044516 荧光素酶活性在miR-1281 组、miR-NC 组中差异无统计学意义(P>0.05),见图4B。pcDNAcirc_0044516 组食管癌Eca109 细胞中miR-1281 表达量(0.26±0.02)低于pcDNA 空载体组(1.00±0.00),si-circ_0044516 组食管癌Eca109 细胞中miR-1281 表达量(3.27±0.29)高于si-NC 组(1.02±0.07,P<0.05),见图4C。
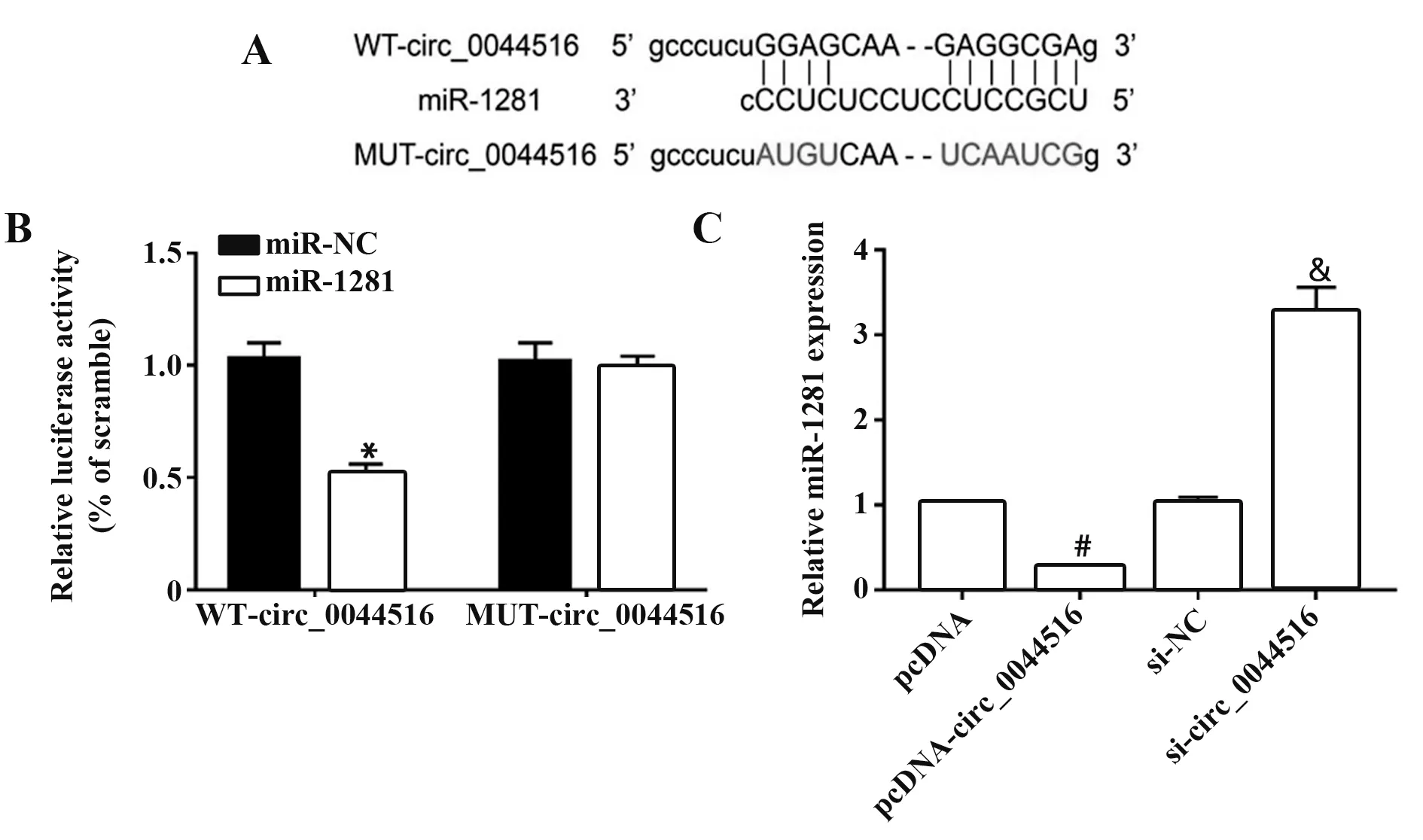
图4 circ_0044516靶向调控miR-1281的表达Fig.4 circ_0044516 targets and regulates expression of miR-1281
2.5 miR-1281 过表达抑制食管癌Eca109 细胞增殖、促进细胞凋亡 在食管癌Eca109 细胞中转染miR-1281模拟物使miR-1281过表达,miR-1281 组miR-1281 表达量较miR-NC 组增加1.91 倍左右(图5A),细胞增殖能力和克隆形成数较miR-NC 组减少(图5B、C),而cleaved-caspase3、cleaved-caspase9蛋白表达量和凋亡率较miR-NC 组升高(P<0.05,图5D、E)。
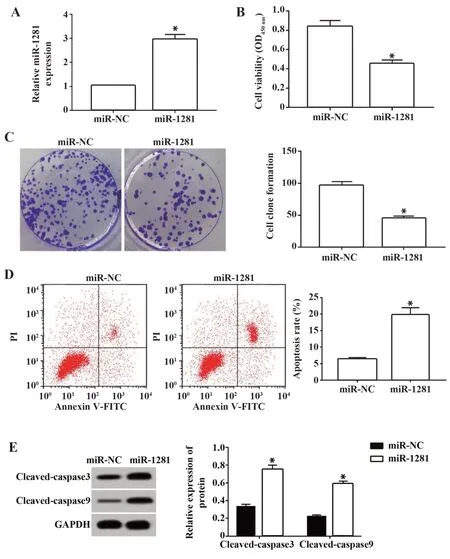
图5 miR-1281 过表达抑制食管癌Eca109 细胞增殖、促进细胞凋亡Fig.5 Overexpression of miR-1281 inhibits proliferation of esophageal cancer Eca109 cells and promotes cell apoptosis
2.6 下调miR-1281 表达逆转干扰circ_0044516 表达对食管癌Eca109 细胞增殖和凋亡的作用 在食管癌Eca109 细胞中同时转染si-circ_0044516 和an‑ti-miR-1281,si-circ_0044516+anti-miR-1281 组miR-1281表达量、凋亡率、cleaved-caspase3、cleavedcaspase9 蛋白表达量均低于si-circ_0044516+antimiR-NC 组(图6A、D、E),细胞增殖能力和克隆形成数 高 于si-circ_0044516+anti-miR-NC 组(P<0.05,图6B、C)。
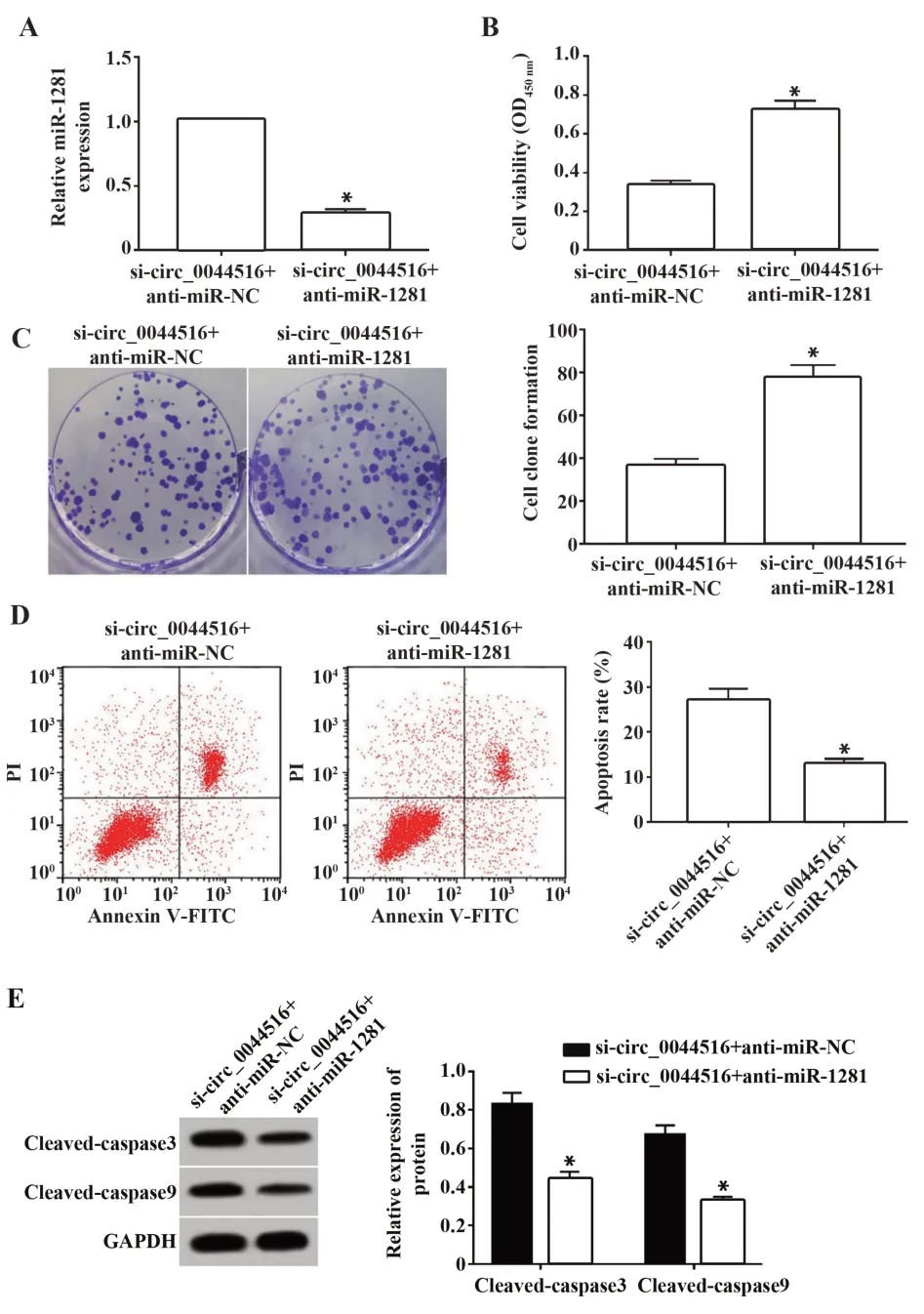
图6 下调miR-1281 表达逆转干扰circ_0044516 表达对食管癌Eca109细胞增殖和凋亡的作用Fig.6 Down-regulation of miR-1281 expression reversed effect of interference with circ_0044516 expression on proliferation and apoptosis of esophageal cancer Eca109 cells
3 讨论
circRNA 在食管癌在内的癌症中发挥多种生理上和病理上的作用[10-11]。研究表明,circ_0044516在前列腺癌患者外泌体和前列腺癌细胞中表达上调,下调circ_0044516可通过调节前列腺癌细胞中miR-29a-3p 的表达来抑制前列腺癌细胞的存活和转移[7]。circ_0044516在胃癌细胞中表达上调,细胞质中circ_0044516 可能作为miR-149-5p 海绵来调节HuR 的表达,促进胃癌细胞的增殖、迁移和侵袭,并促进胃癌异种移植小鼠体内肿瘤生长[8]。以上研究表明circ_0044516 在前列腺癌和胃癌中具有致癌作用,但其在食管癌中发挥的功能与机制目前尚未可知。本研究通过qRT-PCR 发现与癌旁组织相比,39 例食管癌组织中的circ_0044516 表达上调,提示circ_0044516 可能在食管癌发生发展中发挥作用。本研究在食管癌Eca109 细胞中干扰circ_0044516表达,功能实验证实干扰前列腺癌细胞中circ_0044516 的表达会降低前列腺癌细胞的增殖、提高细胞凋亡,表明circ_0044516 是食管癌进程中一个潜在的癌基因。
研究报道miR-1281 在胶质瘤组织中低表达,miR-1281 模拟物能减弱胶质瘤细胞的增殖、迁移和侵袭[12]。miR-1281 在乳腺癌组织中低表达,干扰其表达可促进乳腺癌细胞的增殖和克隆形成[13]。但miR-1281 是否能调节食管癌尚不清楚。本研究发现miR-1281在食管癌组织中低表达。本研究表明,miR-1281的过表达抑制食管癌Eca109细胞的增殖,并诱导其凋亡。本研究首次揭示了miR-1281 对食管癌细胞增殖、凋亡的影响,miR-1281 在食管癌中发挥抗癌作用,与既往研究相似[13-14]。
据报道,circRNA 可作为miRNA 海绵参与基因的转录后调控[14-15]。例如,hsa_circ_RNA0023397 与miR-160b 结合抑制食管癌细胞增殖并促进其凋亡[16]。hsa_circRNA6448-14作为miR-455-3p的竞争结合海绵促进食管鳞状细胞癌的发生[17]。本研究使用生物信息学分析发现miR-1281为circ_0044516的潜在靶标,结合双荧光素酶报告基因分析以及qRT-PCR 分析结果进一步证实了这一发现。在食管癌Eca109 细胞中下调miR-1281 表达则逆转干扰circ_0044516 介导的Eca109 细胞增殖和凋亡的作用。综上,干扰circ_0044516 可促进miR-1281 的表达,从而抑制食管癌发生发展,表明circ_0044516靶向miR-1281调节食管癌细胞的生物功能。
总之,本研究发现circ_0044516 在食管癌组织中表达上调,干扰circ_0044516 通过靶向miR-1281促进食管癌Eca109 细胞凋亡和抑制增殖。本研究结果表明,circ_0044516/miR-1281 调控网络在食管癌中可能是有前途的治疗靶点。