探讨地西他滨短时刺激对RAK细胞免疫表型及抗癌活性的影响①
李洁羽 周智锋 林万松 陈淑萍 叶韵斌 (福建医科大学附属肿瘤医院,福建省肿瘤医院肿瘤免疫学研究室,福建省肿瘤转化医学重点实验室,福州350014)
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,由于HCC 患者免疫功能低下,术后复发率高,对放化疗不敏感,导致总体治疗效果不理想[1]。近年来,越来越多的证据表明,过继免疫治疗(adoptive immunotherapy,ACI)可有效降低肿瘤的复发和转移,且不良反应低,相对安全,逐渐成为治疗肿瘤的新型辅助或替代疗法[2-3]。重组人纤维连接蛋白(RetroNectin,RN)主要来源于大肠杆菌中表达RN 的基因片段,是扩增的人纤维连接蛋白的一种嵌合体,广泛应用于基因转染领域[4-5]。相关基础研究证实,RN 能抵抗细胞高度活化诱发的细胞凋亡,使细胞保持高分裂状态从而促进增殖,因此RN 与抗CD3 单抗相结合可高效地刺激细胞的附着、伸展、分化和增殖,从而获得增殖率和活力更高的免疫活性细胞,即RAK细胞,其是临床上细胞免疫治疗常用的广谱而有效的免疫效应细胞。
地西他滨(5-氮杂-2'-脱氧胞嘧啶核苷,Decitabine,DAC)是一种胞嘧啶类似物,能够竞争性地抑制DNA 甲基转移酶活性,使DNA 去甲基化,再次激活表观遗传沉默基因,诱导细胞分化[6-7]。既往研究证实,体外诱导的NK 细胞经DAC 刺激后,杀伤作用和因子分泌功能增强[8]。DAC 处理的嵌合抗原受体T(dCAR-T)细胞的增殖、抗肿瘤活性和细胞因子产生均得到增强[9]。本研究将探讨不同浓度的DAC短时刺激对RAK 细胞增殖、免疫表型及抗肝癌效应的影响。体外药物的加入可能是诱导培养具有更佳抗肿瘤特性的效应细胞的一种策略,为过继细胞免疫治疗肿瘤提供新思路。
1 材料与方法
1.1 材料 肝癌细胞株HepG2 为本实验室保存。KBM-581培养基购自美国Corning公司;细胞培养基DMEM 购 自 美 国Hyclone 公 司;CD3 单 克 隆 抗 体(CD3McAb)、重组人白细胞介素2(recombinant hu‑man interleukin-2,rhIL-2)购自PeproTech 公司;Ficoll-Paque 分离液购自GE 公司;鼠抗人淋巴细胞亚群试剂盒MultitestTMKit、Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒、CD3-PerCP/CD8-APC/CD45RA-FITC/CD62L-PE Kit、IFN-γ-PE、颗粒酶-B(Granzyme B,GrB)-PE、穿孔素(perforin)-FITC、CD107a-PE、Intra‑SureTM试剂盒、GolgiStopTM蛋白质转运抑制剂购自BD公司;二辛5,6-羧基荧光素二乙酸琥珀酰亚胺酯(5,6-carboxyfluorescein diacetate succinimidyl ester,
CFSE)细胞增殖检测试剂盒购自Invitrogen 公司;佛波酯(phorbol 12-myristate 13-acetate,PMA)、离子霉素购自Sigma-Aldrich 公司;TC-20 自动细胞计数仪、凝胶成像系统购自Bio-Rad公司;FACS CantoⅡ流式细胞仪购自BD 公司;Leica AF 活细胞工作站购自德国徕卡公司。
1.2 方法
1.2.1 RAK 细胞培养 RN(12.5 μg/ml)和抗CD3 McAb(5 μg/ml)提前24 h 包被6 孔板,4 ℃冰箱放置过夜,使用前用培养基冲洗1 次。抽取3 例健康供者(已签署知情同意书)外周血30 ml,淋巴细胞分离液分离外周血单个核细胞(peripheral blood mononu‑clear cell,PBMC),生理盐水洗涤。以含0.5%自体血浆的KBM-581培养基调整细胞浓度为1×106个/ml,接种于6 孔板,加入IL-2(500 U/ml),37 ℃、5%CO2培养。后续培养根据情况每3 d 添加IL-2 及新鲜培养液。显微镜观察细胞活力(活细胞应>80%),镜下动态观察RAK细胞增殖情况。
1.2.2 RAK 细胞分组及增殖实验 RN 结合CD3McAb 包被6 孔板,将RAK 细胞分为6组接种于6孔板,3孔/组。初始细胞数3×106个/孔,其中以不加药物的RAK 细胞为对照组,其他组为不同浓度的DAC(50、500、1 000、2 000、3 000 nmol/L)刺激组,药物作用RAK 细胞24 h 后,全量更换新培养液,并加入IL-2 继续培养,分别于4 d、7 d、10 d 和12 d 进行细胞计数,观察不同浓度DAC 对细胞增殖的影响。CFSE是标记活细胞的荧光染料,在细胞分裂增殖过程中,染料可平均分配到子代细胞中,以CFSE 为细胞增殖示踪物,调节RAK 细胞密度为1×106个/ml,每毫升细胞中加入2 μl CFSE 储存液,终浓度为10 μmol/L,37 ℃孵育10 min,加入5倍体积的冷培养基终止染色,冰上孵育5 min,300 g 离心5 min,沉淀细胞用新鲜培养基洗涤3 次后加IL-2 常规培养。分别于培养第3、4、5 天收集细胞,流式细胞仪488 nmol/L激发光检测CFSE细胞增殖。
1.2.3 流式细胞术细胞免疫表型分析 收集第4、7、10、12天的RAK细胞,调整各浓度组细胞数为5×105~10×105个,采用Multitest CD3-FITC/CD8-PE/CD45-Per‑CP/CD4-APC、CD3-FITC/CD16+CD56-PE/CD45-PerCP/CD19-APC、CD3-PerCP/CD8-APC/CD45RA-FITC/CD62LPE Kit(记忆表型)流式荧光抗体标记细胞,4 ℃孵育30 min 后上机检测RAK 细胞经不同浓度DAC 刺激后的T细胞亚群(CD4+、CD8+)、NKT细胞(CD3+CD56+CD16+)比例。采用BD FACS CantoⅡ流式细胞仪的FACS DivaTM软件进行检测,FlowJo7.6.1 软件分析数据。
1.2.4 Annexin Ⅴ/PI检测DAC 对RAK 细胞凋亡的影响 不同浓度的DAC(0、50、500、1 000、2 000、3 000 nmol/L)刺激RAK细胞24 h后,分别于4 d、7 d、10 d、12 d 收集细胞,按照凋亡检测试剂盒说明书加入Binding buffer 与FITC 标记的Annexin-Ⅴ室温避光30 min,再加入PI避光孵育5 min,1 h内于流式细胞仪检测凋亡水平。
1.2.5 不同浓度DAC刺激对RAK细胞效应功能的影响 培养第10天,收集各组不同浓度DAC刺激的RAK 细胞,调整浓度为2.0×105个/ml 置于96 孔板,加入50 ng/ml PMA、1 μg/ml 离子霉素刺激,培养基中含有蛋白质转运抑制剂GolgiStopTM,于37 ℃、含5%CO2的培养箱中共同孵育5 h 后收获细胞,采用CD3-PerCP/CD8-APC 抗体进行细胞表面染色。加入BD IntraSureTM试剂盒中Fix&Perm 破膜剂A 和破膜剂B 各100 μl,4 ℃下进行胞内染色,分别加入IFN-γ-PE、perforin-FITC、GrB-PE 各5 μl,避光孵育30 min,最终以PBS 洗涤后重悬,同时设置同型对照管。RAK 细胞表面溶酶体相关膜蛋白1(lysosome associated membrane protein 1,LAMP1,又名CD107a)表达的分析:收集培养第10 天的各组DAC 刺激的RAK细胞,按RAK细胞:HepG2靶细胞=10:1(1×106:1×105)在U 型底的96 孔板中充分混匀,然后向细胞混合物中加入5 μl CD107a-PE 抗体,2 h后加入蛋白转运抑制剂GolgistopTM(终浓度:10 μg/ml)温和混匀后,置于37 ℃、5%CO2培养箱中继续孵育,4 h 后收集细胞,按上述方法进行表面染色,流式检测。
1.3 统计学处理 所有数据均采用xˉ±s表示,组间比较采用t检验,应用GraphPad Prism 5.0 统计软件分析实验结果,P<0.05为差异有统计学意义。
2 结果
2.1 DAC 刺激的RAK 细胞的形态学观察 6 种不同剂量DAC 刺激的RAK 细胞培养至第10 天时,显微镜下细胞大部分呈圆形,团簇状生长,随着DAC浓度增大,细胞团逐渐减少(图1、图2)。
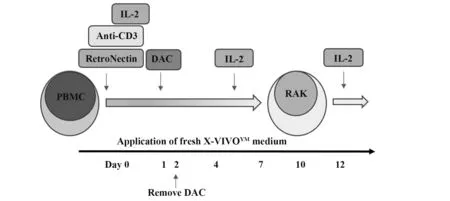
图1 RAK细胞培养的实验流程图Fig.1 Flow chart of RAK cell culture
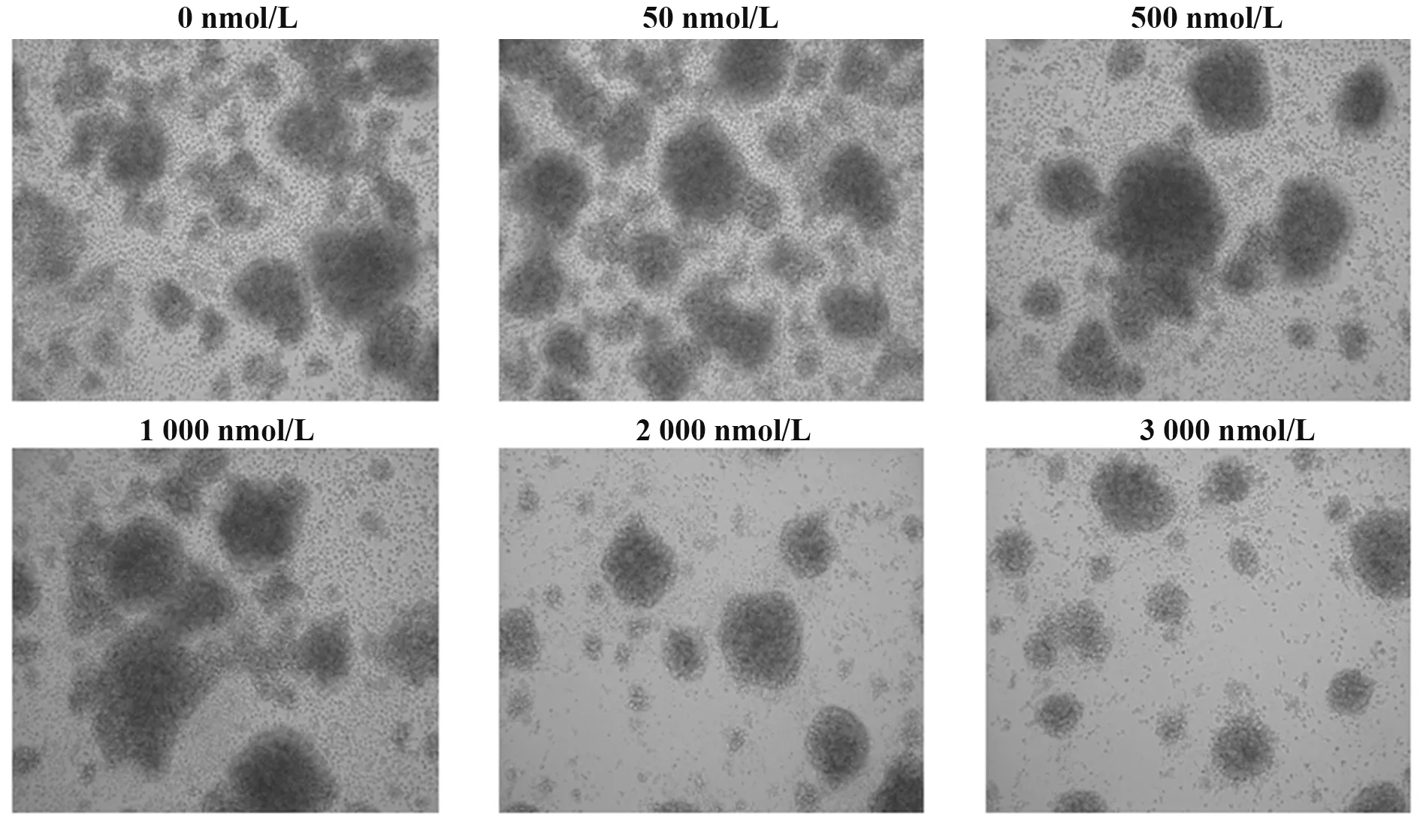
图2 不同剂量DAC刺激的RAK细胞的生长状态Fig.2 Growth status of RAK cells treated with different concentrations of DAC
2.2 DAC 对RAK 细胞增殖的影响 随着培养时间延长,细胞总数逐渐增加,培养至第12天时,DAC高浓度组(2 000 nmol/L、3 000 nmol/L)与50 nmol/L 组相比,细胞数量显著减少(图3A)。如图3B、C所示,RAK细胞在第4天快速增殖,添加不同浓度的DAC各组增殖率分别为(83.40±0.55)%、(82.4±3.30)%、(81.80±2.19)%、(79.50±3.46)%、(76.80±6.33)%、(71.40±6.78)%,DAC 3 000 nmol/L 组增殖率显著低于DAC 50、500、1 000 nmol/L组(P<0.05),提示DAC浓度越大,对细胞增殖抑制越显著。

图3 DAC对RAK细胞增殖的影响Fig.3 Effects of DAC on proliferation of RAK cells
2.3 DAC 对RAK 细胞免疫表型的影响 随着培养时间延长,各组RAK 细胞CD4 比例呈上升趋势,CD8 比例呈下降趋势。与对照组相比,培养第10 天高浓度DAC 组(1 000、2 000、3 000 nmol/L)RAK 细胞CD4 比例显著升高(P<0.05),CD8 比例显著降低(P<0.05),见图4。各组RAK细胞NKT(CD3+CD56+)比例随培养时间延长呈上升趋势,在第12 天,3 000 nmol/L DAC 刺激RAK 细胞组NKT 比例明显升高(P<0.01),见图5。第10天收集各组RAK 细胞检测记忆表型,发现CD4+或CD8+TCM(CD45RA-/CD62L+)表达随DAC 浓度增加呈下降趋势(P<0.05),而CD4+或CD8+的TEM(CD45RA-/CD62L-)表达随DAC 浓度增加呈轻度上升趋势。同时比较CD4+TCM 与CD8+TCM 表达,可观察到前者比例略高于后者(图6)。
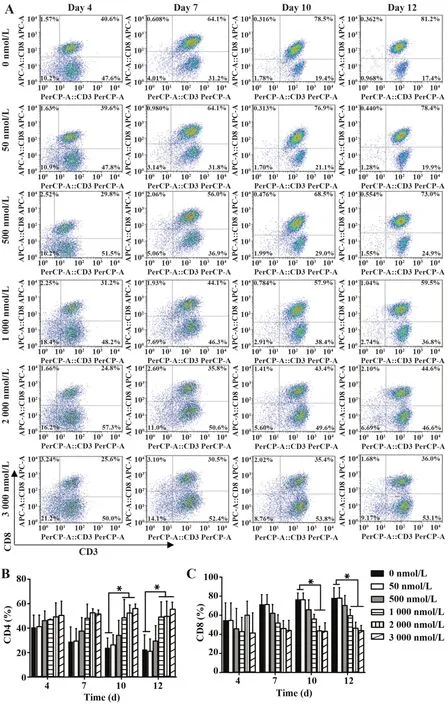
图4 不同浓度DAC 刺激的RAK 细胞在不同时间点对CD4、CD8表达的影响Fig.4 CD4 and CD8 expressions of RAK cells in different DAC concentrations and time points
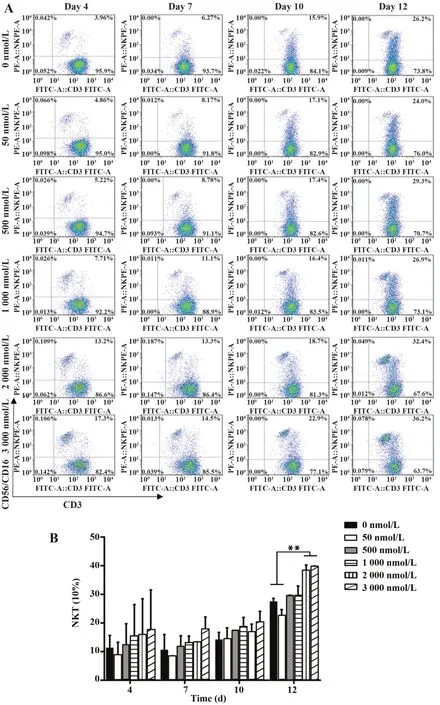
图5 不同浓度DAC 刺激的RAK 细胞在不同时间点对NKT表达水平的影响Fig.5 NKT expression of RAK cells in different DAC concentration and time points
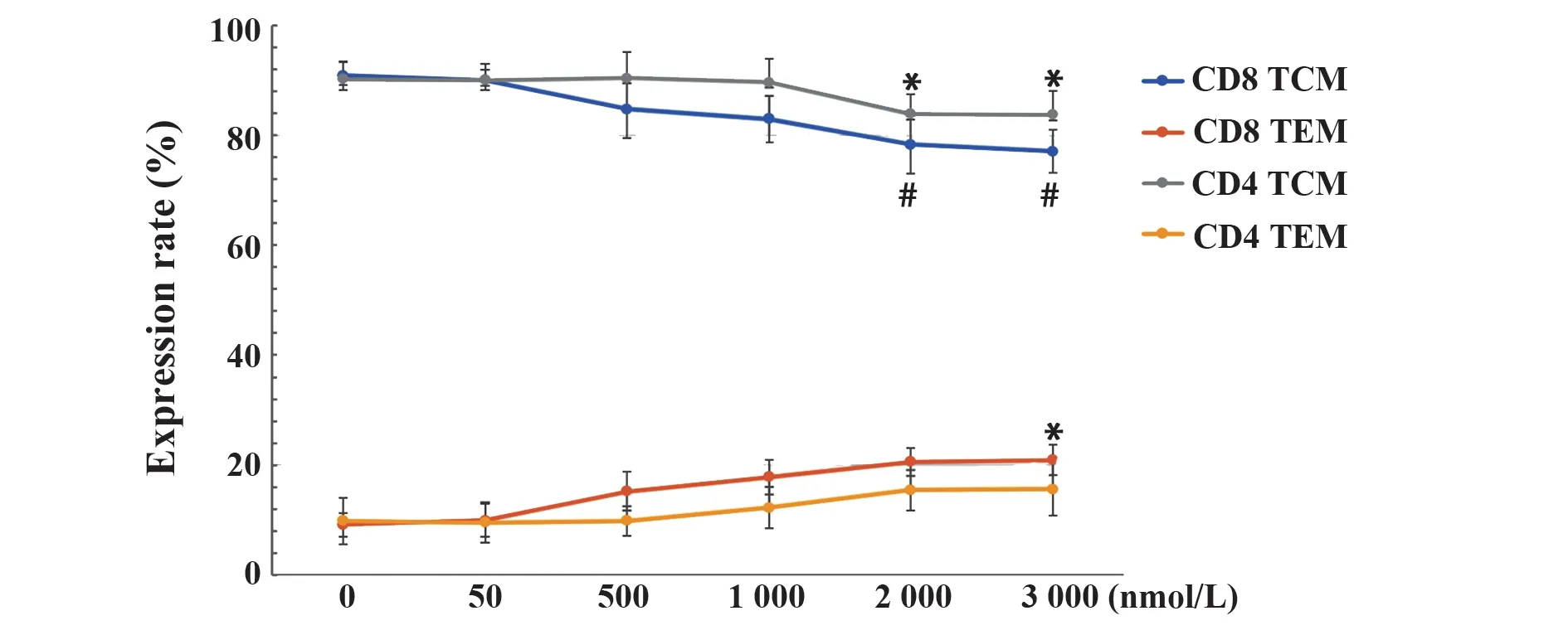
图6 不同浓度DAC对RAK细胞记忆表型的影响Fig.6 Effects of different concentrations of DAC on memory phenotype of RAK cells
2.4 DAC 对RAK 细胞凋亡水平的影响 与对照组相比,随着培养时间延长,高浓度DAC 刺激组(1 000、2 000、3 000 nmol/L)凋亡水平显著升高(P<0.05,P<0.01),提示DAC 浓度超过1 000 nmol/L 时可促进RAK细胞凋亡(图7)。
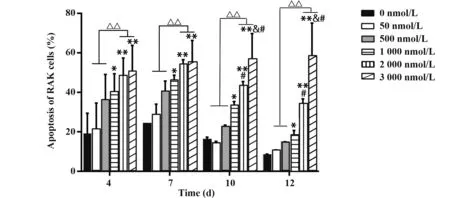
图7 不同浓度DAC对RAK细胞凋亡的影响Fig.7 Effects of different concentrations of DAC on apoptosis of RAK cells
2.5 DAC 对RAK 细胞效应功能的影响 于培养第10 天收集不同浓度DAC 刺激的RAK 细胞检测免疫效应相关分子表达。图8A 显示,与其他DAC 浓度组相比,1 000 nmol/L DAC 刺激组IFN-γ水平显著升高(P<0.05)。500 nmol/L 和1 000 nmol/L DAC 刺激组的perforin 表达高于0 nmol/L 和50 nmol/L DAC刺激组(P<0.01)。500 nmol/L 和1 000 nmol/L DAC刺激组的GrB 表达略高于其他组,但差异无统计学意义(P>0.05)。以HepG2为靶细胞,按效靶比10:1与RAK 细胞共孵育,流式细胞术检测RAK 细胞表面CD107a 表达,图8B 显示,经500、1 000 nmol/L DAC 刺激的RAK 细胞的细胞毒效应分子CD107a的阳性率较对照组提高更为明显(P<0.05)。

图8 不同浓度DAC对RAK细胞毒活性的影响Fig.8 Effects of different concentrations of DAC on cytotoxic activity of RAK cells
3 讨论
过继性免疫治疗(adoptive cell transfer therapy,ACT)领域正在快速发展,以T 细胞为主的细胞免疫治疗受到广泛关注,科学家们对如何优化T 细胞的生成、提高T 细胞杀伤效率、减少T 细胞耗竭、开发通用型T细胞、减少肿瘤微环境抑制、降低临床毒性等问题展开了深入研究[10-12]。RN 是重组人纤维连接蛋白片段,包括细胞结合域、肝磷脂结合域和CS-1位点3 个功能区域,包被在培养介质上的RN 与CD3Ab 协同作用可有效刺激外周血T 细胞的附着、伸展、分化和增殖[13]。本研究采用RN 联合CD3Ab包被后加入IL-2 共同刺激PBMC,获得了上万倍增殖的RAK细胞,大大提高了细胞培养效率。RAK细胞是广谱的免疫效应细胞,在这个异质性细胞群体中,主要的效应细胞为CD3+CD8+细胞毒T 细胞(cytotoxic T lymphocyte,CTL)。目前为提高T 细胞制品的治疗效果,许多研究主要集中于应用药物或细胞因子等进行诱导培养及条件优化,提高效应细胞的体外增殖水平及免疫活性。
DAC 是FDA 批准的DNA 去甲基化剂,已被证实能够抑制DNA甲基转移酶,逆转衰竭相关的DNA甲基化程序,从而在体内外激活表观遗传沉默的基因[14-15]。本研究在体外添加不同浓度的DAC 对RAK细胞进行短时刺激(24 h),然后充分去除药物,在不同时间点观察药物作用后RAK 细胞的生长趋势和免疫效应活性。CFSE增殖实验结果显示,RAK细胞在培养第4天快速增殖,高剂量的DAC,特别是3 000 nmol/L组增殖率显著低于50、500、1 000 nmol/L DAC 组。细胞计数结果提示,随着培养时间延长,细胞总数逐渐增多,到培养后期DAC 高浓度组(2 000、3 000 nmol/L)细胞数量显著降低,提示DAC浓度越高,对细胞扩增抑制越显著。RAK 细胞群是以CD8+为主的细胞群,随着培养时间延长,CD8+比例可达80%以上,尽管CD8+T 细胞是发挥肿瘤杀伤作用的主要细胞群,但CD4+T 细胞的调节性和记忆维持性不容忽视,失去CD4+T 细胞的辅助会导致CD8+T 细胞耗竭[12]。因此不论是体外扩增培养,或是基因工程改造的T 细胞,合适的CD4+/CD8+T 细胞都有利于二者相互协调共同发挥抗肿瘤作用[17]。在细胞制品中提高CD4+T 细胞比例,可能是提高过继免疫细胞疗效的关键。本研究发现,随着培养时间延长,DAC 刺激的RAK 细胞CD4 和NKT 比例呈上升趋势,CD8 比例呈下降趋势,尤其是高浓度DAC(1 000、2 000、3 000 nmol/L)会促进CD4+T 细胞比例升高。但当DAC 浓度超过1 000 nmol/L 时,会加速RAK 细胞凋亡。本研究通过记忆表型分析发现RAK 细胞以中央记忆型T 细胞亚群(CD45RA-/CD62L+)为主,CD4+或CD8+TCM 表达虽然随DAC 浓度增加呈下降趋势,但在DAC 刺激后CD45RA-/CD62L+的表达更集中于CD4 阳性而非CD8 阳性的RAK 细胞,提示DAC 有利于CD4+T 细胞TCM 生成,从而使其具备更加持久的抗肿瘤能力。本研究还发现低浓度DAC 不仅不影响细胞增殖,还能够促进细胞毒相关细胞因子分泌,特别是1 000 nmol/L DAC 刺激的RAK 细胞分泌的IFN-γ 和perforin 水平显著升高。细胞毒效应分子CD107a 的阳性率也显著高于对照组,提示该浓度下DAC刺激的RAK细胞对肿瘤细胞杀伤作用明显增强。
现有的研究表明,DNA 甲基转移酶3a(DNMOL/LT3a)介导的新生DNA 甲基化不仅直接驱动T 细胞抑制和衰竭,DNA 甲基化也可通过改变多种免疫相关基因的转录水平而导致T 细胞分化和活性的改变[15-16]。2013年,KOPP 等[8]发现使用的DAC 剂量不同会出现低甲基化和细胞毒性的双相反应,低浓度DAC 在细胞增殖过程中影响NK 细胞激活和抑制受体表达,高剂量DAC 降低NK 细胞增殖和活力。近期有研究采用低剂量(10~100 nmol/L)DAC 作用CAR-T 细胞,发现DAC 可启动表观遗传重编程,赋予CAR-T 细胞增强和持久的抗肿瘤潜能,提供了一种体外给药制备具有更好抗肿瘤特性的CAR-T 细胞的选择[9,18]。该课题组一致认为DAC 在一定剂量范围内可产生最佳免疫调节作用。而在本研究中,由于DAC作用的是RAK细胞,本研究推荐的作用于RAK 细胞的DAC 浓度为1 000 nmol/L,大大超过既往研究使用的剂量,考虑到也许是RN 能抵抗由于淋巴细胞增殖过程中高度活化而诱发的细胞凋亡,使活化细胞保持高分裂状态。当细胞处于快速增殖状态,用较高剂量的去甲基药物短时间刺激也可获得更高的扩增率、更合适的细胞亚群比例及更强免疫活性的效应细胞。将药物引入RAK 培养体系也为今后RAK 的临床应用提供良好的基础借鉴,在此研究基础上,课题组将进一步通过动物实验验证DAC刺激的RAK 细胞的抗肿瘤疗效,同时希望在基因组学水平研究DAC 对RAK 细胞关键转录因子及免疫相关信号通路等的影响,也为改善过继性T 细胞治疗提供可参考的实验数据。