miR-152调控Wnt通路对CRC细胞生物学行为和免疫功能的影响①
周锐泽 李文亮 黄 鉴 保见坤 (昆明医科大学第一附属医院肿瘤外科,昆明650032)
手术、放疗及化疗是治疗大肠癌(colorectal can‑cer,CRC)的重要手段,转移和复发是导致CRC 预后不佳的重要原因[1]。免疫抑制是肿瘤细胞逃脱机体免疫系统监视的重要途径,肿瘤细胞分泌的TNF-α和可溶性白细胞介素-2 受体(soluble interleukin-2 receptor,sIL-2R)抑制细胞免疫,从而促进CRC 的增殖和转移[2]。微小RNA(microRNA,miRNA)是一种短的、不具备编码能力的单链RNA,miRNA 可靶向结合信使RNA(message RNA,mRNA)的3'端非翻译区域(3'-ntranslated region,3'-UTR)并抑制其翻译,近年来研究发现miRNA 在肿瘤的发生和发展中具有重要作用[3]。miR-152 是一种新发现的与肿瘤有关的miRNA,一项研究显示miR-152 在CRC 中水平降低,且低水平的miR-152预示不良预后,提示miR-152 在CRC 中具有抑癌作用,但其作用机制尚不清楚[4]。一项最新研究结果显示miR-152 可通过抑制Wnt 通路抑制子宫内膜上皮细胞增殖,但关于miR-152 与CRC 的关系仅通过了临床的相关性分析得到,而关于miR-152 对CRC 细胞生物学行为的影响和分子机制仍不清楚[5]。此外,最新研究显示Wnt也参与肿瘤的免疫抑制,结直肠癌细胞可通过Wnt/β-catenin 通路促进IL-17a 表达,从而抑制T 细胞的免疫能力,但Wnt/β-catenin 与CRC 免疫抑制的关系尚不明确,且miR-152 调控CRC 的机制是否与Wnt/β-catenin 通路有关也不清楚[6]。综上,本文主要分析miR-152调控Wnt通路对CRC 细胞生物学行为和免疫功能的影响。
1 材料与方法
1.1 材料 人CRC 细胞系SW116(ATCC 公司,美国);DMEM 培养基血清和抗体、LipofectamineTM2000(Invitrogen公司,美国);miR-152类似物(mimic)和抑制剂(inhibitor)以及相应的阴性对照(negative control,NC,GenePharma 公司,中国);miRNeasy Mini试剂盒;TaqMan miRNA 试剂盒、ECL 显色试剂盒(Thermo Fisher 公司,美国);MiScript SYBR Green PCR 试剂盒(TaKaRa 公司,日本);CCK-8 试剂盒和结晶紫染色试剂盒(Beyotime 生物技术研究所,中国);Transwell 小室、基质胶基质(Corning,Becton Dickinson 公司,美国);FACS Canto Ⅱ流式细胞仪和Annexin V-FITC/碘化丙啶(PI)试剂盒(BD Biosci‑ences 公司,加拿大);抗体MTDH 和山羊抗兔IgG H&L(HRP,Abcam 公司,美国);PVDF 膜(Bio-Rad公司,美国);ELISA 试剂盒(碧云天公司,中国);光学显微镜(奥林巴斯公司,日本)。
1.2 方法
1.2.1 细胞分组和转染 将DMEM 培养基中处于对数生长期的SW116细胞分为3组:NC组、mimic组和inhibitor组。mimic组和inhibitor组通过LipofectamineTM2000 转 染50 nmol/L 的miR-152 mimic 或in‑hibitor 上调或抑制miR-152 水平,NC 组转染等量的NC 空载质粒作为对照组,转染条件为7 ℃、5%CO2、48 h。通过RT-qPCR分析转染效果。
1.2.2 RT-qPCR 使用miRNeasy Mini 试剂盒提取总miRNA,并通过TaqMan miRNA 反转录试剂盒形成cDNA。利用MiScript SYBR Green PCR 试剂盒对互补DNA进行扩增(95 ℃10 s,55 ℃30 s,72 ℃30 s,40 个循环)。通过比较循环阈值并以U6 作为内参计算miR-152相对表达水平。
1.2.3 CCK-8 法检测细胞增殖 将100 μl 细胞悬浮液添加到96 孔板中,孵育24 h、48 h 和72 h 后,将10 μl CCK-8 溶液添加到每个孔中孵育2 h。酶标仪检测450 nm波长下每个孔的光密度(OD)值。
1.2.4 划痕愈合实验检测细胞迁移 将培养接种于6 孔板中的1×105个细胞培养至约90%融合。使用200 μl的移液器吸头刮擦细胞,拍照(此时为0 h)。在相同条件下继续培养48 h。通过细胞的图像使用光学显微镜观察并拍照,划痕前缘迁移距离百分比(%)=(0 h宽度-48 h宽度)/0 h宽度×100%。
1.2.5 Transwell 检测细胞侵袭 37 ℃下将细胞培养在无血清DMEM 中,将细胞(5×104个/ml)进行血清饥饿处理24 h。然后将细胞接种至24 孔Tran‑swell 装置的上部腔室,将含有15%胎牛血清的DMEM 充满下部腔室。24 h 后清洗掉未侵入的细胞,并将渗透到下腔室中的细胞用95%乙醇固定,并在室温下用0.1%结晶紫染色20 min。在400 倍视野下计随机5个视野中细胞个数。
1.2.6 流式细胞术检测凋亡 将处理后的各组细胞使用不含EDTA的0.25%胰蛋白酶消化,将1×106个细胞先后用预冷的PBS 和5%牛血清白蛋白(BSA)洗涤3 次,以2 000 r/min 离心收集。然后向细胞中加入300 μl 的5%BSA 和700 μl 的70%的预冷乙醇,低温过夜。将细胞以2 000 r/min离心5 min收集并使用PBS 洗涤,细胞与100 μl 结合缓冲液和5 μl的Annexin-V-FITC(20 μg/ml)静置15 min 在黑暗中孵 化,然 后 将150 μl 结 合 缓 冲 液 和10 μl 的PI(50 μg/ml)加入试管中静置15 min 在黑暗中孵化,通过FACS Canto Ⅱ流式细胞仪测量凋亡率。
1.2.7 Western blot 细胞裂解后4 ℃、12 000 r/min离心5 min,收集总蛋白。通过8%SDS-PAGE 分离每个样品中等量(50 μg)的蛋白质,并将其转移到硝酸纤维素膜上。通过在室温下将膜浸入5%脱脂牛奶中2 h 封闭非特异性抗原。随后,将膜与TNF-α、sIL-2R、Wnt1、β-catenin、c-myc 抗体在4 ℃下孵育过夜,然后将膜与相应的辣根过氧化物酶偶联的二抗在室温下孵育1 h。使用化学发光试剂显示,Quantum One软件分析灰度计算相对于GAPDH的表达量。
1.3 统计学处理 统计分析使用SPSS19.0 软件。数据以±s 表示,计数资料使用率(%)表示,进行单因素方差分析,两两比较通过SNK-q 检验。P<0.05表示差异有统计学意义。
2 结果
2.1 各组细胞中miR-152水平比较 转染后,mimic组的miR-152 水平(5.94±0.58)显著高于对照组(1.17±0.20)(P<0.01),inhibitor 组的miR-152 水平(0.26±0.09)显著低于对照组(P<0.01),提示转染实验成功,见图1。

图1 各组细胞中miR-152水平比较Fig.1 Comparison of miR-152 levels of each group
2.2 各组细胞增殖情况比较 在培养第2 天和第3天,mimic组的OD值显著低于NC组,而inhibitor组的OD 值显著高于NC 组(P<0.05),提示miR-152可抑制SW116细胞增殖,见表1。
表1 各组细胞OD值比较(±s)Tab.1 Comparison of cell OD value of each group(±s)
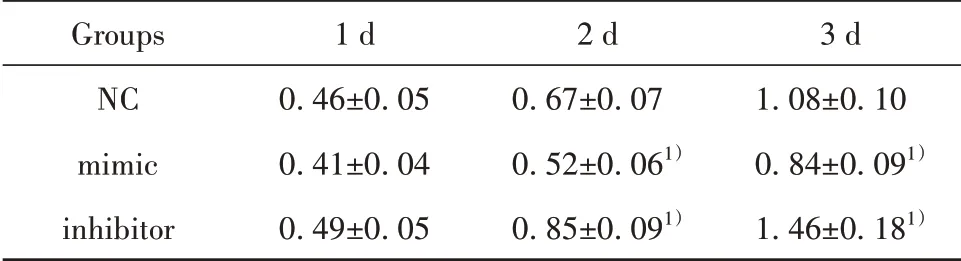
表1 各组细胞OD值比较(±s)Tab.1 Comparison of cell OD value of each group(±s)
Note:Compared with NC group,1)P<0.05.
Groups NC mimic inhibitor 1 d 0.46±0.05 0.41±0.04 0.49±0.05 2 d 0.67±0.07 0.52±0.061)0.85±0.091)3 d 1.08±0.10 0.84±0.091)1.46±0.181)
2.3 各组细胞迁移能力比较 mimic 组细胞划痕前缘迁移距离百分比显著低于NC组,而inhibitor组(87.56±6.38)%显 著 高 于NC 组(P<0.05),提 示miR-152可抑制SW116细胞迁移,见表2、图2。

图2 划痕愈合试验检测细胞迁移能力Fig.2 Scratch healing test to detect cell migration ability
表2 各组细胞划痕前缘迁移距离比较(±s,%)Tab.2 Comparison of migration distance of leading edge of scratch in each group(±s,%)
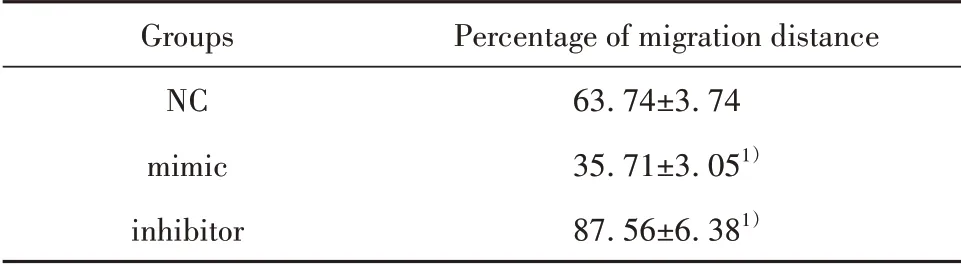
表2 各组细胞划痕前缘迁移距离比较(±s,%)Tab.2 Comparison of migration distance of leading edge of scratch in each group(±s,%)
Note:Compared with NC group,1)P<0.05.
Groups NC mimic inhibitor Percentage of migration distance 63.74±3.74 35.71±3.051)87.56±6.381)
2.4 各组细胞侵袭能力比较 mimic 组侵袭细胞数显著低于NC组,而inhibitor组显著高于NC组(P<0.05),提示miR-152 可抑制SW116 细胞侵袭,见表3、图3。
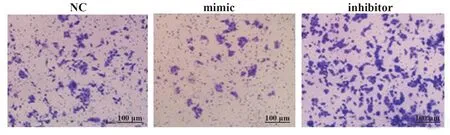
图3 Transwell实验检测细胞侵袭能力Fig.3 Transwell assay to detect cell invasion ability
表3 各组侵袭细胞数目比较(s)Tab.3 Comparison of number of invasive cells in each group(s)

表3 各组侵袭细胞数目比较(s)Tab.3 Comparison of number of invasive cells in each group(s)
Note:Compared with NC group,1)P<0.05.
Groups NC mimic inhibitor Number of invasive cells 97.64±7.86 60.16±7.311)169.43±11.751)
2.5 各组细胞凋亡情况比较 mimic 组细胞凋亡率显著高于NC组,而inhibitor组显著低于NC组(P<0.05),提示miR-152 可促进SW116 细胞凋亡,见表4、图4。

图4 流式细胞术检测细胞凋亡Fig.4 Flow cytometry to detect apoptosis
表4 各组细胞凋亡率比较(±s,%)Tab.4 Comparison of apoptosis rate of each group(±s,%)

表4 各组细胞凋亡率比较(±s,%)Tab.4 Comparison of apoptosis rate of each group(±s,%)
Note:Compared with NC group,1)P<0.05.
Groups NC mimic inhibitor Apoptosis rate 6.79±0.95 12.20±1.681)3.65±0.641)
2.6 各组免疫功能的影响 mimic 组的TNF-α、sIL-2R 蛋白水平显著低于NC 组(P<0.05),inhibitor组的TNF-α、sIL-2R 蛋白水平显著高于NC 组(P<0.05),见表5、图5。

图5 Western blot检测各组TNF-α、sIL-2R蛋白水平Fig.5 Western blot detection of TNF-α and sIL-2R protein levels in each group
表5 各组TNF-α、sIL-2R水平比较(ˉ±s)Tab.5 Comparison of TNF-α and sIL-2R levels in each group(±s)

表5 各组TNF-α、sIL-2R水平比较(ˉ±s)Tab.5 Comparison of TNF-α and sIL-2R levels in each group(±s)
Note:Compared with NC group,1)P<0.05.
2.7 各组Wnt通路相关蛋白比较 mimic 组Wnt1、β-catenin、c-myc蛋白水平显著低于NC组(P<0.05),inhibitor 组Wnt1、β-catenin、c-myc 蛋白水平显著高于NC组(P<0.05),见表6、图6。
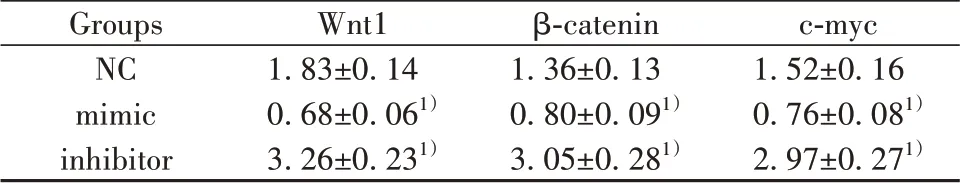
表6 各组Wnt1、β-catenin、c-myc蛋白比较(xˉ±s)Tab.6 Comparison of Wnt1,β-catenin and c-myc proteins in each group(xˉ±s)
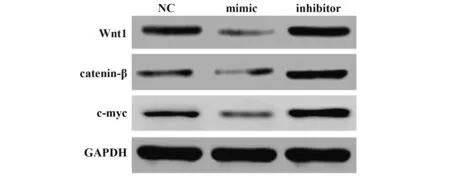
图6 Western blot 检测各组Wnt1、β-catenin、c-myc 蛋白水平Fig.6 Western blot detection of Wnt1,β-catenin and c-myc protein level in each group
3 讨论
CRC 是消化道系统常见肿瘤,一项全球性的统计调查结果显示,2018 年全年新发CRC 患者共704 376 例,占所有肿瘤的3.9%,排名第八,2018 年死于CRC 的患者有310 394 例,占所有肿瘤的3.2%,排名第十[7]。现阶段治疗CRC 的方法主要是手术治疗、放疗、化疗和免疫疗法,虽然大多数CRC在短期内会得到有效缓解,但其长期疗效仍不理想,大多数CRC 患者会出现复发和转移,并最终导致患者死亡,探究CRC 发生进展的机制具有重要意义[8]。
miRNA 可通过碱基配对方式与mRNA 的3'-UTR 区域结合,从而在转录后水平上调节基因的表达水平。miRNA 在CRC 转移、复发中有显著作用,如miR-4319、miR-32 等[9-10]。miR-152 是一种新发现的与肿瘤有关的miRNA,在乳腺癌和子宫内膜癌中发挥抑癌作用[11-12]。本研究通过CRC 细胞系SW116构建miR-152 过表达或抑制的细胞模型,结果显示提高miR-152水平可显著抑制细胞增殖、凋亡、迁移和侵袭功能,并在体外显示出促进细胞凋亡的作用,抑制miR-152 得到相反的结果。ARDAVAN等[13]的研究结果显示miR-152可能通过AKT通路抑制CRC 细胞的增殖和侵袭。LI 等[14]的研究结果提示miR-152可显著抑制CRC细胞增殖。以上研究表明,在CRC 中miR-152 发挥抑癌作用,并且可抑制TNF-α、sIL-2R 表达,TNF-α、sIL-2R 起到免疫抑制作用,不但可以使CRC 细胞被免疫系统清除,还可促进肿瘤细胞转移[15]。提示miR-152还可以发挥免疫抑制的作用。
Wnt 通路在CRC 的进展中具有重要作用,Wnt1的激活及β-catenin 可调控原癌基因转录,c-myc 是Wnt 通路的下游靶基因,具有促进CRC 增殖和转移的作用[16]。此外,Wnt 通路也具有促进免疫抑制的作用,研究显示Wnt/β-catenin 通路可促进sIL-2R 或抑制TNF-α 的水平抑制组织中浸润的免疫细胞功能和活力,从而使肿瘤细胞免受机体免疫系统清除[17]。本研究结果显示上调miR-152 水平会限制Wnt1/β-catenin 途径的蛋白水平以及下游靶蛋白c-myc 水平,而下调miR-152 的水平会促进Wnt 通路。有研究显示miR-152 的降低或促进Wnt 通路,从而激活炎症通路[18]。SUN 等[19]的研究显示在CRC 中miR-152 通过抑制Wnt/β-catenin 途径诱导细胞的凋亡并抑制增殖。miR-152 的上调可抑制经典Wnt 途径的激活,并抑制成纤维样滑膜细胞的增殖[20]。在骨髓间充质干细胞中,抑制miR-152 可通过调节Wnt 通路促进增殖和成骨分化[21]。此外,近年来研究也发现了Wnt 通路活化与局部免疫有关,并认为抑制Wnt通路缓解免疫抑制可能成为癌症的辅助治疗手段[22]。PIAZZA 等[23]的研究也显示抑制Wnt 通路可以通过解除免疫抑制,促进TNF-α 等具有肿瘤细胞杀伤力的细胞因子表达。提示在CRC中,miR-152 也具有缓解细胞的免疫抑制状态的作用,而这种作用可能与miR-152 具有抑制Wnt 通路的功能有关。
综上所述,本次体外实验发现了miR-152 可通过抑制Wnt 途径缓解CRC 细胞的免疫抑制状态,抑制增殖、转移并促进凋亡。关于miR-152 通过抑制Wnt 抑制CRC 的作用仍需要体内实验验证,其作用机制值得深入研究。