细胞自噬调控上皮间质转化在肺纤维化中的作用机制
胡琴 张晨曦 柯少瑞
河南中医药大学1呼吸疾病中医药防治省部共建协同创新中心,2河南省中医药防治呼吸病重点实验室,3中医药科学院,4药学院(郑州450046)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是以肺实质纤维化和肺功能丧失为特征进行的最终致死性疾病[1]。欧美数据显示,70 岁以上老年人患IPF 风险是40 岁以上人群的6.9 倍[2-3],在2000年至2008年,IPF 的发病率增加了35%,累计患病率从13.4/10 万上升到18.2/10 万[4-5]。肺泡上皮间质转化(epithelial-mesenchymal transition,EMT)是IPF 发病的关键环节之一[6-7]。临床研究证实IPF 患者肺组织内存在肺泡上皮细胞EMT 异常活跃的现象,肺上皮细胞发生EMT 转化为成纤维细胞和肌成纤维细胞,促进病程发展[8]。目前,IPF 的治疗原则主要集中在抗纤维化、抗炎、抗氧化等方面,主要治疗药物有吡非尼酮、尼达尼布、糖皮质激素、N-乙酰半胱氨酸等[9],但均存在较多副作用。因此,亟需加强IPF 分子病理机制研究,为其有效防治提供实验基础。研究表明,自噬与IPF 的发生发展关系密切[10-11]。LI 等[12]实验表明,瑞格非尼通过TGF-β1 信号转导促进肌成纤维细胞自噬,抑制肌成纤维细胞的活化和EMT 的产生,从而缓解肺纤维化。TENG 等[13]在TGF-β1 刺激的肝星形细胞中熊去氧胆酸通过下调线粒体自噬的表达抑制肝纤维化。由此可推测细胞自噬与EMT在IPF 进程及治疗中具有重要作用。因此,本实验利用TGF-β1 诱导人源肺泡上皮细胞A549 建立纤维化模型,观察肺上皮细胞EMT 及自噬水平的改变,并通过使用雷帕霉素(rapamycin,RAPA)促进自噬,观察其对A549 细胞EMT 的影响,探讨自噬对A549 细胞EMT 的调节作用及其机制,为进一步阐明IPF 的发病机制提供实验依据。
1 材料与方法
1.1 细胞与试剂人源肺泡上皮细胞A549,购自中国科学院上海生命科学院细胞资源中心;RPMI 1640 培养基、胎牛血清、胰蛋白酶-EDTA 消化液、PBS 缓冲液(Biological Industries 公司,南美);自噬激动剂RAPA(MedChemExpress 公司,美国);RIPA裂解液、BCA 蛋白浓度测定试剂盒(北京索莱宝科技有限公司);PAGE 凝胶制备试剂盒、彩色预染蛋白Marker(上海雅酶生物医药科技有限公司);GAPDH、Beclin1、E-cadherin(E-cad)、N-cadherin(N-cad)、Fibronectin(FN1)抗体,山羊抗鼠、抗兔二抗,免疫荧光二抗(武汉Proteintech 公司);LC3 抗体(GeneTex 公司,美国);p62 抗体(Cell Signaling Technology 公司,美国);4%多聚甲醛、QuickBlock免疫染色封闭液、免疫染色通透液(Triton X-100)等试剂购自上海碧云天生物技术有限公司。
1.2 建立TGF-β1 诱导的A549 细胞模型A549细胞用含10%胎牛血清和1% 青/链霉素的RPMI 1640 培养基培养,待细胞密度达30%左右,更换为无血清的RPMI 1640 培养基饥饿培养2 h,分别以2.5、5、7.5、10、15 ng/mL 的TGF-β1 刺激细胞,培养48 h 后观察细胞形态,利用CCK8 检测24、48 h细胞活力,Western blot 检测EMT 相关蛋白E-cad、N-cad 及自噬相关蛋白Beclin1、p62 的表达,筛选出细胞形态较好、无细胞毒性、蛋白表达变化明显的诱导浓度及时间,最终以5 ng/mL TGF-β1刺激A549细胞48 h建立肺纤维化体外模型。模型建立后,选用10 nmol/L RAPA观察自噬对A549细胞EMT的影响,将A549 分为空白组(control)、模型组(5 ng/mL TGF-β1)、RAPA组(10 nmol/L)、TGF-β1+RAPA(5 ng/mL TGF-β1+10 nmol/L RAPA)组,培养48 h 后,进行检测。
1.3 细胞活力检测A549 细胞接种于96 孔板中,每组设立6 个复孔,孵育24 h,给予不同浓度TGFβ1 分别处理24、48 h 后,每孔加入10 μL 的CCK-8溶液混匀,放入培养箱培养1 h,在450 nm 处检测各组吸光值,计算各组细胞的相对活力。细胞活力(%)=实验组吸光值/对照组吸光值×100%。
1.4 TEM 的检测细胞收集后置于2.5%的戊二醛中固定24 h 后,用PBS 洗涤3 次。细胞沉淀在25 ℃下用1%锇酸进行后固定2 h,再次用PBS 洗涤三次,然后在0%、50%、70%、80%、95%、100%梯度乙醇溶液中脱水,每个梯度处理15 min,再用100%丙酮脱水处理2 次。用100%环氧树脂浸润细胞沉淀10 min,重复3 次,再用1∶1(Epon812:丙酮)缓慢摇晃渗透2 h 以上,Epon812 中浸润24 h 以上。将样品转移至包埋槽之中,加入适量的Epon812,置于60 ℃的烘箱中处理48 h 以上。超薄切片机将样品切成超薄切片(40 ~70 nm),用1%乙酸双氧铀和0.1%柠檬酸铅染色各30 min,并在透射电镜下(Tecnai G220 S-Twin 美国)观察并拍照。
1.5 Western blot收集不同处理组细胞后,使用BCA 蛋白浓度测定试剂盒检测蛋白浓度,调整各组蛋白浓度,使各组蛋白浓度一致,蛋白变性后每孔加入20 μg 蛋白样品,进行SDS-PAGE 凝胶电泳,结束后将蛋白电转至PVDF 膜,随后进行封闭,TBST 洗涤3 次。加入稀释好的一抗,GAPDH 抗体(1∶5 000)、Beclin1 抗体(1∶5 000)、p62 抗体(1∶1 000)、E-cad 抗体(1∶5 000)、N-cad 抗体(1∶5 000),置于4 ℃过夜。次日弃一抗,TBST 洗3 次;加入二抗,室温孵育1 h,弃二抗,TBST 洗3 次,滴加ECL 发光液,使用超高灵敏化学发光成像分析系统拍照并保存结果图片,进行后续分析。
1.6 免疫荧光检测A549 接种于24 孔板细胞爬片中,RAPA 预处理2 h,TGF-β1 刺激48 h 后用PBS洗涤2 次,4%多聚甲醛固定20 min 后,PBS 洗涤2 次。每孔滴加500 μL 通透液(Triton X-100),室温通透10 min 后,PBS 洗涤2 次。每孔加入500 μL免疫染色封闭液,室温封闭2 h 后,PBS 洗涤3 次。加入兔抗LC3 和鼠抗FN1 抗体(1∶500),混匀之后加入孔中,4 ℃过夜后,PBS 洗涤4 次,5 min/次。加入免疫荧光二抗(1∶300),室温孵育1 h,PBS 洗涤4 次,5 min/次。滴加适量抗荧光淬灭封片液(含DAPI)至载玻片上,取出细胞爬片倒扣于载玻片,用激光共聚焦扫描显微镜观察细胞并拍照。
1.7 统计学方法采用IBM SPSS 22.0 统计软件进行数据分析。数据以均数±标准差表示两组间差异比较采用t检验;多组间差异比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 TGF-β1 对A549 细胞形态及活力的影响利用不同浓度的TGF-β1(0、2.5、5、7.5、10、15 ng/mL)分别作用于A549 细胞。诱导48 h 后,倒置显微镜观察细胞形态变化,见图1A-F,对照组细胞形态无明显变化,呈不规则多边形;与对照组相比,实验组细胞形态由不规则多边形转变为梭形,形态发生显著性变化。CCK-8 法检测结果显示,在实验浓度范围内,TGF-β1诱导24、48 h后对A549细胞无明显的细胞毒性作用(P>0.05,图1 G、H)。
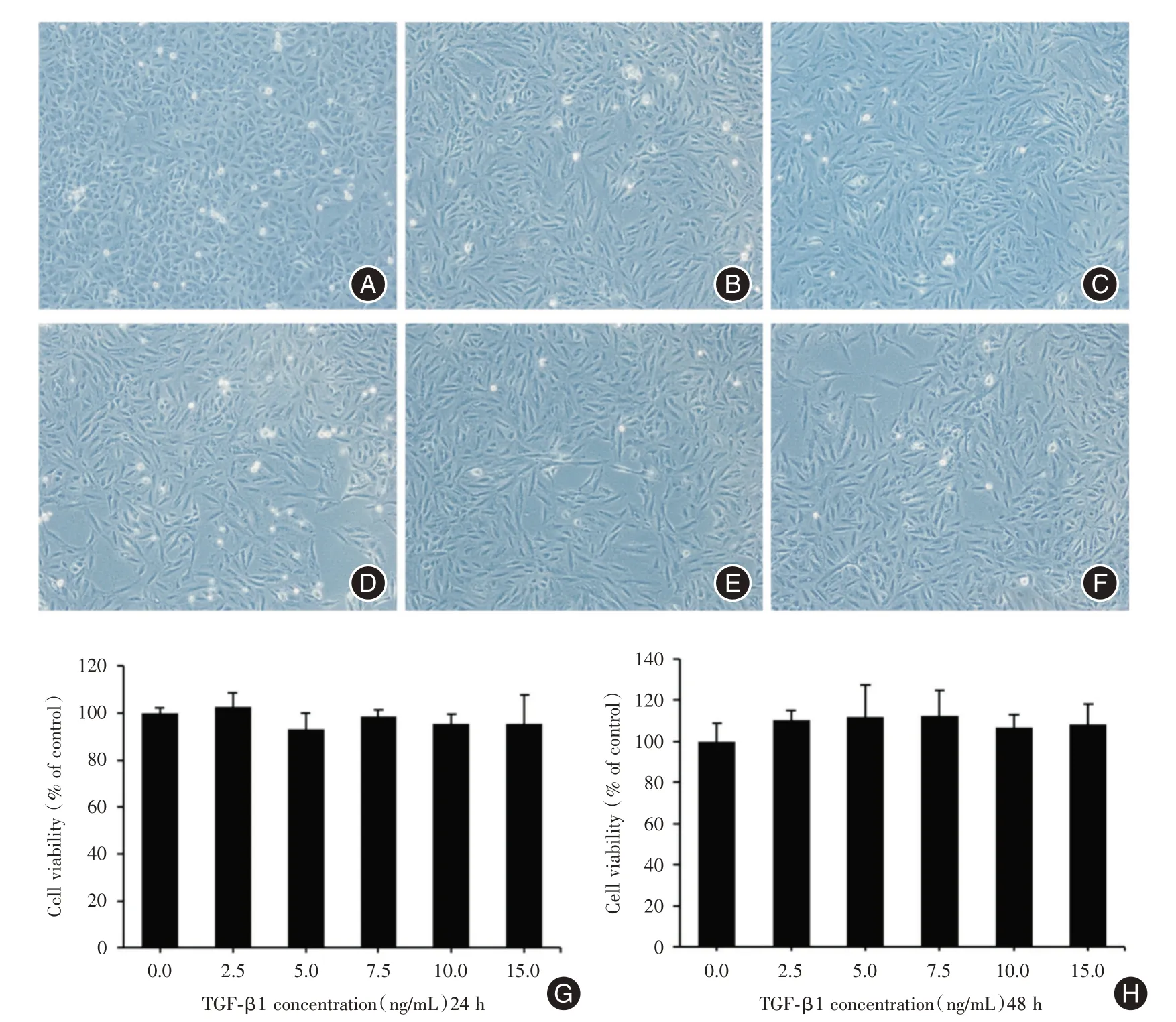
图1 不同浓度TGF-β1 对A549 细胞形态及活力的影响Fig.1 Effects of different concentrations of TGF-β1 on morphology and viability of A549 cells
2.2 TGF-β1 对自噬和EMT 相关蛋白表达的影响检测经TGF-β1 诱导A549 细胞48 h 后EMT 标志物E-cad 和N-cad,自噬标志物Beclin1 和p62的相对蛋白表达水平。见图2,与对照组相比,经TGF-β1 浓度梯度诱导后,Beclin1、E-cad 的蛋白表达下调,p62、N-cad 的蛋白表达上调(P<0.05)。最终选择5 ng/mL TGF-β1 诱导A549 细胞48 h 作为最佳作用浓度和时间,进行后续实验研究。
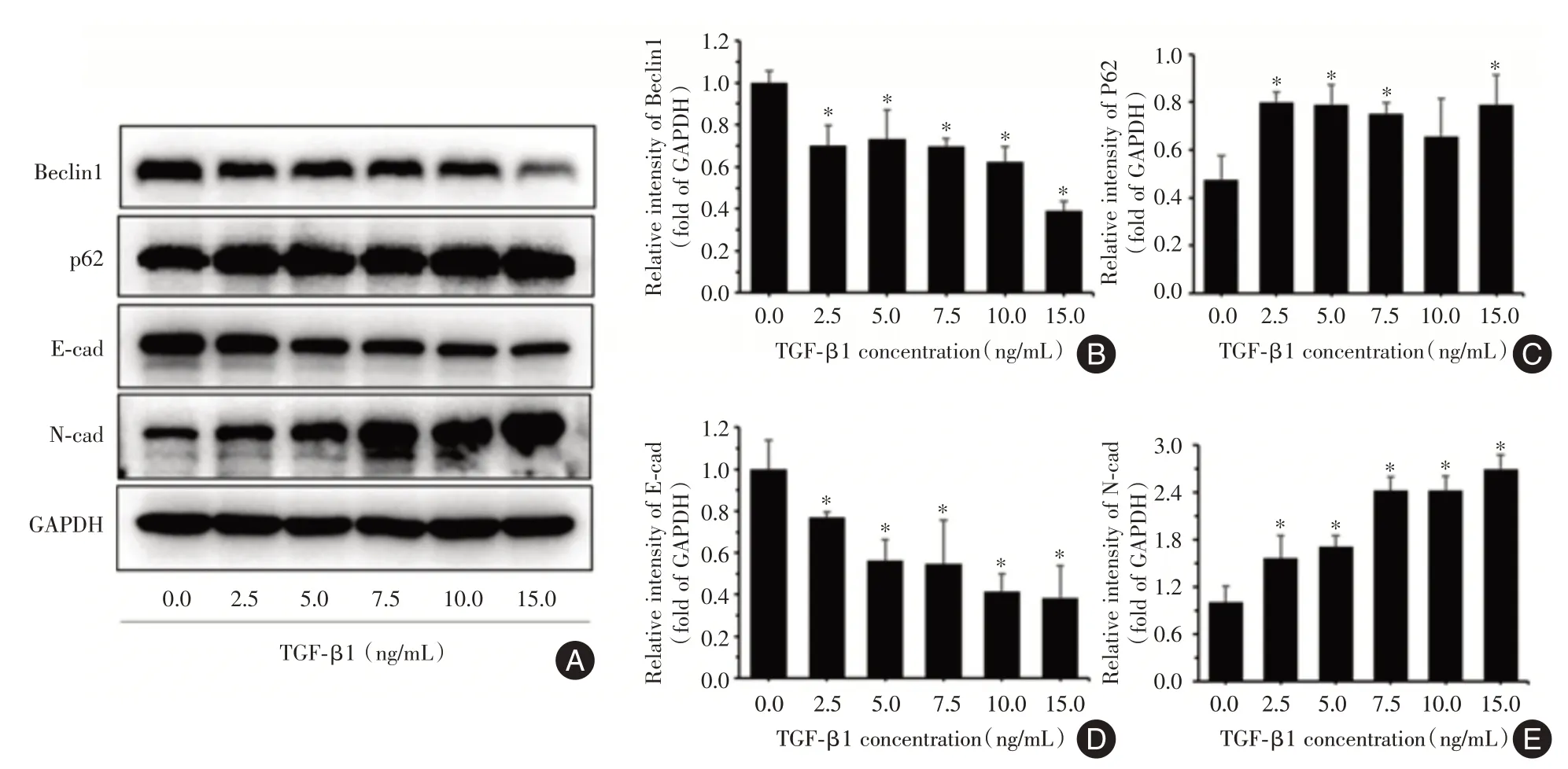
图2 不同浓度TGF-β1 对自噬和EMT 相关蛋白表达的影响Fig.2 Effects of different concentrations of TGF-β1 on autophagy and EMT-related protein expression
2.3 TGF-β1 对A549 细胞自噬的影响TEM 观测5 ng/mL TGF-β1 诱导A549 细胞48 h 后细胞超微结构的变化,见图3,和对照组相比,TGF-β1 诱导后细胞形态向梭形转变,发生显著变化;对照组中细胞内可以观察到自噬溶酶体,而TGF-β1 诱导后自噬溶酶体数量显著减少。
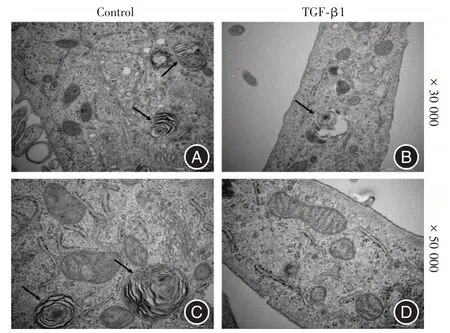
图3 TEM 观察TGF-β1 对A549 细胞自噬的影响Fig.3 TEM observation of the effect of TGF-β1 on autophagy of A549 cells
2.4 自噬激动剂对自噬和EMT 蛋白表达的影响通过Western blot 检测加入自噬激动剂RAPA后自噬指标(Beclin1、p62)和EMT相关指标的变化。见图4,与对照组相比,模型组中Beclin1、E-cad表达下调,p62、N-cad 表达上调(P<0.05);与模型组相比,RAPA+TGF-β1 组中,Beclin1、E-cad 表达上调,p62、N-cad 表达下调(P<0.05)。
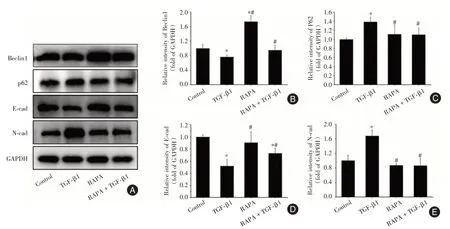
图4 自噬激动剂对自噬和EMT 相关蛋白表达的影响Fig.4 Effects of autophagy agonists on the expression of autophagy and EMT-related proteins
2.5 免疫荧光检测自噬激动剂对LC3 和FN1 表达的影响通过免疫荧光的方法检测各组细胞的LC3、Fibronectin 蛋白的表达水平,见图5,与对照组相比,TGF-β1 组LC3 的表达水平明显降低,而FN1 的表达明显升高;加入自噬激动剂后,与TGFβ1 相比,LC3 表达水平明显上升,同时FN1 表达水平明显降低。
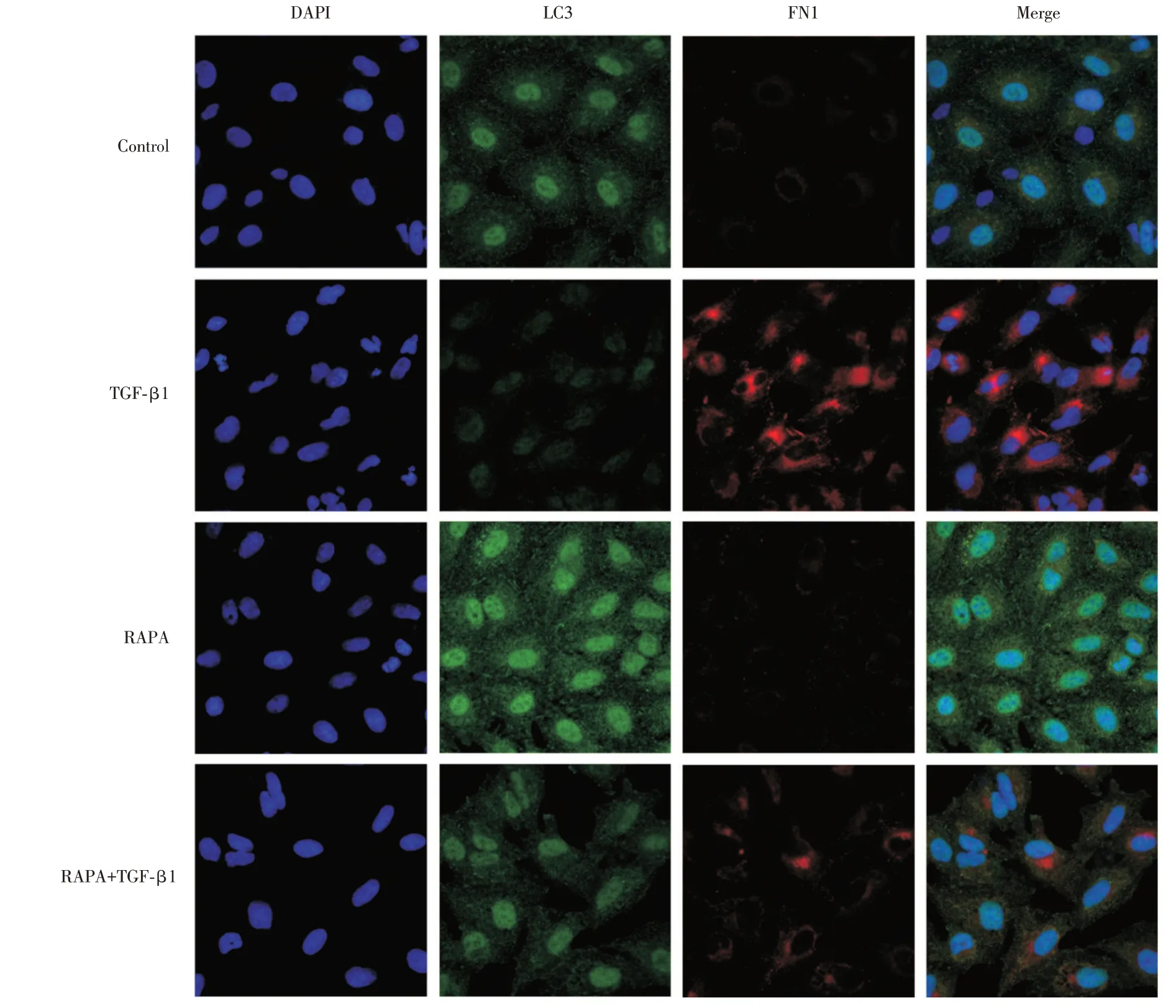
图5 免疫荧光检测自噬激动剂对LC3 和FN1 表达的影响(400×)Fig.5 Immunofluorescence detection of the effect of autophagy agonists on the expression of LC3 and FN1(400×)
3 讨论
TGF-β1 是一种重要的促纤维化细胞因子,是器官纤维化的重要调控因子,可通过介导EMT、成纤维细胞活化、胶原沉积等过程加重肺纤维化[14]。本研究采用TGF-β1 对A549 细胞进行诱导,诱导后与对照组相比,实验组细胞形态由不规则多边形向梭形转变,细胞分散开来,呈现出EMT的典型表象。Western blot 结果也证实,模型组出现了上皮标志物蛋白E-cad 下调,间质标志物蛋白N-cad 上调,说明TGF-β1 诱导的A549 细胞的EMT模型是可行的、成功的而且相对稳定。
EMT 是上皮细胞失去细胞-细胞黏附和顶端-基底极性的生物学过程,从而获得迁移、侵袭和产生ECM 成分的间质特征,导致底层基膜的降解[15]。临床病理学研究发现,IPF 患者肺上皮细胞发生EMT 转化为成纤维细胞和肌成纤维细胞,促进病程的发展,EMT 已成为IPF 发病的重要机制之一。在特发性肺纤维化的人体组织样本中,EMT主要信号通路标记物在成纤维细胞病灶和受损的上皮细胞中同时表达,为EMT 在人类病理学中发挥作用提供了间接证据[16-17]。研究证实,在IPF中,肺泡上皮细胞EMT 的发生涉及缺氧、蛋白磷酸化、细胞外基质调节失衡等多种因素。最近研究发现,细胞自噬可能是调控肺泡EMT 有效改善肺纤维化的另一条重要途径,而关于细胞自噬和肺纤维化的分子机制研究却鲜有报道。
细胞自噬是细胞对营养缺乏、生长因子剥夺、感染和缺氧等不同形式下应激所做出的适应性过程。自噬活性变化能够影响神经退行性病变、肿瘤和传染性疾病等多种疾病的病理过程。SHI 等[18]发现IPF 患者miR199a-5p 通过靶向Sirt1/AMPK 信号通路调控自噬且通过调节自噬可诱导IPF 患者间充质干细胞衰老;同时证实抑制miR199a-5p 可恢复间充质干细胞活力,延缓小鼠肺纤维化进程。此外,BAEK 等[19]发现亚精胺通过激活IPF 成纤维细胞和博来霉素诱导的纤维化肺组织中关键的自噬分子LC3-Ⅱ、Beclin-1 和ATG7 的表达来促进自噬小体的形成,有助于缓解肺部纤维化。LC3 含量的多少与自噬泡数量的多少呈正相关,与自噬程度呈正相关[20]。p62 是一种自噬降解底物蛋白,当内膜上的LC3-Ⅱ蛋白则被解离为LC3-Ⅰ并回到细胞质再次被利用,p62 蛋白则被降解,其表达水平往往与自噬水平负相关[21]。Beclin1 是在自噬过程中与形成吞噬小体的起始有关,对自噬至关重要[22]。Western blot和免疫荧光结果发现,在TGF-β1诱导的A549 细胞EMT 的过程中,Beclin1 和LC3 蛋白表达下调,而p62 蛋白表达显著性增加,表明细胞自噬水平显著降低;TEM 结果也证实,TGF-β1诱导的A549 细胞的自噬水平下降。因此,进一步深入研究细胞自噬在肺上皮细胞EMT 中的作用将有助于探索调控EMT 过程的新的分子生物学机制,为早期干预IPF 的形成提供靶点。
自噬激动剂RAPA 在体内与重组人FKBP12蛋白相结合产生复合物,该复合物能够与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)相结合,并抑制mTOR 的活化,达到增强自噬的作用[23]。本研究选用RAPA 促进细胞自噬,以观察自噬对EMT 的影响。Western blot 与免疫荧光结果均显示,与模型组相比,RAPA+TGF-β1 组提高了细胞的自噬水平,激活细胞自噬能显著改善TGF-β1 诱导的EMT 现象,进而缓解肺泡上皮细胞纤维化的发生。
综上所述,肺泡上皮细胞A549 在TGF-β1 诱导下发生EMT,同时细胞自噬水平下降;利用RAPA提高细胞自噬水平可以抑制EMT 过程,表明提高细胞自噬水平可能对TGF-β1 诱导的EMT 具有抑制作用,这为未来从自噬角度研发IPF 的防治药物提供了理论依据。然而,细胞自噬在TGF-β1 诱导的A549 纤维化模型中的过程中发挥的具体作用及分子机制还有待进一步阐明,故需更多的细胞、动物和临床实验研究进一步探索自噬与IPF 的作用关系。

