MYCBP在原发性肝细胞癌中的变化与临床病理特征的关系及临床意义
林方增,马振江,谭国胜*,蔡鸿杰,龙伟清,罗灿峤
(中山大学附属第一医院1放射介入科,2东院肿瘤科,3检验科,4病理科,广东 广州 510080)
MYC结合蛋白(MYC-bingding protein,MYCBP)通过与原癌基因MYC结合,调节c-MYC蛋白在肿瘤形成和发生过程中的作用。已有相关研究[1]表明MYCBP的异常表达与多种肿瘤细胞的增殖、转化、侵袭及转移等生物行为相关。有关MYCBP与原发性肝细胞癌(HCC)内容的文献仍属少量。本研究通过检测HCC标本中MYCBP含量,分析MYCBP在HCC中的变化与临床病理特征的关系及临床意义。
1 材料与方法
1.1 临床资料及组织标本收集经外科手术切除并经病理学确诊的62例HCC患者的肿瘤组织和癌旁组织标本。本研究通过我院临床科研伦理委员会批准,患者的临床数据资料完整,临床分期采用中国肝癌分期方法,病灶大小测量采用RECIST 1.1标准,病理分级依据WHO分级系统标准。患者术前均未接受放化疗、靶向及免疫治疗等。标本取材方法:于肿瘤组织内及癌旁组织(距肿瘤边缘≥0.5 cm)随机取样,大小约0.5 cm3。标本组织以福尔马林固定。
1.2 免疫组化法检测MYCBP含量应用兔抗人MYCBP检测试剂盒对肿瘤组织及癌旁组织行免疫组化(IHC)染色检查。采用免疫组化IRS(immunoreactive score)评分标准[2]判读染色结果,并对MYCBP作相对定量,比较两组标本IRS评分。取62例肿瘤组织样本,依据IRS评分中位数将患者分为MYCBP高含量组和低含量组,分析患者多个临床病理指标与MYCBP含量的关系;术后随访36个月,比较患者无病生存期(DFS)。
1.3 统计学分析采用SPSS 20.0统计软件分析数据,计量资料比较采用t检验,计数资料比较采用χ2检验,DFS分析采用Kaplan-Meier生存曲线法,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化法检测MYCBP含量肿瘤组织免疫组化IRS评分 (5.76±1.28)分,明显高于癌旁组织的 (2.63±0.61)分(t=17.46,P<0.05),即肿瘤组织MYCBP含量明显高于癌旁组织。见图1。
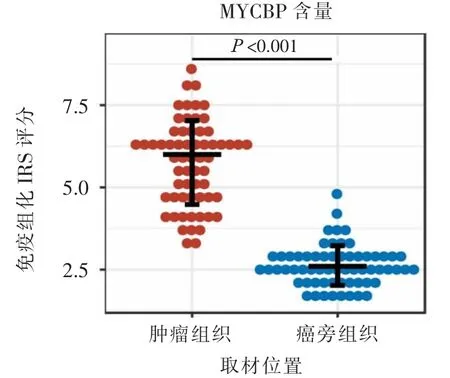
图1 肿瘤组织与癌旁组织MYCBP含量比较
2.2 MYCBP含量与临床病理特征及DFS的关系将患者分为MYCBP低含量组(n=32,I RS评分≤6分)和高含量组(n=30,IRS评分>6分)。MYCBP含量与患者病理分化程度、病灶数量、门静脉癌栓形成等临床病理特征相关(P<0.05)。见表1。MYCBP低含量组的术后中位DFS明显长于MYCBP高含量组 (26个月vs.17.8个月,P<0.05)。见图2。
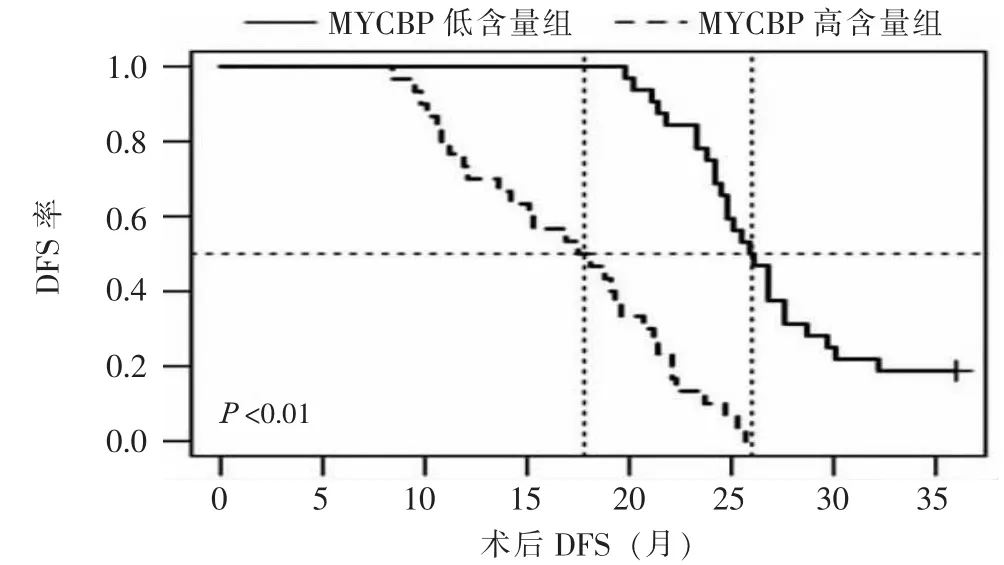
图2 MYCBP低含量组与高含量组患者的DFS比较
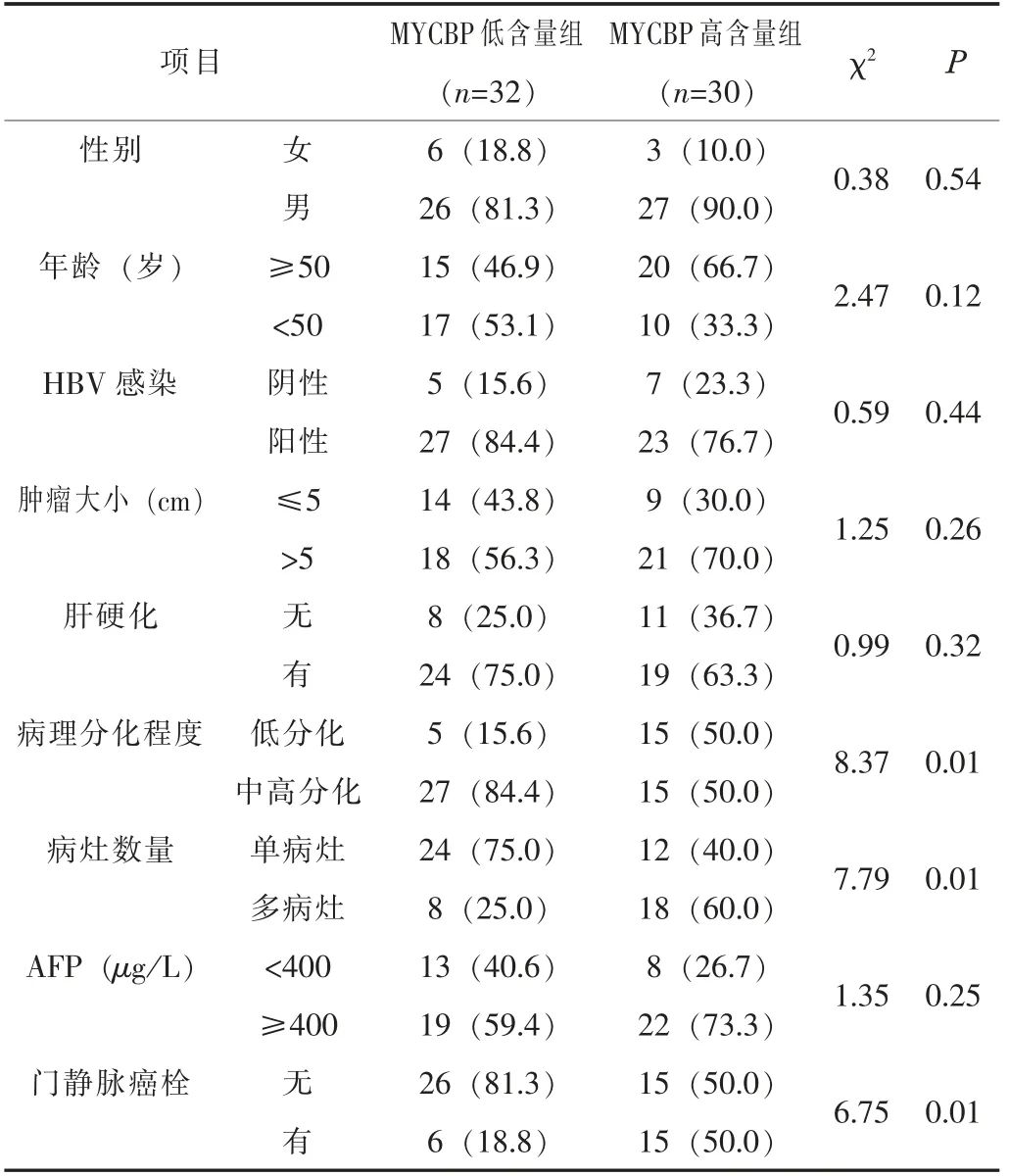
表1 MYCBP含量与患者临床病理特征的相关性[n(%)]
3 讨论
MYCBP是11 kDa的蛋白,具有与c-MYC癌基因结合并激活其转录的作用。研究[1,3-4]表明,MYCBP与肺癌、胃癌、乳腺癌及胶质瘤等肿瘤的发生及预后密切相关。本研究结果显示,肿瘤组织MYCBP含量明显高于癌旁组织,表明MYCBP在HCC中呈上调表达,提示MYCBP含量增加可能对HCC的发生及进展产生促进作用,与Zhu等[5]的研究结果基本相同,HCC中的MYCBP含量明显高于正常肝组织。相关研究[1,3-5]表明,MYCBP含量增加可提高c-MYC转录活性,促进c-MYC靶基因的表达,从而促使细胞发生恶变、侵袭及迁移等,故MYCBP在HCC中的含量高于癌旁肝组织。同时,MYCBP表达含量也受多种生物因子及物质的调节。
本研究结果显示MYCBP含量与HCC患者病理分化程度、病灶数量及门静脉癌栓形成等临床病理特征存在关联。病理分化程度越低、病灶数量越多、合并门静脉癌栓形成等因素使患者总体MYCBP含量偏高。一般而言,肿瘤病理分化程度越低,则恶性程度越高;病灶数量越多,提示多中心发病或早期发生周边转移的可能;门静脉癌栓形成则预示肿瘤具有较强的侵袭性[6]。该结果提示MYCBP含量与HCC的肿瘤生物学行为存在一定的相关性,HCC肿瘤恶性度越高,MYCBP含量也相对增加。本研究中,MYCBP低含量组的术后中位DFS明显长于MYCBP高含量组,也提示MYCBP与HCC的预后密切相关,即肿瘤MYCBP含量越高,外科手术预后有可能更差。
综上所述,MYCBP在HCC中含量增加,与某些临床病理指标及术后DFS存在关联,对HCC预后判断有一定临床意义。

