PD-1/PD-L1、TIM-3表达与食管癌临床病理特征及预后的关系*
刘 凯,刘 燕,黄 莉,刘 凯△
(新疆医科大学附属肿瘤医院:1.头颈综合放射治疗科;2.胸腹放射治疗科,乌鲁木齐 830011)
食管癌是世界范围内最常见的恶性肿瘤之一。2020年全球癌症报告显示,全球食管癌发病率居恶性肿瘤第8位,死亡率居恶性肿瘤第6位,食管鳞癌占所有食管癌的87.0%,且超过一半的病例发生在中国[1]。中国是食管癌高发国家之一,尽管目前食管癌的综合治疗有了很大进步,但患者的预后仍较差,高复发及远处转移风险是影响患者预后的主要原因[2]。一些重要的免疫检查点如PD-1/PD-L1信号通路、TIM-3已被证实在多种恶性肿瘤组织中异常表达,并与肿瘤进展、转移及预后密切相关,有可能成为肿瘤免疫学治疗的新基准[3-6],但其在食管癌方面的文献报道较少见。本研究分析了PD-1/PD-L1、TIM-3在癌组织、食管癌旁正常组织表达的生物学意义及其与患者一般临床病理特征和预后的关系,评价其在预测食管癌患者预后中的临床应用价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2008年1月1日至2012年12月31日本院收治的行根治性手术治疗的104例食管癌患者术后病理标本(包括癌组织和距离切缘大于5 cm的癌旁正常组织)作为研究对象。纳入标准:(1)符合2009年第7版美国联合癌症分类委员会/国际抗癌联盟诊断标准;(2)经病理检查确诊为食管鳞状细胞癌;(3)临床相关资料完整及石蜡标本保存完整;(4)相关检查排除多发性癌;(5)行食管癌根治术;(6)对本研究知情同意。排除标准:(1)曾进行过新辅助治疗;(2)初次确诊时即有转移;(3)合并第二恶性肿瘤。本研究通过医院医学伦理部门批准。
1.2 方法
应用链霉菌抗生物素蛋白-过氧化物酶连结(streptomyces avidin peroxidase link,SP)法进行免疫组织化学染色,检测癌组织及癌旁正常组织PD-1/PD-L1、TIM -3的表达。切片由2名有工作经验的病理科医师双盲独立观察结果,取二者均值纳入统计。
1.3 随访
采用定期复查、信件、电话随访等方式与患者或家属进行沟通随访。以患者病理诊断报告确诊为食管鳞状细胞癌的当月为随访初始月,以患者死亡为终末事件,随访截止日期为2014年12月31日。104例患者获随访6~71个月,中位随访24个月,失访0例,随访率为100%。无进展生存期(progression-free survival,PFS)指患者从接受治疗开始至观察到疾病进展或发生因任何原因死亡之间的这段时间。
1.4 统计学处理
2 结 果
2.1 PD-1、PD-L1、TIM-3表达情况
癌组织PD-1、PD-L1、TIM-3表达阳性例数均明显高于癌旁正常组织,见表1。

表1 癌组织和癌旁正常组织PD-1、PD-L1、TIM-3表达比较(n)
2.2 PD-1、PD-L1、TIM -3表达与临床病理特征的关系
肿瘤浸润程度越深、伴淋巴结转移者PD-L1、TIM-3表达水平越高,TIM-3也可能与肿瘤分化程度有关,见表2。

表2 PD-1、PD-L1、TIM-3表达与临床病理特征的关系(n)

续表2 PD-1、PD-L1、TIM-3表达与临床病理特征的关系(n)
2.3 生存和预后影响因素分析
104例患者中位PFS为10.95个月,其中随访满6、12、18个月PFS患者分别占80.8%、42.3%、3.8%。PD-1、TIM-3对患者中位PFS有影响,PD-L1对患者中位PFS无影响;肿瘤TNM分期、分化程度、病变部位对患者中位PFS有影响,其余项指标对患者中位PFS无影响,见图1~3。将有意义的影响因素纳入模型进行多因素分析,仅PD-1、TIM-3高表达,肿瘤分化程度是患者不良预后的独立因素,差异有统计学意义(P<0.05) 。PD-1、TIM-3高表达的食管鳞癌根治性术后患者中位PFS均低于PD-1阴性患者(OR=1.744、2.316),肿瘤高、中分化程度的食管鳞癌根治性术后患者中位PFS高于低分化程度患者(OR=2.183),见表3。

图1 PD-1、TIM-3表达对PFS的影响

图2 肿瘤TNM分期对PFS的影响

图3 肿瘤病变部位及分化程度对PFS的影响
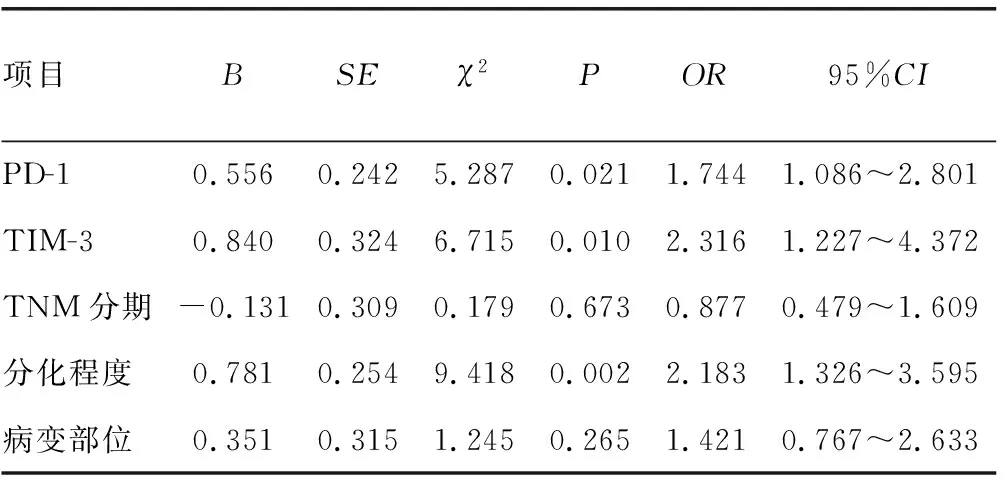
表3 影响食管鳞癌患者PFS的多因素分析
3 讨 论
由于PD-1/PD-L1通路在肿瘤免疫逃逸机制中具有重要作用,因此,目前对PD-1/PD-L1通路的免疫治疗成为研究热点。本研究结果显示,与癌旁组织比较,癌组织PD-1、PD-L1表达阳性例数均较高。国内有部分学者比较了食管癌组织和癌旁正常组织PD-1、PD-L1的表达情况,发现癌组织PD-1、PD-L1表达阳性率远高于癌旁正常组织,说明PD-1/PD-L1表达可能与肿瘤的发生有关[7-8]。本研究进一步分析了PD-1/PD-L1表达与患者临床病理因素的关系,结果显示,不同部位肿瘤组织PD-1表达阳性例数比较,差异有统计学意义(P<0.05),且PD-1表达与肿瘤分期相关,Ⅰ期食管癌患者PD-1阳性表达率相对较低,而研究未发现PD-L1的阳性表达与肿瘤部位相关,但随患者TNM分期程度增加、病变大于3 cm及发生淋巴结转移者PD-L1表达逐渐升高,与多项研究结果类似[8-10],提示PD-L1表达与肿瘤浸润深度有关。PD-1、PD-L1 可能会促进肿瘤的进展,并且结合2种蛋白的阳性表达情况,食管癌组织细胞膜、细胞核、细胞质均有PD-L1 表达,且表达水平与肿瘤浸润深度显著相关,而PD-1蛋白多局限于肿瘤浸润性淋巴细胞表达[7],推测PD-L1与食管肿瘤浸润深度的相关性更密切,而PD-1相关性可能不明显。
本研究对患者进行了随访,并分析了PD-1/PD-L1对患者PFS的影响,结果显示,PD-1表达阳性患者PFS 较阴性患者缩短(PD-1阳性9个月,PD-1阴性12.3个月)。多因素分析结果显示,PD-1表达是PFS 的独立影响因素,PD-1高表达的食管鳞癌根治性术后患者中位PFS低于PD-1阴性患者,而PD-L1与PFS的相关性不明显。目前,PD-1/PD-L1表达与患者预后的关系尚存有争议。有研究者表明,PD-1、PD-L1高表达与食管癌患者预后不良相关,然而有许多研究却发现,PD-L1高表达是患者预后良好的因素[11-12];但也有学者认为,肿瘤细胞PD-L1表达情况对患者预后无影响[13]。由于对食管癌的相关研究有限,本研究样本量较少,未来需扩大样本量进一步研究。
已证实TIM-3是抗肿瘤免疫的负性调控分子,大量研究证实,TIM-3不仅表达于多种肿瘤相关免疫细胞,并对细胞因子分泌具有重要的调节作用,而且直接表达于多种肿瘤细胞和组织[14]。本研究结果显示,食管癌组织TIM-3呈高表达,TIM-3表达强度与肿瘤分化程度、肿瘤浸润深度、淋巴结转移、TNM分期均具有明显的相关性,肿瘤高分化程度的患者TIM-3表达较中、低分化程度患者低,且随浸润程度越深、伴淋巴结转移和TNM分期越晚癌组织TIM-3表达水平逐步增高。本研究对TIM-3蛋白表达情况与患者PFS进行生存分析结果显示,TIM-3表达阳性患者PFS较阴性患者缩短(TIM-3阳性10.2个月,TIM-3阴性14.7个月);多因素分析结果显示,TIM-3表达是PFS 的独立预后因素,TIM-3高表达的食管鳞癌根治性术后患者中位PFS低于TIM-3阴性患者。提示TIM-3在一定程度上反映了肿瘤生长状态,并可能参与了食管癌的发生和发展。与以往TIM-3在其他肿瘤组织中的研究结果相仿。YUAN等[14]发现,TIM-3在肾透明细胞癌组织表达水平明显高于癌旁组织,且TIM-3表达与患者预后呈负相关,提示其可作为影响患者预后的一个独立因素。但TIM-3 在各种恶性肿瘤中的表达程度略不相同,部分表达也受其他外在因素的影响,且目前为止,TIM-3在食管癌中的研究尚少见,因此,仍需进一步探究。
目前,免疫治疗已成为肿瘤治疗新的研究热点,本研究大多数食管癌患者肿瘤组织PD-1/PD-L1、TIM-3表达阳性率较高,且表达效果与患者临床病理特征及预后存在一定相关性,这一结果为食管癌免疫治疗提供了参考依据。根据2021美国临床肿瘤学会食管癌诊疗最新进展的多项Ⅱ期临床试验结果显示,对可切除的食管鳞癌患者采用新辅助放化疗联合免疫治疗,完全缓解率达24.0%~43.0%,免疫抑制剂参与食管癌新辅助治疗及辅助治疗的前景令人期待,但其能否成为标准治疗方案仍需Ⅲ期临床试验的研究数据;且免疫治疗联合化疗可为晚期食管癌患者带来良好的近期疗效和生存获益,免疫治疗已成为晚期食管鳞癌治疗的新选择。

