降钙素基因相关肽对高氧肺损伤的Notch通路调控*
邓 健,王少华
(广东省深圳市福田区妇幼保健院儿科 518045)
氧疗是临床常用手段,但当早产儿肺组织长时间接受高氧时反而会引起高氧肺损伤,对其预后造成不同程度的影响[1]。降钙素基因相关肽(calcitonin gene-related peptide,CGRP) 为一类主要由感觉神经释放的生物活性神经肽类物质[2]。Notch通路是一条参与体内多种器官和组织调控的信号通路[3]。近年来,相关研究表明,CGRP和Notch通路均参与了肺损伤修复重建过程[4-5]。然而,对CGRP是否通过Notch通路调控高氧肺损伤的修复,目前国内相关研究仍较匮乏。本研究以SD早产鼠及其肺组织作为研究对象,通过比较在高氧暴露的不同时间点使用CGRP及其拮抗剂、Notch信号通路阻断剂干预后肺组织的病理改变,以及其中Notch信号的Notch l、Hes、heRP mRNA表达情况,以探讨CGRP是否通过调控Notch通路对肺组织发挥效应,从而为高氧肺损伤的防治提供参考。
1 材料与方法
1.1 材料
1.1.1实验动物及分组
每天下午将健康SD成年雄鼠和雌鼠(由深圳市拓普生物科技有限公司实验室购置)按1∶1比例合笼交配,次日清晨检查到雌鼠阴道涂片显示精子者定义为妊娠第0天。雌鼠妊娠第19天用乙醚麻醉后剖宫产取出胎仔作为研究对象。将胎龄19 d的SD早产鼠分为空气组(A组)、高氧组(B组)、高氧联合CGRP组(C组)、高氧和CGRP联合CGRP8-37组(D组)及高氧和CGRP联合MW167组(E组),每组至少18只,依次编为A~E组。CGRP8-37为CGRP拮抗剂,MW167为Notch信号通路阻断剂。
1.1.2主要试剂与仪器
主要试剂与仪器为CGRP(ANASPEC)、CGRP8-37 (Wurogentec)、MW167(millipore)、Notch-1 (ABclonal)、heRP(Biobyt)、Hes(Santa)、反转录试剂盒(全式金)、苏木精-伊红染色(hematoxylin eosin,HE)染色液(Servicebio)、荧光倒置显微镜(Mshot)等。
1.2 方法
1.2.1制备动物模型
参照梁木林等[6]介绍的方法制备高氧动物模型。同时对各组早产鼠腹腔注射干预试剂,A、B组均为生理盐水,C~E组分别为CGRP、CGRP联合CGRP8-37、CGRP联合MW167。注射完毕后约1 h将早产鼠给近期正常分娩的母鼠哺乳。除A组外,B~E组代乳鼠和未成熟鼠均放置在95%高氧容器中,定时添增水和饲料,持续14 d 。
1.2.2肺组织标本制备及病理检查
哺乳期第3、7、14 天每组处死6只早产鼠并取出肺组织保存于-80 ℃液氮快速冷冻。常规切片、HE染色,光镜下观察肺组织病理改变。采用BAUMAN等[7]介绍的肺组织损伤评分法评估其病理改变。
1.2.3定量实时聚合酶链反应(Q-PCR)法检测肺组织 Notch 1、Hes、heRP mRNA表达水平
提取总RNA逆转录合成cDNA进行扩增。反应条件:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火延伸34 s,共40个循环。
1.3 统计学处理
2 结 果
2.1 肺组织病理改变
A组早产鼠肺组织气管、血管正常。B、D、E组早产鼠第3天可见炎症细胞浸润;第7天可见肺泡上皮细胞肿胀,间质水肿;第14天气管、血管广泛破坏,管壁增厚。C组早产鼠第3天大致正常,第7天肺泡间隔少许断裂,第14天肺泡融合,肺泡内充满渗出液,见图1。
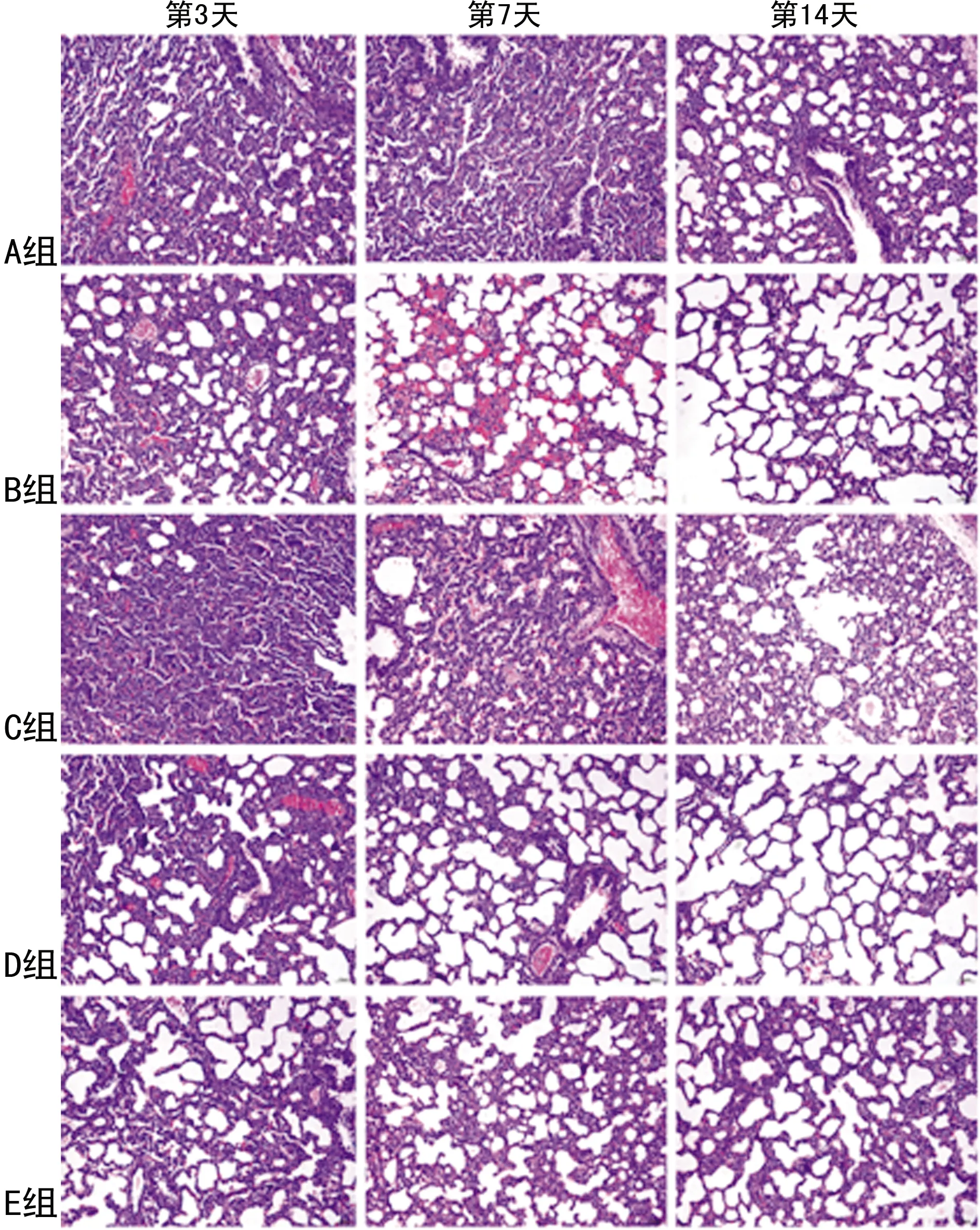
图1 各组早产鼠不同时间点肺组织病理改变比较(HE染色,200×)
2.2 肺损伤病理评分
C组早产鼠第3、7、14天肺损伤病理评分均低于B、D、E组,差异均有统计学意义(P<0.05),见表1。

表1 各组早产鼠不同时间点肺损伤病理评分比较分)
2.3 肺组织Notch 1、Hes、heRP mRNA表达水平
C组早产鼠第3、7、14天Notch 1、Hes、heRP mRNA表达水平均明显高于B、D、E组,差异均有统计学意义(P<0.05),见表2。

表2 各组早产鼠不同时间点肺组织Notch 1、Hes、heRP mRNA表达水平比较
3 讨 论
CGRP由37 个氨基酸组成,是人类用分子生物学方法发现的第1个活性多肽,广泛分布于神经系统、呼吸系统、循环系统等,生物半衰期约为18 min[8]。近年来,有研究表明,人和鼠肺泡Ⅱ型上皮细胞(typealⅡ veolarepithelial cell,AECⅡ)膜上也发现了CGRP特异性受体及结合位点,并在胚胎肺的发育和肺生理、病理过程均发挥了重要作用[9]。当不成熟肺受到氧化应激后CGRP通过免疫调节加快清除自由基,减少合成及释放炎症因子,并促进水通道蛋白过表达而减轻肺水肿,从而对机体起到抗炎、抗氧化损伤等作用。此外,在氧化应激的条件下AECⅡ增殖受到抑制,而CGRP可减弱该抑制作用,促进细胞转化为AECⅡ,减少功能细胞凋亡并改善其存活,可能是CGRP促进高氧肺损伤修复的关键[10]。
Notch通路是一条进化上高度保守的信号通路[11]。Notch信号可介导转录因子的表达,由此实现调控肺泡上皮细胞和血管内皮细胞的生物学活动,如分化、增殖、凋亡等[12-13]。因此,Notch信号通路在肺的发育、损伤及修复过程中发挥着十分重要的作用。Notch信号包括Notch受体、配体、细胞内效应分子蛋白和调节分子等[14]。目前,在哺乳动物中发现的Notch受体有4种(Notch 1~4) ,均广泛分布于肺组织中。气道上皮细胞主要表达Notch 1、4,肺泡上皮、肺间质、血管内皮及成纤维细胞主要表达Notch 2、3。Notch 1与配体结合可启动靶基因Hes、Su(H)转录,促进AECⅡ增殖。在氧化应激条件下血管内皮细胞、气道和肺泡上皮细胞Notch 1活性下降,表达减少,AECⅡ转化为AECⅠ,最终影响肺发育和肺损伤修复[15]。
本研究结果显示,早产鼠在高氧暴露后肺组织结构破坏,炎性渗出,间质水肿,成纤维细胞增生,与此同时,Notch l及其下游靶基因Hes、heRP mRNA表达均下降。给予外源性CGRP干预后早产鼠肺组织病理损伤程度明显减轻,Notch信号上升。当分别加入CGRP受体拮抗剂——CGRP8-37和Notch信号通路抑制剂——MW167时肺损伤程度加重,Notch信号下降。由此可见,CGRP可能通过促进Notch通路中Notch 1、Hes、heRP等生物信号的表达,从而对氧化应激性损伤的肺发挥保护效应。今后应从信号传导通路方面阐释CGRP如何实现Notch信号下游靶分子的调控,可能对高氧肺损伤的预防和治疗产生深远意义。

