1例EBUS-TBNA引起结核性肉芽肿临床报道
王子君 魏光 何明恒 厉银平
支气管内超声引导下经支气管针吸活检(EBUS-TBNA)是将超声与传统支气管镜相结合,逐步取代了传统的经支气管镜盲穿及纵隔镜检查,成为肺内外恶性肿瘤、纵隔、肺门肿大淋巴结的病理组织学诊断的首选检查手段[1-2]。自2003年EBUS-TBNA问世以来,最常见并发症报道[3-5]有少许出血,其它的如一过性心律失常、低氧、纵隔感染、纵隔气肿、炎性息肉等并发症也偶有报道,其中EBUS-TBNA引起的穿刺处炎性息肉,国内外仅有数例报道,我科今发现1例行EBUS-TBNA后出现结核性炎性息肉的并发症,现报道如下。
病历资料
患者,女,70岁,因“咳嗽两周”于2020年9月2日收入我科,患者主要症状为干咳,未诉发热、咯血、喘气等不适。既往有高血压和糖尿病病史。入院实验室检查:血常规、血生化、癌胚抗原、痰抗酸染色、自免全套、C12肿瘤标志物、ANCA抗体、ACE均正常, T-spot阳性。胸部CT平扫及增强示:1.纵隔及双肺门淋巴结肿大;2.双肺纤维灶及多发结节,部分钙化;3.双侧胸腔少量积液。全身PET-CT提示纵隔及双肺门多发肿大淋巴结,代谢增高,考虑炎性病变,余全身未见恶性肿瘤性病变。于9月10日行气管镜及EBUS-TBNA检查,常规气管镜下未见明显异常,于4R区及7区淋巴结进行穿刺活检,穿刺结果显示主要为血细胞,少许炎症细胞及纤维结缔组织伴坏死及碳末沉积,未见肉芽肿形成,未见肿瘤细胞。穿刺样本结核分枝杆菌核酸检测结果为阳性。最后综合上述检查结果诊断为“纵隔淋巴结结核”,出院后给予异烟肼、吡嗪酰胺片、利福喷丁胶囊、乙胺丁醇抗结核治疗。于11月15日患者又因“咳嗽加重一周伴痰中带血、气短”来门诊复诊:纵隔及双肺门见淋巴结肿大,气管下段隆突上、双侧左右主支气管可见软组织结节影突入腔内。11月20日支气管镜(图1~3)提示:气管下段、左主支气管及右主支气管开口处肿物,肿物表面呈暗红色和黑色,堵塞大部分管腔。气管下段及左右主支气管内肿物予以活检,活检病理报告示:慢性肉芽肿性炎症,免疫组化染色:PCK(未见异常上皮分布),PAS(-),抗酸染色(-),但活检标本PCR荧光探针法结核分枝杆菌核酸(TB-DNA)检测结果阳性(湖南圣湘生物科技有限公司)。结合病史、病理资料,考虑管腔内新生物为穿刺后纵隔淋巴结结核破溃入气道形成结核性肉芽肿。治疗上在抗感染、化痰、平喘、抗结核、控制血糖基础上先后两次在气管镜下给予下圈套、激光治疗,患者症状好转后于12月24日出院继续口服抗结核治疗,因患者无明显喘气症状,正值年前患者未同意再次行介入治疗,嘱继续口服抗结核治疗后随访。于2021年3月15日患者来门诊复诊诉咳嗽明显,活动后有气短,遂入院于3月23日复查气管镜(图4~7)见原隆突上新生物治疗后消失,仅有炭末沉着;左右主支气管内侧壁各见已约5 mm大新生物,表面呈黑色和暗红色,较2020年11月20日稍缩小,活检后分别给予氩气结合冷冻治疗,活检病理报告为慢性炎症,X-pert检测阴性,症状好转后出院随访。
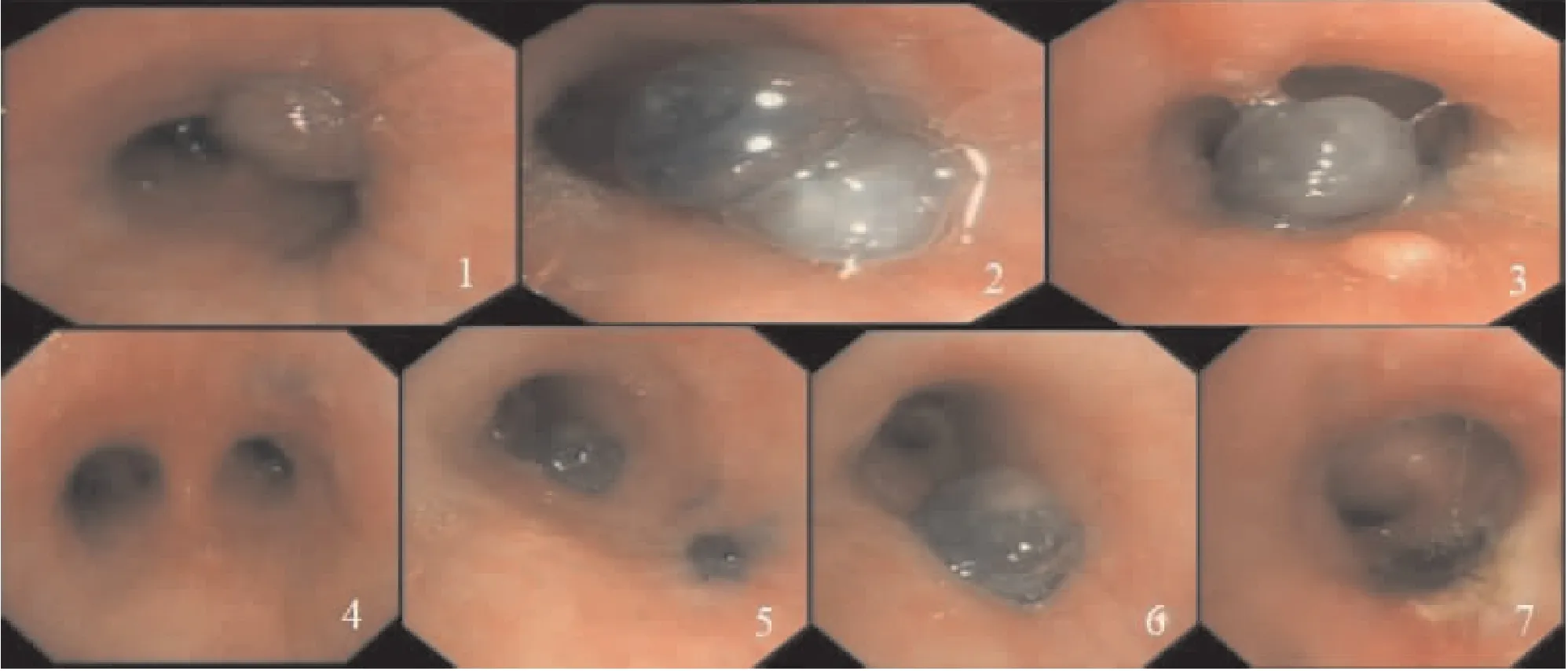
图1 气管镜见隆突4R穿刺处半球形息肉样新生物;图2 左主支气管7组淋巴结穿刺处两个黑色半球形新生物;图3 右主支气管7组淋巴结穿刺处见新生物;图4 3.23复查气管镜见隆突处仅见炭末正常;图5 3.23气管镜下见左主支气管内侧壁新生物;图6 3.23气管镜下见右主支气管内侧壁新生物;图7 3.23新生物氩气治疗后
讨 论
超声支气管镜自2008年首次引入我国,因其微创性、实时可视性以及高准确率,安全性好的优点被广泛运用于肺门及纵隔病变的检查,并发症的报道均较少,不过随着开展例数的增多,一些少见的并发症如炎性息肉并也偶有报道。2010年韩国Gupta等[6]首先报道经EBUS-TBNA诊断后的纵隔淋巴结结核患者2个月后右主支气管侧壁近隆突处新生肉芽结节病灶,活检后病理诊断为肉芽肿性炎症。2018年国内罗莉等[7]也报道了3例行EBUS-TBNA后出现炎性息肉的并发症。该患者行EBUS-TBNA确诊为纵隔淋巴结结核1个月后出现咳嗽气短,
复查胸部CT、气管镜见三处穿刺点均出现新生物,活检病理证实为肉芽肿性炎症,活检标本PCR荧光探针法,结核分枝杆菌核酸(TB-DNA)检测结果阳性,结合患者的临床表现及病理资料考虑这种炎性息肉为结核性肉芽肿。据报道结核性淋巴结炎患者并发引流窦的患病率估计为2%~23%[8],这种并发症的出现可能为穿刺的部位、次数、病变大小有关。目前穿刺后炎性息肉形成的具体原因不是很明确,Samter[9]提出了炎性息肉的进展过程:一系列的损伤包括创伤、二次感染、易感细菌或其他药物导致了毛细血管渗透性增加、炎性细胞的浸入进而造成血管充血和组织水肿,由此产生的压力推动黏膜形成褶皱和突起,形成大量粘液疝。该例患者也有可能是EBUS-TBNA直接导致淋巴结结核破溃入气道形成的结核性淋巴结瘘型。淋巴结瘘型又分为破溃前期、破溃期、破溃后期,该患者支气管镜下表现为破溃前期(局部支气管因淋巴结结核外压、侵袭导致的黏膜充血、水肿、粗糙及管腔狭窄)[10],结核分枝杆菌在淋巴结中的繁殖伴随着迟发型超敏反应,淋巴结中心的炎症导致淋巴结肿胀和变暗。淋巴结中心变软,干酪样物质会破裂进入周围组织,且在开始抗结核治疗后,免疫反应变得更加强烈,此时由于EBUS-TBNA穿刺时是在纵隔淋巴结中有一个引流通道,穿刺部位黏膜的完整性破坏,支气管黏膜启动修复程序,导致息肉形成,穿刺针有可能将淋巴结中的干酪样坏死物或结核分枝杆菌沿穿刺部位带出,同时受侵犯的淋巴结出现肿大、液化坏死时,出现张力升高的情况,穿刺后淋巴结包膜完整性破坏,使张力有释放的可能,多种因素促进局部瘘口的形成,最终形成结核性林巴结瘘[11]。另外该患者有糖尿病也可能是促进因素。因此对考虑纵隔淋巴结结核的患者实施EBUS-TBNA检查时,可以结合快速现场评价(ROSE)技术在明确诊断的前提下尽量选择直径较小的穿刺针,减少穿刺次数,结合支气管镜下超声及术前增强影像避免选择液化坏死处进行穿刺,从而减少淋巴结内物质溢出的风险,进而减少因EBUS-TBNA并发结核性肉芽肿的概率。
患者在行EBUS-TBNA检查后出现炎性息肉的时间并不一致,术后若出现气短或持续性咳嗽,应及时行支气管镜检查明确,当炎性息肉的增生使患者出现干咳、胸闷等症状,导致支气管狭窄,影响患者通气功能时,可在抗结核治疗基础上经支气管镜下行钳夹、热消融、冷冻以及联合药物灌注等治疗清除炎性息肉[6,12]。

