外泌体作为诊断肺癌的标志物的研究现状
陆秋琴 张琳琳 贾维
肺癌目前居全球范围内癌症死因的首位,占总癌症死亡的25%;其5年生存率相当低,不到20%[1-2]。目前临床中诊断肺癌的辅助检查有多种方法:X线、低剂量螺旋CT、胸腔穿刺活检、支气管镜检查、痰脱落细胞学检查及PET-CT等。尽管CT的敏感性高但其特异性仍比较低,会造成较高的假阳性[3];而胸腔穿刺活检并不是对每个患者都适用,其发生严重并发症的风险高达15%[4];由此可见,这些辅助检查尚未能满足临床的需求。手术是目前治疗肺癌预后最佳的手段,但大多数肺癌患者被确诊时已是晚期,错过了手术的最佳时机,可供选择的治疗方案相当有限,导致了晚期肺癌患者的5年生存率只有4%[1]。因此,亟须找出一种具有特异性的标志物来辅助肺癌的诊断。
外泌体是一种由肿瘤细胞(tumor cell, TC)、免疫细胞、干细胞和神经细胞等多种细胞分泌的纳米级的细胞外囊泡(extracellular vesicles,EVs)。它可以通过在邻近细胞间或远处受体细胞间传递蛋白分子、DNA、miRNAs这些物质来转导信号,从而对细胞间的通讯起着重要的调控作用[2]。许多研究(见表1、2)证明了外泌体所含的蛋白及核酸有望成为诊断肺癌的可靠标志物,它的稳定性[5]和特异性[6]为其奠定了坚实的基础。因此,本文旨在对近年来外泌体在诊断肺癌方面的研究现状进行综述。

表1 外泌体蛋白作为肺癌标志物
外泌体的概述
外泌体是1983年Johnstone 等在研究绵羊网织红细胞成熟和分化的过程中发现的一种微小囊泡,随后将其命名“exosome”,它是一种直径为30-150nm的“茶托状”扁平球体[7-9]。肿瘤细胞、免疫细胞、干细胞和神经细胞等多种细胞均能产生外泌体。它通过细胞的內吞作用和出芽形成[8],存在于血液、尿液、胸腔积液以及唾液、腹水、脑脊液等各种体液中。目前提取外泌体的方法有:聚合物沉淀法、超速离心法、过滤离心法、尺寸排阻色谱法、免疫磁珠法等。外泌体由多种蛋白质,核酸,脂质等生物大分子构成,具有脂质双层膜结构。它作为细胞间的通讯工具,主要通过以下三种方式介导细胞间的交流[2,10-11](见图1):第一,外泌体通过特异性表面分子与靶细胞进行识别并融合,即受体-配体的相互作用将其内所含的物质释放至靶细胞,从而调节受体细胞的转录;第二,外泌体与靶细胞的细胞膜融合使内容物释放到靶细胞的细胞质中,从而实现分子之间的转运;第三,通过类似胞吞作用的机制传递信息到靶细胞。外泌体的特异性及靶细胞摄取外泌体的不同方式使其在细胞间通讯中的功能复杂化,目前尚不清楚不同的方式是否会造成外泌体的定位、降解或功能的差异[2]。
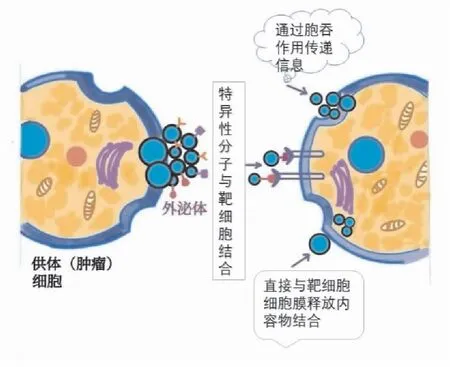
图1 外泌体介导细胞间通讯的三种方式
外泌体在肿瘤中的作用
目前研究表明了癌细胞分泌的外泌体远比正常细胞分泌的多,它能够调制肿瘤微环境(tumor microenvironment, TME)以促进肿瘤的发生发展、侵袭转移、血管生成、免疫逃逸等过程[12-13];还可作为抗肿瘤药物的有效载体,也可介导抗肿瘤药物的耐受性[10](见图2)。肺癌的发生与发展与肿瘤微环境之间复杂的相互作用息息相关。肿瘤微环境是肿瘤细胞赖以生存的内环境,由肿瘤相关成纤维细胞,干细胞,神经细胞,免疫细胞等及细胞外基质和物理因素如缺氧等组成。缺氧是TME的前提。Zhang等[14]的研究表明,缺氧的骨髓间充质干细胞分泌的外泌体通过STAT3诱导上皮-间质转化(epithelial-mesenchymal transition, EMT)极大地提高了肿瘤细胞的侵袭力,促进了肿瘤的转移。此外,肺癌细胞分泌的外泌体中的miRNAs可在肿瘤细胞间传递遗传信息,且其内含的蛋白质可以直接激活宿主细胞中的信号转导,从而促进肺癌细胞的生长和增殖。研究[15]发现,外泌体 miR-1260b通过抑制分泌型卷曲相关蛋白(secreted frizzled related protein 1, sFRP1)和Smad4蛋白(drosophila mothers against decapentaplegic protein)来调节Wnt/β-catenin信号通路从而促进肺癌细胞A549的侵袭转移。外泌体还可以通过刺激肿瘤血管生成来促使肿瘤的发展。相关研究表明,肺癌来源的外泌体的miR-210,可以通过激活JAK2/STAT3信号通路上调基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、FGF2和血管内皮生长因子(vascular endothelial growth factor, VEGF)等促血管生成因子的表达从而促进肺癌血管的生成[16]。在肺部TME中,肿瘤来源的外泌体携带免疫抑制分子,并将这些分子转移到免疫细胞使之受到抑制。树突状细胞(dendritic cell, DC)可以捕获这些外泌体分化为耐受DC,使原始的CD4+T细胞转化为肿瘤抗原特异性调节性T细胞,从而抑制肿瘤特异性CD8+T细胞的功能,以促进肿瘤进展[12]。实验还证明了外泌体是一种理想的药物载体,Akhil等[17]的研究表明由外泌体介导的阿霉素传递,对TC表现出优先的细胞毒作用,减低了正常组织的毒性且疗效更佳。肿瘤来源的外泌体可以介导抗肿瘤治疗的抵抗,其机制尚未明了。EGFR突变的TC通过内吞作用将外泌体内化,进而激活PI3K/AKT和MAPK信号通路下游的外泌体野生型EGFR蛋白,从而引起对奥希替尼的耐药性[18]。Li等[19]的实验表明,exo-miR-613通过下调TC中的GJA1、TBP和eIF-4E的表达从而逆转了NSCLC细胞对顺铂的耐药性。外由此可见,外泌体的相关研究将为肺癌的诊断与治疗带来新希望。
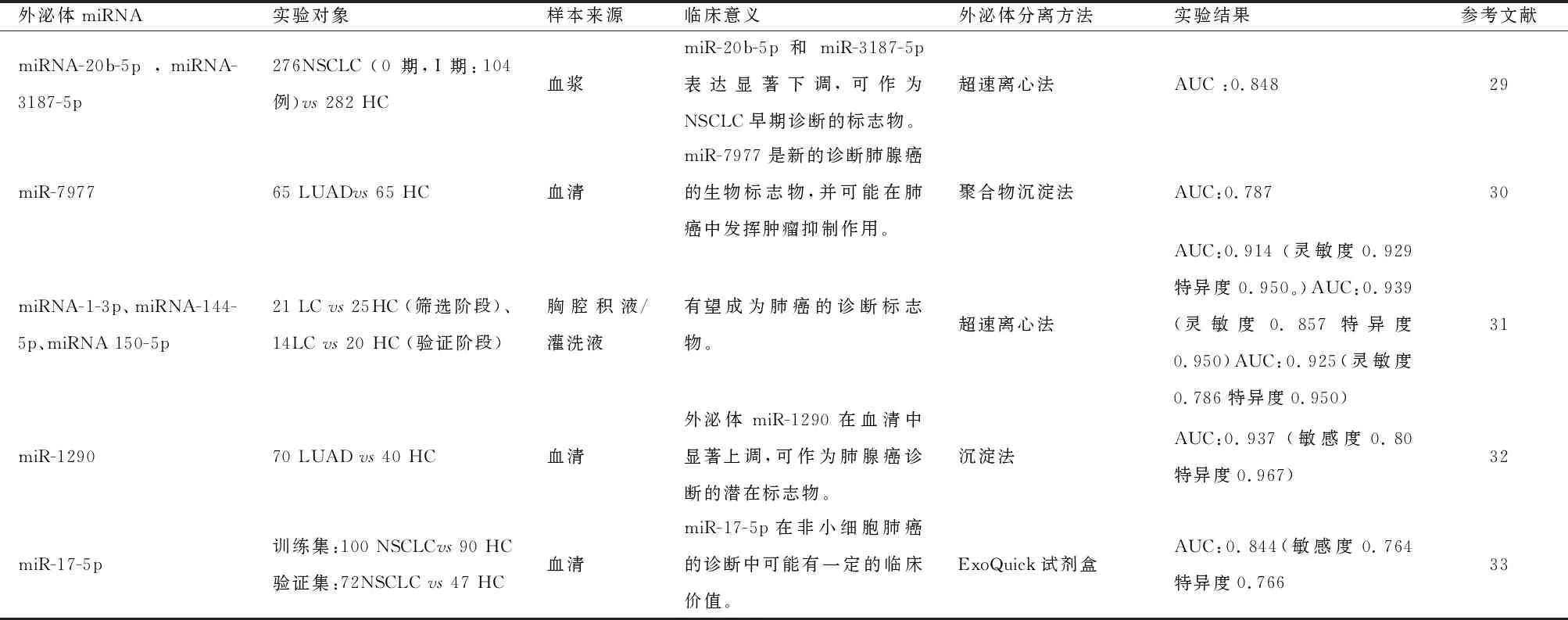
表2 外泌体miRNA作为肺癌标志物
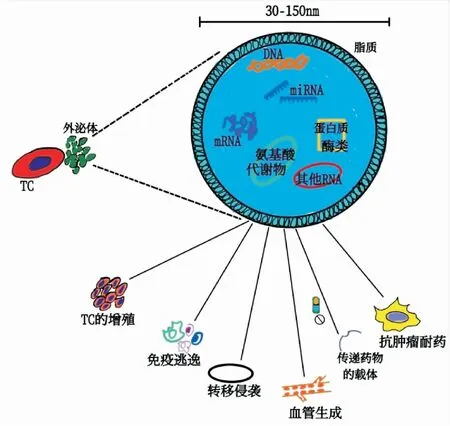
图2 外泌体在肿瘤中的作用.即能促进肿瘤细胞的增殖、侵袭迁移、血管生成、免疫逃逸等;可作为抗肿瘤药物的有效载体,也可介导抗肿瘤耐药。
外泌体作为诊断肺癌的标志物
一、外泌体中蛋白质作为肺癌标志物
近年来许多研究表明外泌体中含有大量蛋白质,且外泌体蛋白参与肺癌的发生发展的各个环节,因此具有成为新的诊断肺癌工具的巨大潜力。Sandfeld-Paulsen等[3]采用细胞外囊泡阵列芯片对580例患者(431 例肺癌患者和150 例对照者)分离出的血浆外泌体蛋白的表达情况,发现CD151、CD171 和 TSPAN8 这三种外泌体蛋白在肺癌中的高表达,区分了肺癌患者与非肺癌患者且能区分肺癌的各组织亚型;其中CD151对肺癌的诊断价值最大,受试者工作特征曲线(receiver operating characteristic curve, ROC)下方的面积(Area Under Curve, AUC)为0.68;三者联合检测特异性更高,AUC值为0.938。Niu等[20]采用超速离心法将46例健康对照者和125例非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的血清分离出外泌体,再用质谱法对这两组外泌体进行蛋白质组学分析,发现NSCLC患者的外泌体中α-2-HS-糖蛋白(alpha2-HS-glycoprotein, AHSG)和细胞外基质蛋白1(extracellular matrix 1, ECM1)的表达水平明显高于健康对照组。AHSG对NSCLC的诊断价值最大,AUC为0.736(P<0.0001);AHSG、ECM1与癌胚抗原结合诊断NSCLC,AUC值为0.938,对诊断NSCLC具有巨大的潜力。Sun等[21]的研究表明了唾液EVs含有信息丰富的蛋白质,利用质谱法对正常人和肺癌患者唾液EVs蛋白图谱进行了系统比较。选其中6种相关外泌体蛋白彻底鉴定后,发现四种外泌体蛋白(BPIFA1、CRNN、MUC5B和IQGAP)具有肿瘤特异性,可用于检测肺癌。探究体液中循环中外泌体的蛋白质组学差异,将为癌症诊断的特异性和敏感性方面开辟新的领域。
二、外泌体miRNAs作为肺癌标志物
miRNA是一种短的单链非编码RNA,通过促进靶mRNA的切割或抑制其翻译在转录后水平调节基因表达[8]。相关研究已经证明了外泌体miRNAs在介导肿瘤的发生发展中扮演着重要的角色。且外泌体的结构是其成为标志物的重要因素,它的双层脂质结构,包裹着miRNAs使其不被酶解,稳定携带细胞来源的各种生物活性物质在体液中循环。因此,它们能够成为肿瘤的诊断标志物。Sun等[5]对72 例肺癌患者和72例健康者,采用实时荧光定量聚合酶链式反应,来检测血清中外泌体miR-106b在NSCLC细胞系SPC-A-1、H 358、A 549和H 1229以及正常肺上皮细胞系Beas-2B中的表达,结果显示肺癌患者和癌细胞系中血清外泌体miR-106b显著升高。Han等[22]通过从56例LLC和40例HC的血浆外泌体中的 14 个miRNAs 的表达进行了比较,结果显示,患者的循环外体miR-342-5p和miR-574-5p的表达显著高于健康对照者,AUC值分别为0.733,0.780。因此循环外体miR-342-5p和miR-574-5p有可能作为早期肺腺癌的新的诊断生物标志物。研究[23]发现,NSCLC患者血浆中分离的外泌体中,miR-619-5p的表达高于正常,血浆外泌体miR-619-5p的表达,抑制了靶点RCAN1.4从而了促进NSCLC的生长和转移。这些 miRNAs 具有诊断的肺癌的高敏感性及特异性,有望成为辅助诊断筛查肺癌的生物标志物。
三、外泌体DNA作为肺癌的生物标志物
目前从NSCLC细胞的外泌体双链DNA(double-stranded DNA, dsDNA)中成功检测EGFR突变,以及肺癌中的KRAS和p53突变,这使得外泌体中分离出的dsDNA作为诊断标记物将为肺癌的诊断开辟新的可能性。然而目前还未研发出能从人体中分离外泌体dsDNA的技术[24]。虽然肿瘤外泌体DNA检测在肺癌的诊断中起着至关重要的作用,但测序仪器的可及性、数据分析和高昂的成本都是目前无法解决的限制因素。
结 语
随着当代医疗技术的不断发展,液体活检正在成为诊断肺癌的微创方法,外泌体的发现和研究为肺癌的早期诊断开辟了新的途径。外泌体作为无创或微创的肺癌标志物,可降低一些有创活检引起的病情恶化风险,而且有望能有效延长患者生存期。然而要实现将外泌体领域的研究转化为未来的临床实践,我们仍面临着一些问题:首先是对外泌体在肺癌中的作用的进一步研究,以及靶细胞摄取外泌体的不同的方式,是否会导致外泌体不同的定位、降解或功能,以更好地阐明它们的作用及其作用机制;其次,解决外泌体的分离纯化技术问题及寻找外泌体的靶基因;再次,目前外泌体作为标志物的研究仍缺乏大量临床样本验证其有效性等问题。只有解决这些问题,外泌体才能够广泛应用于临床。总而言之,外泌体的研究有着广阔的前景,基于外泌体与肺癌的研究,有望能研发出可应用于临床的肺癌诊断标志物,以达到提高肺癌患者5年生存率,延长肺癌患者生存时间的目的,造福更多的患者。

