铁盐对海带雌配子体生长发育的影响
赛珊 赵楠 王伟伟 罗世菊 李晓捷
(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻与海参技术创新中心,山东省海藻遗传育种与栽培技术重点实验室,山东烟台 264003)
海带(Saccharinajaponica)是重要的大型海水经济藻类之一。海带的生活史具有明显的异形世代交替,即孢子体与配子体世代交替[1-6]。目前,海带的人工繁育方式主要有两种:一种是选取具有明显优势的成熟孢子体作为亲本进行选择育种;另一种是利用海带配子体克隆进行育苗。后一种方法具有操作简单、品种纯度高、繁育效率高等优点[7-12]。海带配子体克隆培养方式主要是液体保存,其中影响配子体克隆生长发育的主要因素是温度、光照强度和营养盐等,无机氮与磷的比例以及一些植物生长促进剂和微量元素也对配子体的生长和发育具有非常重要的作用[13-27],其中铁元素对海藻的光合作用、呼吸作用以及一些代谢行为有重要的影响[28-29]。
在海带配子体的日常保种过程中,培养液中需要加氮和磷这两种营养盐。缺少氮盐会导致生长缓慢,缺少磷盐会导致生长发育不良,而添加铁盐能促进海带配子体对氮和磷两种营养盐的吸收[30]。刘德厚等[31]的研究表明,铁盐对海带配子体的生长发育有较大的影响。
为探究铁盐对不同品种(系)海带雌配子体的影响,本研究通过添加不同质量浓度Fe3+,对在低温弱光和高温强光条件下培养的“901”、韩国海带和“连杂1号”3个品种(系)海带雌配子体的生长发育情况进行了观察。
1 材料和方法
1.1 试验材料
选取实验室种质库分别保存在低温弱光[(10.0±1.0)℃、2 μmol/(m2·s),L]和高温强光[(15.0±1.0)℃、80 μmol/(m2·s),H]条件下状态良好的“901”(经国家审定的海带品种)、韩国海带(采自韩国的海带地理种群)和“连杂1号”雌配子体克隆系。培养液为加热煮沸的消毒海水,添加质量浓度分别为10、1 mg/L的NaNO3-N、KH2PO4-P。
1.2 试验药品
柠檬酸铁为分析纯,上海埃彼化学试剂有限公司生产。
1.3 试验方法
1.3.1 试验材料预处理
将海带雌配子体克隆用循环泵气动打散,其滤液经400目(孔径38 μm)筛绢过滤后,取适量滤液于直径为9 cm的培养皿中。在显微镜(10×16倍)下镜检打散的配子体,以平均每段3~4个细胞、每个视野有4~5个配子体段为宜。将培养皿放置在低温弱光[10 ℃,≤2 μmol/(m2·s)]条件下静置1周,使配子体段附着,便于计数。
1.3.2 正式试验
试验设置0、0.5、1.0、1.5 mg/L等4种Fe3+质量浓度,光照周期为10 L∶14 D。分别选取保存在低温弱光[(10.0±1.0)℃、2 μmol/(m2·s),L]和高温强光[(15.0±1.0)℃、80 μmol/(m2·s),H]条件下的试验材料,放在(10.0±1.0)℃、20 μmol/(m2·s)的培养箱中培养,每个试验组设3个平行。试验持续1个月,前10 d每2 d镜检1次,统计配子体段的细胞数,之后每4 d镜检1次,拍照观测配子体的生长状态。按照以下公式计算相对生长率(RGR,%/d)和配子体排卵比率(%)。
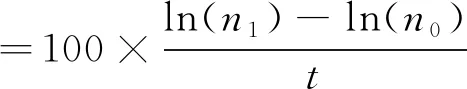
(1)
配子体排卵比率=100×排卵细胞数/(排卵细胞数+未排卵细胞数)
(2)
式(1)中,n0为初始配子体段细胞数,n1为试验结束时配子体段细胞数,t为试验天数(d)。
1.4 数据处理
采用EXCEL 2013整理试验数据,利用SPSS 25.0进行单因素方差分析(one-way ANOVA),用Tukey HSD方法进行均值多重比较,结果均以“平均值±标准差”表示,设显著性水平为0.05。
2 结果
2.1 铁盐对海带雌配子体相对生长率和排卵比率的影响
从图1-a可以看出,“901”(L)在Fe3+质量浓度为0时,培养时间越长,配子体段细胞数越多。当Fe3+质量浓度分别为0.5、1.0、1.5 mg/L时,试验前8 d,配子体段的细胞数随着培养天数的增加而增多。在第8天,Fe3+质量浓度为1.5 mg/L组的配子体段细胞数最多,由4个增加到18个,相对生长率为22.72 %/d。第10天,由于部分细胞开始排卵,造成配子体段细胞数呈现负增长。从图1-b可以看出,“901”(H)在试验开始后的前6 d,4个Fe3+质量浓度组的配子体段细胞数均增多了。第6天,Fe3+质量浓度为1.5 mg/L组的配子体段的细胞数最多,由4个增加到16个,相对生长率为20.26%/d。在第10天,配子体段细胞数出现负增长。“901”(L)在试验开始后的第4天,Fe3+质量浓度为0、0.5 mg/L的试验组,其配子体段的细胞数显著低于1.0、1.5 mg/L组(P<0.05),第8天,Fe3+质量浓度为0 mg/L的组显著低于其他组(P<0.05)。“901”(H)在试验开始后的第6天,0 mg/L组配子体段的细胞数显著低于1.0、1.5 mg/L组(P<0.05),第10天,各组间没有显著性差异(P>0.05)。
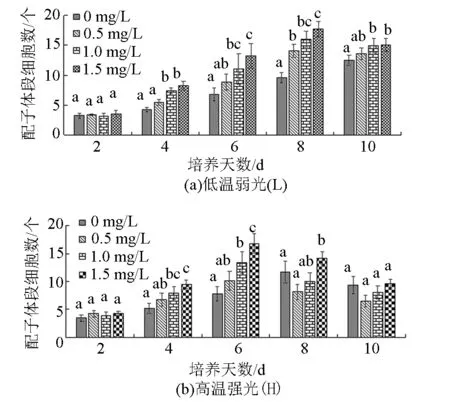
注:柱状图上方不同字母表示同一时间不同Fe3+质量浓度组间有显著性差异(P<0.05),相同字母表示无显著性差异(P>0.05)。
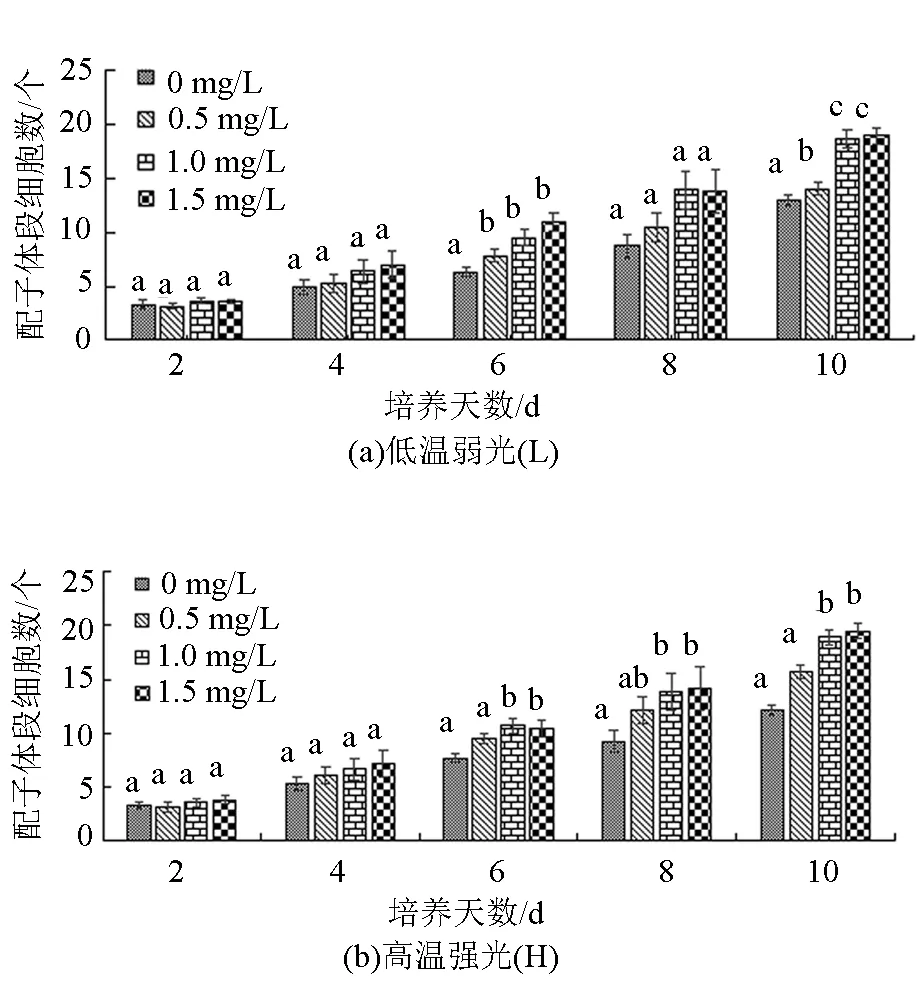
从图2和图3可以看出,在试验过程中,韩国海带(L)、(H)和“连杂1号”(L)、(H)均呈现培养时间越长,Fe3+质量浓度越高,配子体段细胞数增加越多的趋势,且均在第10天,当Fe3+质量浓度为1.5 mg/L时,配子体段的细胞数最多。韩国海带(L)配子体段细胞数由3个增加到20个,相对生长率为18.26%/d;韩国海带(H)由3个增加到24个,相对生长率为20.64%/d。“连杂1号”(L)由3个增加到18个,相对生长率为16.18%/d;“连杂1号”(H)由3个增加到19个,相对生长率为16.68%/d。韩国海带(L)、(H)在试验开始后的前2 d,各试验组间没有显著性差异(P>0.05)。6 d后,当Fe3+质量浓度为0 mg/L时,韩国海带(L)配子体段的细胞增长显著低于其他3个质量浓度组(P<0.05)。第10天,当Fe3+质量浓度为0 mg/L时,韩国海带(H)配子体段的细胞增长显著低于其他3个质量浓度组(P<0.05)。“连杂1号”(L)、(H)在试验的前4 d,各Fe3+质量浓度组间配子体段的细胞增长没有显著性差异(P>0.05)。但随着试验的进行,在第10天,Fe3+质量浓度为0、0.5 mg/L组的细胞增长数显著低于1.0、1.5 mg/L组(P<0.05)。
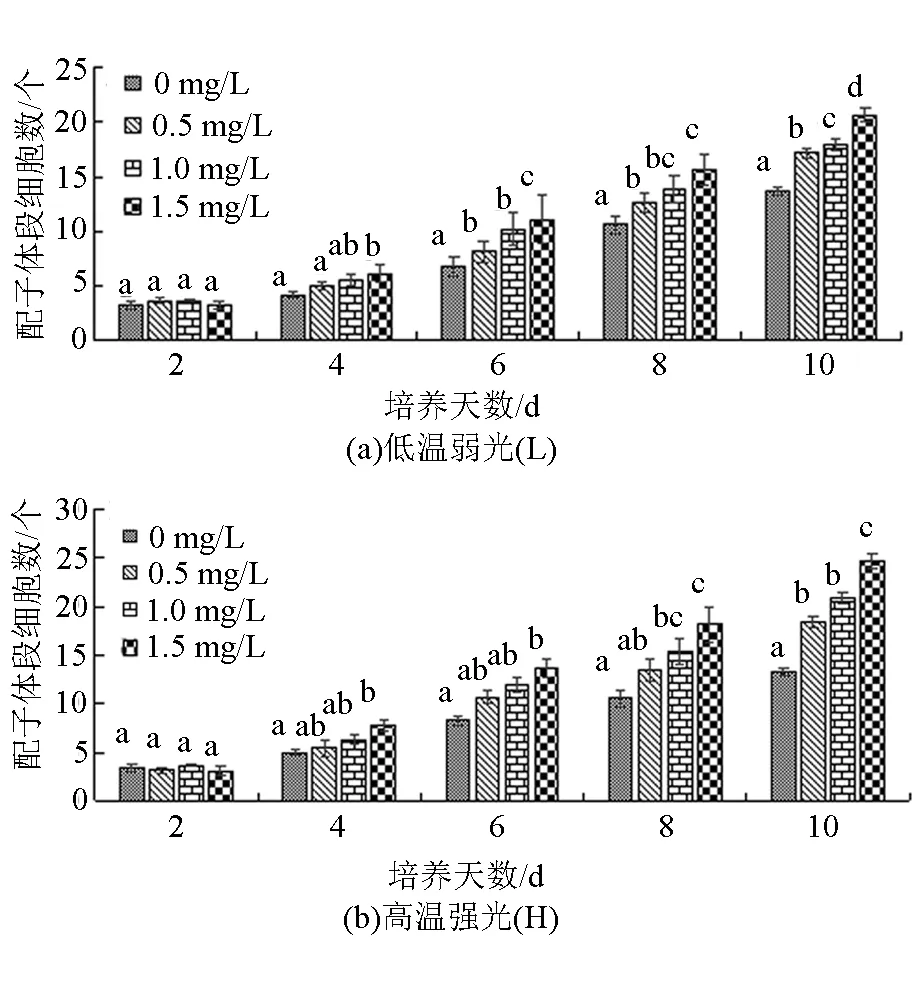
注:柱状图上方不同字母表示同一时间不同Fe3+质量浓度组间有显著性差异(P<0.05),相同字母表示无显著性差异(P>0.05)。
从图1~图3可以看出,“901”(L)在试验的前8 d、“901”(H)在试验的前6 d,Fe3+质量浓度越高,其配子体段细胞数增长速度越快。韩国海带和“连杂1号”在试验的前10 d,其配子体段细胞数的增长速度基本上随着Fe3+质量浓度的增高而加快,并且与高温强光条件下的雌配子体相比,低温弱光条件下雌配子体的相对生长率较低。
注:柱状图上方不同字母表示同一时间不同Fe3+质量浓度组间有显著性差异(P<0.05),相同字母表示无显著性差异(P>0.05)。
从图4可以看出,“901”(L)在Fe3+质量浓度为0 mg/L时没有排卵现象,而“901”(H)的排卵比率达73.8%。“901”(L)和“901”(H)均在Fe3+质量浓度为1.5 mg/L时,其配子体的排卵比率最高,分别达91.06%和100%。“901”(L)配子体的排卵比率在4个Fe3+质量浓度组间有显著性差异(P<0.05);“901”(H)配子体的排卵比率在Fe3+质量浓度1.0、1.5 mg/L组间没有显著性差异(P>0.05),3个添加Fe3+的组显著高于不添加Fe3+组(P<0.05)。
从图5可以看出,韩国海带(L)只有在Fe3+质量浓度为0.5 mg/L时有排卵现象,其配子体排卵比率为1.83%。韩国海带(H)在Fe3+质量浓度为0 mg/L时没有排卵现象,在Fe3+质量浓度为0.5 mg/L时,其配子体排卵比率为4.33%,显著高于Fe3+质量浓度为1.5 mg/L的组(P<0.05)。
从图6可以看出,“连杂1号”(L)、(H)在Fe3+质量浓度为0 mg/L时均没有排卵现象,在Fe3+质量浓度为1.0 mg/L时,其配子体排卵比率最高,分别为6.23%和5.70%。“连杂1号”(L)配子体排卵比率在Fe3+质量浓度0.5、1.0 mg/L两个组间没有显著性差异(P>0.05),但这两组均显著高于1.5 mg/L组(P<0.05)。“连杂1号”(H)配子体排卵比率在Fe3+质量浓度为1.0、1.5 mg/L的两个组间差异不显著(P>0.05),但显著高于0.5 mg/L组(P<0.05)。从图4~图6可以看出,铁盐对“901”雌配子体孤雌生殖的影响最为明显,Fe3+质量浓度越高,配子体的排卵比率越高,而韩国海带和“连杂1号”雌配子体的排卵比率均很低。
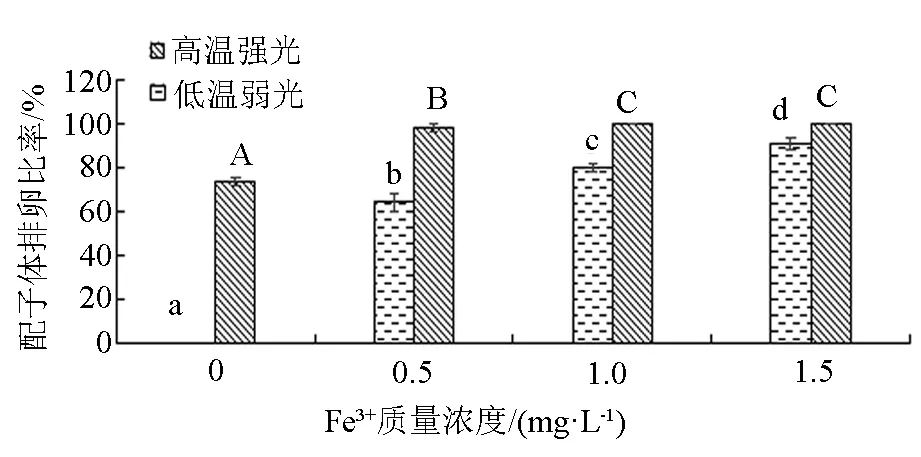
注:柱状图上方小写字母不同表示低温弱光条件下不同Fe3+质量浓度组间差异显著(P<0.05),大写字母不同表示高温强光条件下不同Fe3+质量浓度组间差异显著(P<0.05)。
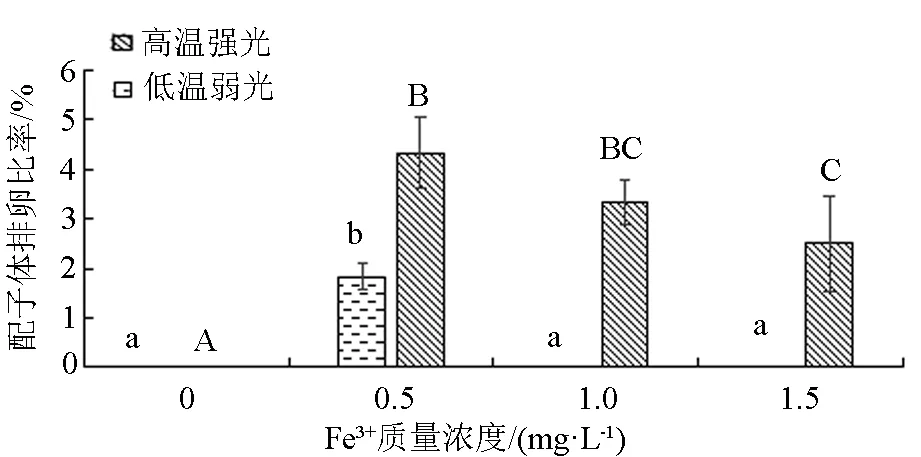
注:柱状图上方小写字母不同表示低温弱光条件下不同Fe3+质量浓度组间差异显著(P<0.05),大写字母不同表示高温强光条件下不同Fe3+质量浓度组间差异显著(P<0.05)。
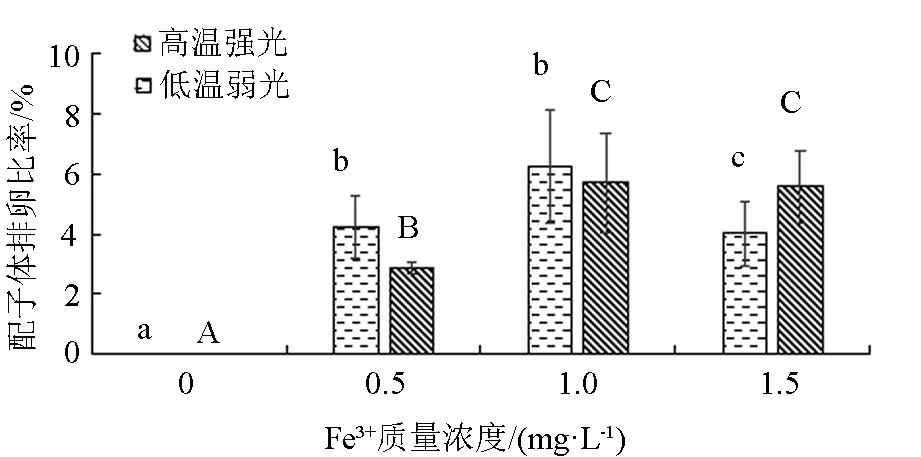
注:柱状图上方小写字母不同表示低温弱光条件下不同Fe3+质量浓度组间差异显著(P<0.05),大写字母不同表示高温强光条件下不同Fe3+质量浓度组间差异显著(P<0.05)。
2.2 铁盐对海带雌配子体生长发育状态的影响
试验第2天,“901”(L)配子体(见图7,a)的状态没有明显变化。试验第4~6天,Fe3+质量浓度为0 mg/L组的配子体生长较慢,Fe3+质量浓度越高,配子体营养生长越快。试验第8天,Fe3+质量浓度为1.5 mg/L的组中有少部分配子体细胞顶端出现卵囊,个别细胞排卵(见图7,b)。试验第10天,0.5、1.5 mg/L的组配子体均出现排卵现象;第14~22天,进入排卵高峰期(见图7,c)。第22天后,卵细胞开始大量转成孢子体(见图7,d)。“901”(H)在试验第8天,Fe3+质量浓度为0.5、1.5 mg/L的组均开始排卵;试验第10天,Fe3+质量浓度为0 mg/L的组也出现了排卵现象;第10~18天,配子体大量排卵,第18天,卵细胞开始大量转成孢子体。Fe3+质量浓度越高,韩国海带配子体营养生长的速度越快,在试验第16天,已形成复杂的分枝体和簇状体(见图8,a),只有个别细胞排卵进行孤雌生殖(见图8,b)。“连杂1号”在Fe3+质量浓度为0.5、1.5 mg/L时,Fe3+质量浓度越高,其营养生长越快,且色素越深(见图9,a),少量卵细胞则转成小孢子体(见图9,b)。
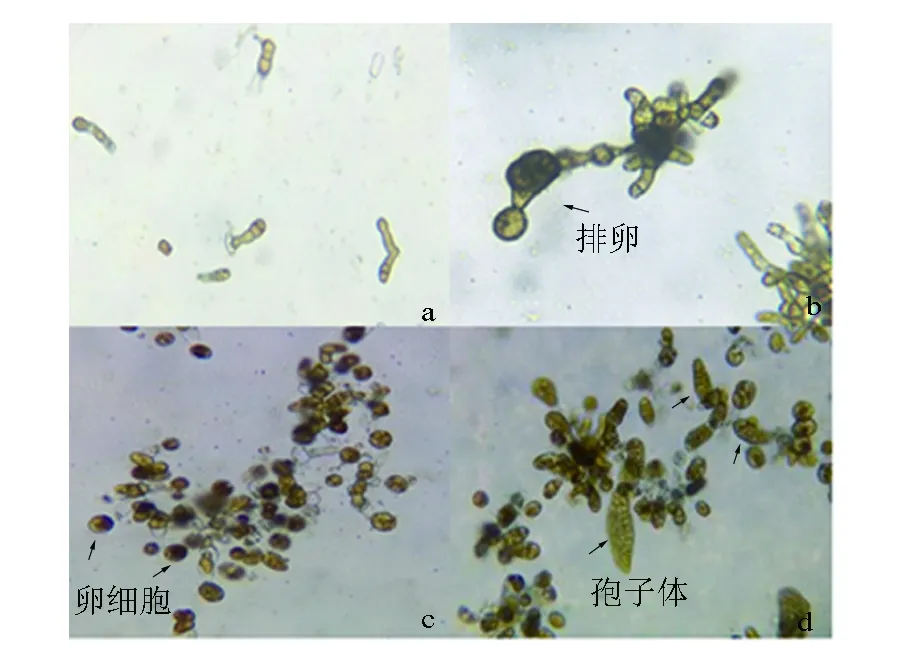
a.配子体;b.正在排卵;c.大量排卵;d.形成孢子体
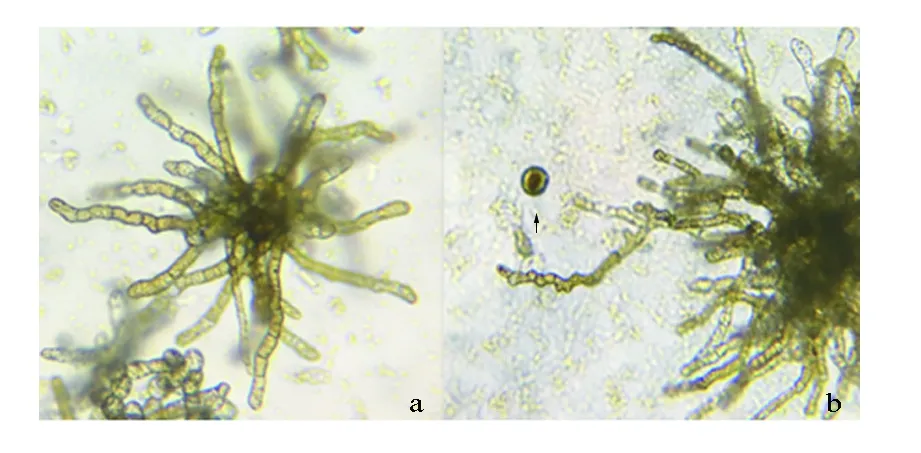
a.簇状体;b.排卵
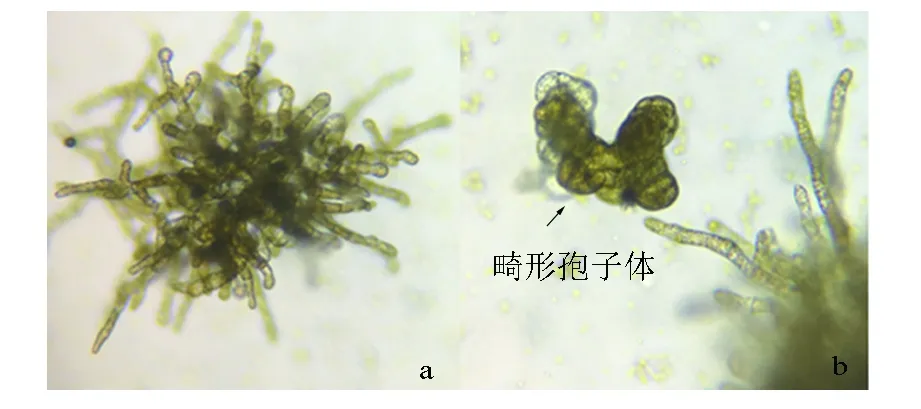
a.簇状体;b.畸形孢子体
试验过程中发现,“901”雌配子体孤雌生殖形成了大量的孢子体,其形态各样,有椭圆形、扇形、带形、波浪形等(见图10)。但这些孢子体全部是畸形的,培养几天后就会出现细胞膨大、色素降解等现象,最终全部死亡(见图11)。
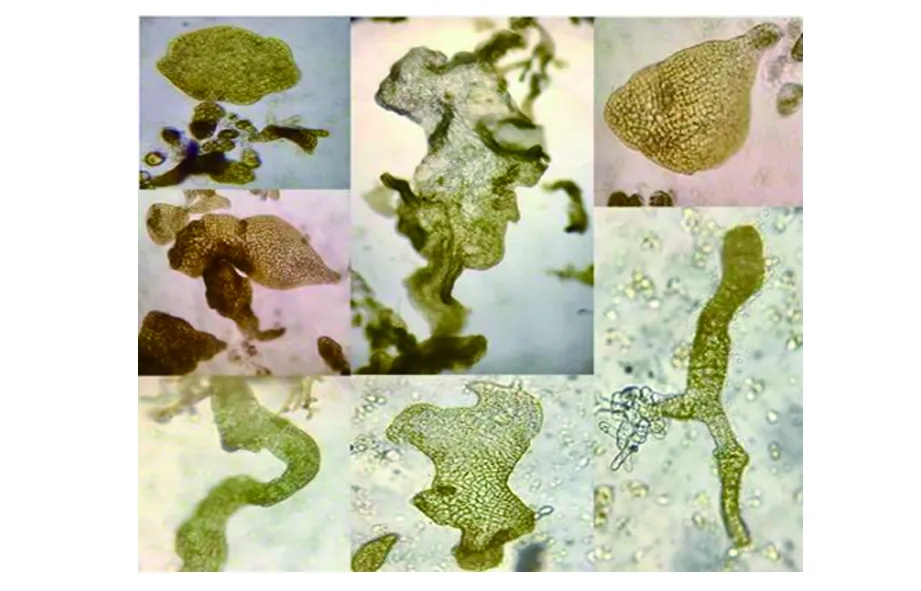
图10 各种形态的畸形孢子体

a.正常形态的孢子体; b,c,d.即将死亡的孢子体
3 讨论
本试验通过添加铁盐,对在低温弱光(L)和高温强光(H)两种条件下培养的“901”、韩国海带和“连杂1号”3个品种(系)海带雌配子体的生长发育情况进行了观察比较,结果发现:铁盐对海带雌配子体的生长发育具有显著的促进作用,但不同品种(系)间海带雌配子体的表现并不相同。在不添加铁盐的情况下,除“901”(H)出现排卵现象外,其他2个品系均进行营养生长;在添加铁盐的情况下,“901”、韩国海带和“连杂1号”均出现排卵现象,说明铁离子能够促进海带雌配子体的孤雌生殖[32-33]。试验过程中发现,“901”海带雌配子体易进行孤雌生殖,且Fe3+质量浓度越高,其孤雌生殖比率越高。当Fe3+质量浓度为1.5 mg/L时,在低温弱光和高温强光条件下培养的“901”海带雌配子体,其排卵比率分别高达91.06%和100%。韩国海带和“连杂1号”的排卵比率相对较低,均不超过7%,其主要进行营养生长。由试验结果可以看出,铁离子对“901”生长发育的促进效果比对韩国海带和“连杂1号”更为显著。其中,“901”(H)在不加铁盐的情况下排卵比率为73.8%。分析认为,该品系比较容易受环境因素的影响,在高温强光条件下,其生长被抑制,恢复到适宜条件后,配子体为了生存,对繁育有迫切的需求,因而快速排卵进行孤雌生殖产生孢子体。相反,韩国海带(L)、(H)在Fe3+质量浓度为0.5 mg/L时排卵比率最高,但也仅为1.83%和4.33%,其他Fe3+质量浓度组的韩国海带(L)无排卵现象。“连杂1号”(L)、(H)在Fe3+质量浓度为1.0 mg/L时排卵比率最高,但仅为6.23%和5.70%。这两个品系均是铁离子质量浓度越高,配子体营养生长越快,这与王潇等[34]的研究结果一致,说明适宜的铁离子质量浓度能够促进配子体的生长。本试验结果还表明,铁和氮、磷营养盐在促进海带配子体发育时具有协同作用,铁是海带配子体由营养生长到发育成熟再到有性生殖过程中的关键因素,但铁质量浓度过高会抑制海带配子体的发育[34]。
本试验发现,同一配子体上排卵细胞越多,越容易刺激周围细胞成熟进行排卵,配子体营养生长越受到抑制;反之,配子体营养生长越旺盛,排卵现象越少。试验中,孤雌生殖产生的卵细胞和孢子体均不易存活,在海带和裙带菜[35-36]中均存在这种情况。本试验中,海带雌配子体孤雌生殖所形成的孢子体均为畸形,且最后都死亡了,而在戴继勋等[35]和方宗熙等[32]的报道中有少量自然成熟的孢子体。分析其可能性,一是孤雌生殖产生的孢子体存在基因缺陷[37],二是本试验中采用培养皿培养,其生存空间较小,不适宜生长,三是所选用的海带品系不同。铁盐对海带配子体的生长发育具有重要影响,其适宜添加浓度以及与氮、磷等其他营养因子的协同机理等研究对海带苗种生产有着重要意义。

