EaDREB2B互作蛋白的筛选及分析
蒋夏兰 黄翠霖 徐世强 张木清


摘 要:甘蔗(Saccharum officinarum)是我國重要的糖料作物之一,90%以上的食用糖是由甘蔗产生的,我国有85%以上的甘蔗种植区是分布在旱地,干旱是限制甘蔗生产重要的因素之一。因此,改良和培育抗旱甘蔗新品种对甘蔗产业的发展具有重要意义。AP2/ERF转录因子是植物中特有的基因家族之一,该基因家族成员通过调控逆境胁迫相关基因的表达,从而在植物的干旱、盐害、冷冻等非生物胁迫中发挥重要作用。前期研究表明斑茅转录因子EaDREB2B在近缘种甘蔗中异源表达可提高甘蔗的抗旱性,但EaDREB2B在甘蔗中的互作蛋白有待挖掘,其调控甘蔗抗旱的分子机制尚待阐明。本研究在前期研究基础上,构建了干旱胁迫下转EaDREB2B基因甘蔗GN18的酵母cDNA文库,拟利用生物信息学和酵母双杂交技术筛选EaDREB2B的互作蛋白,为阐明EaDREB2B调控甘蔗抗旱的分子机制奠定基础。结果表明:EaDREB2B编码325个氨基酸,含有一个位于N端71~129氨基酸区域的AP2保守结构域,EaDREB2B存在转录激活活性,其自激活区位于EaDREB2B的C端255~325氨基酸区域;利用截短的EaDREB2B(1~255氨基酸)作为诱饵蛋白在甘蔗酵母cDNA文库中筛选其互作蛋白,初步筛选出498个候选阳性克隆,通过PCR检测筛选到432个有效阳性克隆,经测序和比对去除重复克隆后,成功筛选出269个与EaDREB2B互作的候选蛋白,候选互作蛋白主要包括转录因子、泛素蛋白酶、乙烯不敏感蛋白、脱水诱导蛋白、核糖体蛋白、延伸因子、解旋酶、蛋白激酶和一些未知蛋白等。通过KEGG功能分析显示,162个候选蛋白被KEGG注释,并且参与44条KEGG信号通路,主要涉及泛素介导蛋白水解、光合作用、核糖体、氨基酸的生物合成、半胱氨酸和蛋氨酸、调节自噬、内质网中的蛋白质加工、碳代谢和RNA转运等通路;通过KEGG富集分析发现互作蛋白在光合作用、泛素介导蛋白水解和氨基酸生物合成等途径显著富集,推测EaDREB2B可能通过其相互作用蛋白泛素化介导蛋白降解参与逆境响应,推测EaDREB2B可能通过蛋白泛素化介导蛋白降解参与逆境响应。
关键词:EaDREB2B;甘蔗;干旱;酵母双杂;蛋白互作
中图分类号:S961.6 文献标识码:A
Screening and Analysis of EaDREB2B Interaction Proteins from Sugarcane
JIANG Xialan, HUANG Cuilin, XU Shiqiang, ZHANG Muqing*
Guangxi Key Laboratory of Sugarcane Biology Provincial, Guangxi University / Provincial & Ministerial Collaborative Innovation Center for Sugar Industry, Nanning, Guangxi 530005, China
Abstract: Sugarcane is the most important sugar crop, in China. More than 90% sugar is produced by sugarcane. More than 85% of sugarcane planting areas are distributed in dry land, and drought is one of the important factors restricting sugarcane production.The AP2/ERF gene family is one of the plant-specific gene families, which participate in the regulation and expression of genes related to adverse stress, and play a very important role in adverse stress. The previous research of the research group showed that EaDREB2B can improve the drought resistance of sugarcane, but the interaction protein of EaDREB2B in regulating the drought resistance of sugarcane remains to be clarified. In this study, a yeast cDNA library of EaDREB2B transgenic sugarcane GN18 under drought stress was constructed based on previous research. Bioinformatics and a yeast two-hybrid technique were used to screen the EaDREB2B interaction proteins to clarify the role of EaDREB2B in regulating sugarcane drought resistance. The functional domain prediction showed that EaDREB2B contained 978 base pairs, encoding 325 amino acid residues with a calculated molecular mass of 36.52 kDa and a predicted pI of 4.57, and the AP2/ERF of EaDREB2B existed in the N-terminal 71‒129 amino acid region. The transactivation activity analysis showed that EaDREB2B had transcriptional activation activity in yeast. EaDREB2B had self-activation in the C-terminal 255‒325 amino acid region. In this study, the truncated EaDREB2B (1‒255 amino acid) was used as the bait protein to screen the sugarcane cDNA library and aimed to identify proteins that interacted with EaDREB2B. In this study, 498 positive candidate clones were initially screened, and 432 effective positive clones were further screened by PCR. After sequencing and comparison to remove identical clones, a total of 269 candidate proteins that interacted with EaDREB2B were screened out. The candidate interacting proteins mainly include transcription factors, ubiquitin proteases, ethylene insensitive proteins, dehydration-inducing proteins, ribosomal proteins, elongation factors, helicases, protein kinases, some unknown proteins and so on. The results of KEGG pathway analysis showed that a total of 162 proteins were annotated with KEGG and assigned to 44 KEGG pathways, including Ubiquitin mediated proteolysis, photosynthesis, ribosome, biosynthesis of amino acids, cysteine and methionine metabolism, regulation of autophagy, protein processing in endoplasmic reticulum, carbon metabolism and RNA transport. KEGG enrichment analysis indicated that 269 candidate proteins were significantly enriched in photosynthesis, ubiquitin-mediated proteolysis, amino acid biosynthesis, and other pathways, suggesting that EaDREB2B might mediate protein degradation through ubiquitination.
Keywords: EaDREB2B; sugarcane; drought; yeast two-hybrid; interaction protein
DOI: 10.3969/j.issn.1000-2561.2022.01.007
植物在生长发育过程中会受到许多不利因素的影响,包括生物因素和非生物因素。据报道,世界上主要的农作物近50%的产量损失与非生物胁迫有关[1]。近年来,随着全球气候变暖,干旱已然成为影响作物产量的重要因素。甘蔗(Sac¬c¬ha¬rum officinarum)是我国最重要的糖料作物,全国近90%的食糖由甘蔗提供[2]。我国85%以上的甘蔗种植区分布在旱地,有效灌溉面积小,干旱严重限制了甘蔗的生长发育,从而导致产量显著下降[3-4]。长期的进化过程中,植物形成了多种应答机制来抵御逆境胁迫。转录因子在植物响应干旱和高温逆境胁迫过程中扮演着关键角色[5]。
AP2/ERF类转录因子是植物特有的转录因子,该类转录因子至少含有1个高度保守的AP2/ERF结构域[6]。在拟南芥和水稻中,根据序列的相似性和AP2 的数量将AP2/ERF基因家族分为AP2、ERF(ethylene-responsive factor)、RAV(ABI3/VP1)和Soloist 4个亚族,AP2/ERF结构域中的第14位氨基酸和第19位氨基酸对转录因子与DNA的结合尤为重要。在ERF亚族中根据第14位氨基酸和第19位氨基酸的类型,将ERF家族分为ERF和DREB(dehydration-responsive element-binding protein)[7]。
DREB转录因子参与不同的信号传递,低温、干旱和高盐等逆境胁迫能诱导大部分DREB基因的表达。拟南芥的AtDREB2A基因能特异性地结合干旱应答元件CRT/DRE(C-repeat/dehydration- responsive element)的核心序列(A/GCCGAC),调控高盐、干旱和低温相关基因的表达[8-9]。StDREB2基因通过调控气体交换、渗透物质累积、抗氧化酶活性、活性氧(ROS)清除及与逆境相关基因的表达,从而提高棉花的抗旱能力和植物生物量[10]。CHEN等[11]发现GmDREB2受干旱胁迫诱导,可激活转基因拟南芥系列下游基因的表达,提高转基因株系对干旱的耐受性。JIANG等[12]报道番茄SlDREB1基因在干旱胁迫下强烈表达,将其遗传转化拟南芥后,发现其能增强转基因拟南芥的耐旱能力。WANG等[13]研究发现水稻OsDREB1F基因、OsDREB2A基因均受高盐胁迫诱导,分别在拟南芥中过表达OsDREB1F基因、OsDREB2A基因,并且发现转基因株系均表现出较强抗盐能力。本课题组前期构建了以rd29A为启动子的表达载体prd29a-dreb- hyg,通过基因枪轰击转化甘蔗,获得转基因GN18植株,在后续研究中发现GN18与野生型FN95-1702相比,具有优异的抗旱性,表明EaDREB2B能够提高甘蔗的抗旱性[14]。然而,关于EaDREB2B调控甘蔗抗旱分子机制尚不清楚,因此本研究拟利用酵母双杂交技术筛选EaDREB2B的互作蛋白,为阐明EaDREB2B调控甘蔗抗旱的分子机制奠定基础。
1 材料与方法
1.1 材料
酵母双杂实验所用的Y2HGold酵母菌株、质粒pGADT7和pGBKT7购于Clontech公司;高保真酶2 × Phanta(南京,诺唯赞)、DNA Ligation Kit(TaKaRa)、Top10感受态细胞(上海,唯地生物)、质粒DNA小提试剂、DNA纯化回收试剂盒(北京,天根)、酵母质粒提取试剂盒(北京,索莱宝)等均购自商业公司;引物合成由生工生物工程(上海)股份有限公司和南宁捷尼斯生物公司共同完成,测序由生工生物工程(上海)股份有限公司完成。研究使用的甘蔗材料为GN18(转EaDREB2B基因株系)和FN95-1702(受体材料),由本实验室种植保存。甘蔗材料的种植及处理参见XU等[15]的方法,采集正常浇水、轻度干旱、重度干旱和复水5 d的GN18甘蔗叶片用于甘蔗cDNA酵母文库构建。
1.2 方法
1.2.1 EaDREB2B生物信息学分析 利用Expasy在线分析工具ProtParam tool(https://web.expasy. org/protparam/)对EaDREB2B蛋白氨基酸序列进行氨基酸数目、相对分子质量、等电点等理化性质分析,ProtSacle(https://web.expasy. org/protscale/)在线分析亲水性和疏水性;Prosite tool(https:// prosite.expasy.org/prosite.html)分析EaDREB2B蛋白的保守结构域;NetPhosK 1.0 Server(http:// www.cbs.dtu.dk/services/NetPhos-3.1/)預测潜在的磷酸化位点;TMHMM Server v. 2.0(http://www. cbs.dtu.dk/services/TMHMM-2.0/)分析其跨膜结构域。
1.2.2 pGBKT7-EaDREB2B载体构建 EaDREB2B的AP2保守结构域位于N端71~129氨基酸区域,对EaDREB2B蛋白从C端进行氨基酸截短。根据前期分析的EaDREB2B基因序列信息及结合pGBKT7多克隆位点信息,设计带有EcoR I和Sal I的EaDREB2B全长(1~325 aa)及一系列截短蛋白(1~295 aa、1~275 aa和1~255 aa)的PCR扩增引物,引物序列见表1。PCR反应体系为:总体积为50 μL,其中2×Phanta® Max Master Mix 25 μL,上下游引物各2 μL,模板质粒1 μL,ddH2O 20 μL。反应程序为:95℃ 3 min;95℃ 15 s,60℃ 15 s,72℃ 30 s,35个循环;72℃ 5 min。PCR产物回收后与酵母表达载体pGBKT7分别用EcoR I和Sal I双酶切,回收后的目的基因与载体片段用DNA Ligation Kit连接酶16℃连接30 min后,取5 μL连接产物转化50 μL大肠杆菌Top10感受态细胞,涂布于含卡那霉素(50 μg/mL)的LB固体培养基,37℃过夜培养。挑选阳性克隆,经菌液PCR检测后扩大培养提取质粒,委托生工生物工程(上海)股份有限公司完成测序,测序正确即成功构建诱饵表达载体。
1.2.3 酵母Y2HGold感受态细胞制备及自激活验证 酵母感受态细胞制备及转化参照鄢敏丽[16]的方法。按照Clontch公司酵母双杂交试剂盒说明方法,将含有EaDREB2B(1~325 aa、1~295 aa、1~275 aa、1~255 aa)片段的载体与pGBKT7(BD空载)分别转化酵母Y2HGold感受态细胞,涂布于SD/-Trp/X-α-Gal平板上,30℃培养3~5 d,根据菌斑生长情况及颜色变化判断是否有转录自激活活性。
1.2.4 酵母文库建立及互作蛋白的筛选 本研究使用的甘蔗均一化pGADT7-cDNA酵母文庫,委托上海欧易生物医学科技有限公司构建。将pGBKT7-EaDREB2B(1~255 aa)与pGADT7- cDNA文库质粒共同转化Y2HGold酵母感受态,以pGBKT7-53+pGADT7-T为阳性对照,以pGBKT7-Lam+ pGADT7-T为阴性对照,将转化后的酵母涂布于DDO/A/X(SD/-Leu/-Trp/AbA(125 ng/mL)/X-α-Gal(40 μg/mL)平板上;30℃培养3~5 d后,挑选蓝色菌落划线于QDO/A/X(SD/-Ade/-His/-Leu/-Trp/AbA/X-α-Gal)平板上;30℃培养3~5 d后,挑选在QDO平板正常生长的蓝色菌落于QDO液体培养基中;30℃摇床培养2~3 d,提取浑浊菌液质粒DNA,用AD载体通用引物进行PCR扩增,引物信息见表1;挑选片段大于500 bp单一产物进行测序,测序结果通过Blast比对割手密基因组数据库(http://www.life. illinois.edu/ming/downloads/Spontaneum_genome/),获取候选蛋白注释信息。
2 结果与分析
2.1 EaDREB2B生物信息学分析
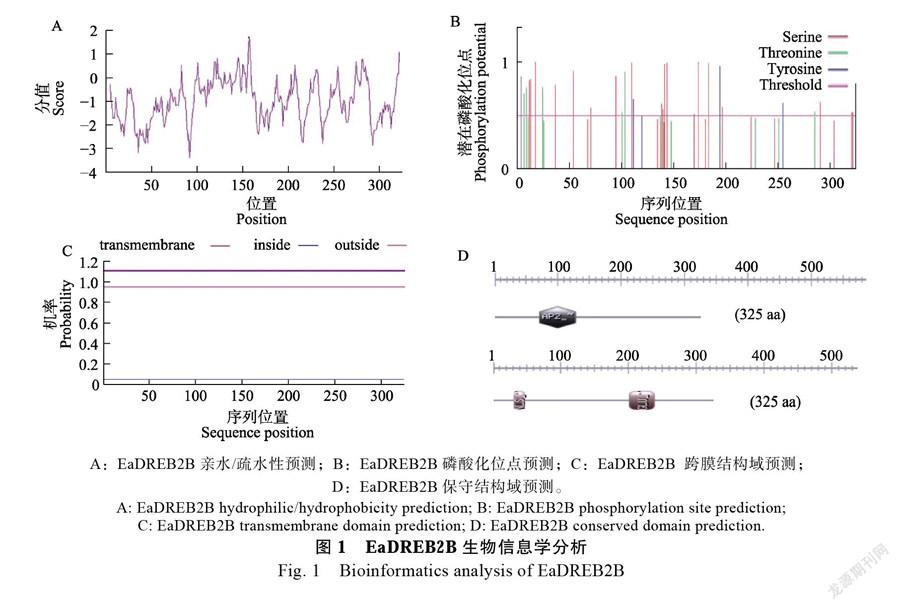
理化性质分析发现,EaDREB2B蛋白分子量为36.52 kDa,等电点(pI)为4.57,分子式为C1576H2454N444O532S12 ,不稳定系数为59.63。亲水性和疏水性分析预测,发现EaDREB2B蛋白质的氨基酸序列中多为亲水性氨基酸(图1A),推测EaDREB2B为亲水蛋白质;磷酸化预测结果显示,EaDREB2B蛋白质中有19个Ser(丝氨酸)位点可发生磷酸化修饰,有8个Thr(苏氨酸)位点可发生磷酸化修饰,4个Tyr(酪氨酸)位点可发生磷酸化修饰(图1B),推测EaDREB2B翻译后可能进行磷酸化修饰发挥其功能;跨膜结构分析,发现EaDREB2B蛋白没有跨膜结构(图1C)。EaDREB2B蛋白保守结构域分析发现,EaDREB2B蛋白共编码325个氨基酸,具有一个高度保守的AP2结构域,包含58个氨基酸残基,位于71~129 aa区域。EaDREB2b蛋白的N端存在KRWKESNQNVDEKPRRK核定位序列(NLS),C端的202~240 aa之间存在一个谷氨酸富集区(图1D)。蛋白质二级结构分析,EaDREB2B蛋白由43.69%的无规则卷曲、38.46%的α-螺旋和6.15%的β-转角组成。
2.2 诱饵载体构建及自激活检测
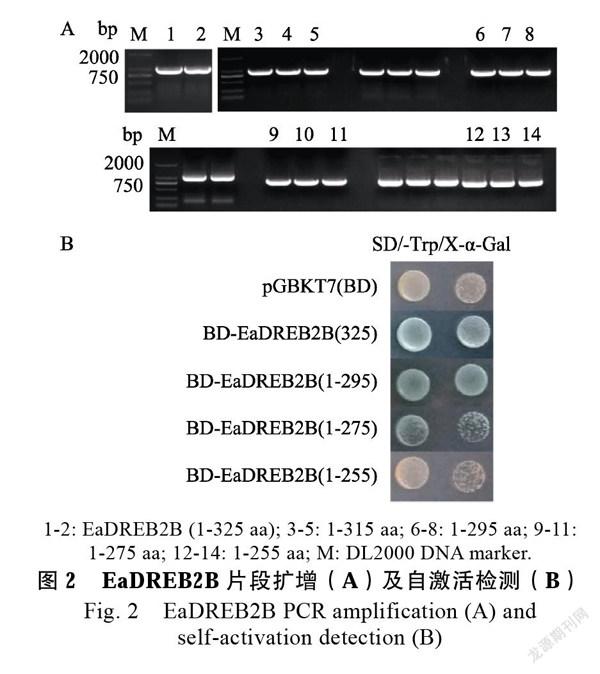
通过PCR扩增EaDREB2B全长及其截短片段,产物经琼脂糖凝胶电泳检测后获得目的条带(图2A),产物纯化后插入pGBKT7,转化大肠杆菌Top10感受态,测序后确认和已知的EaDREB2B全长及其截短的EaDREB2B序列完全一致。重组质粒自激活检测结果显示,在SD/-Trp/X-α-Gal平板上均能正常长出菌落,表明重组质粒成功转入Y2H酵母菌株;转化EaDREB2B全长、截短EaDREB2B片段(1~295 aa和1~275 aa)的酵母菌落变蓝色,而转化pGBKT7(BD)空载和重组EaDREB2B(1~255 aa)截短片段的酵母菌落未变蓝,结果表明EaDREB2B具有自激活活性,自激活区域位于C端255~325区域(图2B)。
2.3 酵母文库的筛选和阳性克隆的鉴定
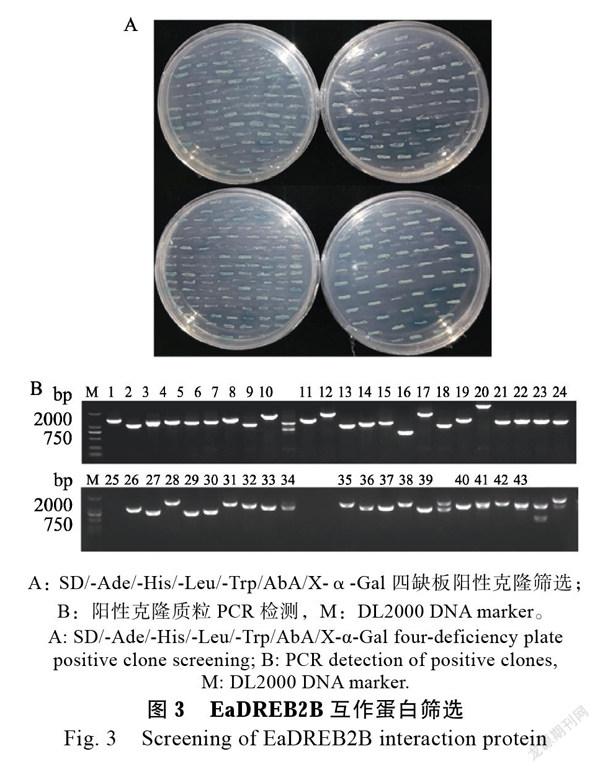
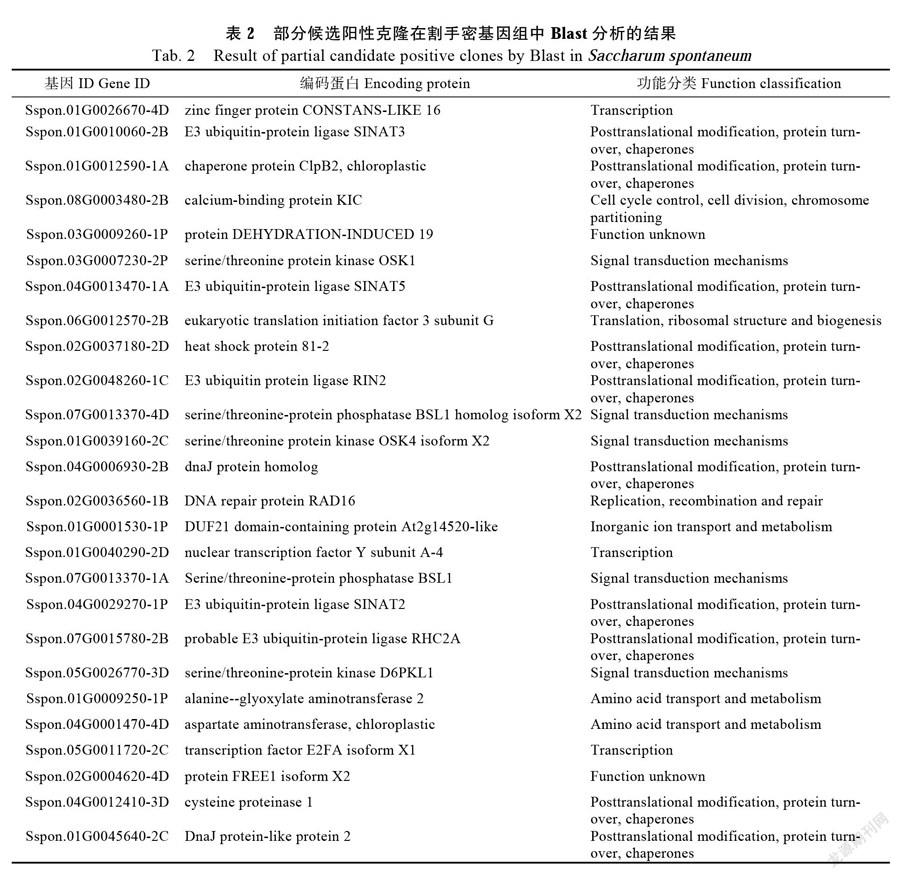
选用无转录激活活性的pGBKT7-EaDREB2B(1~255 aa)与pGAD7-cDNA酵母文库质粒混合后共同转化Y2H酵母感受态,均匀涂布于DDO/A/X营养缺陷培养基上,30℃培养3~5 d。挑选平板上直径大于2 mm的蓝色菌落,重新划线于QDO/A/X平板上初步得到820个阳性克隆,挑选四缺板上的阳性克隆与3 mL QDO/X/A液体培养基中培养2~3 d,提取酵母质粒后用载体通用引物进行PCR验证,结果筛选到432个阳性克隆(图3A),挑选片段大于500 bp阳性克隆进行测序分析(图3B)。测序结果通过Blast检索割手密基因组cDNA数据库,去除重复序列后获得269个候选蛋白的注释信息,主要包括转录因子、泛素蛋白酶、乙烯不敏感蛋白、脱水诱导蛋白、核糖体蛋白、延伸因子、解旋酶、蛋白激酶和一些未知蛋白等(表2)。
利用百迈克在线分析工具[17],对269个候选互作蛋白进行GO功能注释分类,269个候选蛋白中有242个蛋白得到注释,这些蛋白参与15种生物进程,14种细胞组分合成和9种分子功能(图4A)。KEGG pathway功能分析显示,269个候选蛋白中有162个蛋白参与44条信号通路,主要涉及泛素介导蛋白水解(ubiquitin mediated proteolysis)、光合作用(photosynthesis)、核糖体(ribosome)、氨基酸的生物合成(biosynthesis of amino acids)、半胱氨酸和蛋氨酸(cysteine and methionine metabolism)、调节自噬(regulation of autophagy)内质网中的蛋白质加工(protein processing in endoplasmic reticulum)、碳代谢(carbon metabolism)和RNA转运(RNA transport)等通路(图4B)。
3 讨论
前人研究发现,大多数DREB2s转录因子仅含有一个由58个氨基酸残基组成的AP2结构域,N末端是富含碱性氨基酸的核定位信号区,C端存在转录自激活区域。QIN等[18]研究发现玉米中ZmDREB2A转录因子自激活区域在于C端235~ 272 aa区域。水稻中OsDREB2B具有转录激活活性,研究发现OsDREB2B蛋白的284~373 aa区域其转录活性很重要[19]。SAKUMA等[20]研究发现,拟南AtDREB2A蛋白的C端存在一个含有脯氨酸-谷氨酸-丝氨酸-苏氨酸形成的信号肽,正常条件下,信号肽对AtDREB2A蛋白有抑制作用,當删除这段氨基酸残基后(AtDREB2A-CA),过表达AtDREB2A-CA基因可提高拟南芥的抗旱能力。EaDREB2B生物信息学分析发现,EaDREB2B蛋白的N端有一个碱性核定位区,只有1个AP2结构域,位于N端71~129 aa区域,共58个氨基酸残基,编码的蛋白主要以β-折叠和α-螺旋为主,根据DREB亚族分类条件,EaDREB2B属于DREB2s类转录因子,推测其可能存在转录激活区域。通过构建EaDREB2B蛋白全长及从截短蛋白片段的诱饵表达载体,并进行自激活区域检测,结果显示EaDREB2B全长具有转录激活活性,能转录激活调控下游一系列相关基因的表达,其转录激活区域在EaDREB2B的C端255~325 aa区,与前人研究发现DREB2s类转录因子C端存在转录激活活性的结果一致。
酵母双杂交技术是验证蛋白间相互作用的经典方法,最早由美国纽约州立大学的FIELDS等在1989年提出并且建立了基本模型[21]。1997年,STOCKINGER等[22]利用酵母单杂技术,首次从拟南芥cDNA文库中分离到DREB转录因子CBF1。LEE等[23]从拟南芥酵母cDNA文库中筛选DREB2C的互作蛋白bZIP蛋白(ABF2),ABF2可调节对ABA依赖性基因的表达。朱路平[24]研究发现OsDREBA5转录因子有转录激活活性,其自激活区域在C端,选择无自激活活性的pGBKT7-OsDREBA5-1-f2质粒,从水稻酵母文库中成功筛选出43个互作蛋白,表明利用C端截短的DREB转录因子可通过酵母双杂交筛选与其相互作用的蛋白。本研究利用酵母双杂交技术,以截短的EaDREB2B(1~255 aa)为诱饵质粒,从甘蔗酵母cDNA文库成功筛选到269个与EaDREB2B(1~255 aa)互作的候选蛋白。
本研究筛选到与EaDREB2B互作的候选蛋白中涉及蛋白激酶和泛素蛋白酶体等防御相关的蛋白较多,说明EaDREB2B在抗非生物胁迫中有着重要作用。泛素-蛋白酶系统在生物体内控制许多蛋白质的降解速率,从而调节多个基本的细胞生理过程,包括植物生长、细胞信号传导和应激反应[25-26]。泛素-蛋白酶系统在真核生物中是机械保守的,涉及复杂的酶和酶复合物收集,这些酶和酶的复合物结合到特定靶标蛋白并促进其进行泛素化的降解。蛋白质靶标是通过ATP依赖性反应级联作用于泛素化,一般是通过E1 Ub激活酶、E2 Ub结合酶、E3 Ub连接酶3个连续作用进行标记[27]。据报道,DREB2A互作蛋白(DRIP1和DRIP2)与DREB2B相互作用,作为RING型E3泛素连接酶将DREB2A靶向26s蛋白酶体水解[28]。ZHANG等[29]发现拟南芥中编码E3泛素蛋白的TaSAP5可介导与DREB2A互作蛋白DRIPs的降解,从而增加DREB2A蛋白的积累,进而影响其下游基因的表达。
EaDREB2B互作候选蛋白FREE1是内体蛋白分选转运装置(endosomal sorting complex required for transport, ESCRT)所需的内体分选复合物关键蛋白,参与多囊泡/前室区蛋白质的分选的调节。BUESO等[30]和BELDA-PALAZON等[31]发现RSL1介导ABA受体PYL4和PYR1泛素化,FREE1可与RSL1相互作用,将质膜上的ABA受体复合物转运至ESTCRT机制中进行泛素化降解,减弱ABA信号传导。FREE1与转录因子ABF4和ABI5相互作用,以通过减少他们与下游基因的顺式调控序列的结合而在转录上抑制ABA信号传导途径[32]。推测EaDREB2B可能通过候选互作蛋白FREE1介导PYL4ABA受体的泛素化,参与依赖ABA信号传导途径响应干旱胁迫。
参考文献
[1] SHAO H B, CHU L Y, JALEEL C A, MANIVANNAN P, PANNEERSELVAM R, SHAO M A. Understanding water deficit stress-induced changes in the basic metabolism of higher plants-biotechnologically and sustainably improving agriculture and the ecoenvironment in arid regions of the globe[J]. Critical Reviews in Biotechnology, 2009, 29(2): 131-151.
[2] 李海碧, 桂意云, 张荣华, 韦金菊, 杨荣仲, 张小秋, 李杨瑞, 周 全, 刘昔辉. 甘蔗抗旱性及抗旱育种研究进展[J]. 分子植物育种, 2019, 17 (10): 3406-3415.
LI H B, GUI Y Y, ZHANG R H, WEI J J, YANG R Z, ZHANG X Q, LI Y R, ZHOU Q, LIU X H. Research progress on drought resistance and drought-resistant breeding of sugarcane[J]. Molecular Plant Breeding, 2019, 17(10): 3406-3415. (in Chinese)
[3] 王繼华, 张木清, 曹 干. 甘蔗抗旱育种研究进展[J]. 广东农业科学, 2010, 37(12): 34-35, 51.
WANG J H, ZHANG M Q, CAO G. Research progress of sugarcane breeding for drought resistance[J]. Guangdong Agricultural Sciences, 2010, 37(12): 34-35, 51. (in Chinese)
[4] OW L F, YEO T Y, SIM E K. Identification of drought- tolerant plants for roadside greening-An evaluation of chlorophyll fluorescence as an indicator to screen for drought tolerance[J]. Urban Forestry & Urban Greening, 2011, 10(3): 177-184.
[5] LI X P, TIAN A G, LUO G Z, GONG Z Z, ZHANG J S, CHEN S Y. Soybean DRE-binding transcription factors that are responsive to abiotic stresses[J]. Theoretical and Applied Genetics, 2005, 110(8): 1355-1362.
[6] MAGNANI E, SJÖLANDER K, HAKE S. From endonucleases to transcription factors: evolution of the AP2 DNA bin¬ding domain in plants[J]. The Plant Cell, 2004, 16(9): 2265- 2277.
[7] NAKANO T, SUZUKI K, FUJIMUR T, SHINSHI H. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiology, 2006, 140(2): 411-432.
[8] LIU Q, KASUGA M, SAKUMA Y, ABE H, MIURA S, YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. Two trans¬cription factors, DREB1 and DREB2, with an EREBP/ AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-re¬spo¬n¬s¬ive gene expression, respectively, in Arabidopsis[J]. The Plant Cell, 1998, 10(8): 1391-1406.
[9] KASUGA M, LIU Q, MIURA S, YAMAGUCHI- SHINOZAKI K, SHINOZAKI K. Improving plant drought, salt, and freezing tolerance by gene transfer of a single stress-inducible transcription factor[J]. Nature Biotechnology, 1999, 17(3): 287-291.
[10] EL-SAWI M A, ALAYAFI A A. Overexpression of StDREB2 transcription factor enhances drought stress tolerance in cotton (Gossypium barbadense L.)[J]. Genes, 2019, 10(2): 142.
[11] CHEN M, WANG Q Y, CHENG X G, XU Z S, LI L C, YE X G, MA Y Z. GmDREB2, a soybean DRE-binding transcription factor, conferred drought and high-salt tolerance in transgenic plants[J]. Biochemical and Biophysical Research Communications, 2007, 353(2): 299-305.
[12] JIANG L, WANG Y, ZHANG S, HE R, LI W, HAN J, CHENG X. Tomato SlDREB1 gene conferred the transcriptional activation of drought-induced gene and an enhanced tolerance of the transgenic Arabidopsis to drought stress[J]. Plant Growth Regulation, 2017, 81(1): 131-145.
[13] WANG Q, GUAN Y, WU Y, CHEN H, CHEN F, CHU C. Overexpression of a rice OsDREB1F gene increases salt, drought, and low temperature tolerance in both Arabidopsis and rice[J]. Plant molecular Biology, 2008, 67(6): 589-602.
[14] 吳 杨. 斑茅DREB2B基因遗传转化甘蔗的抗旱性研究[D]. 福州: 福建农林大学, 2009.
WU Y. The study on drought resistance of gentic transformation of Erianthus arundinaceus’s DREB2B gene into sugarcne[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese)
[15] XU S, WANG J, SHANG H, HUANG Y, YAO W, CHEN B, ZHANG M. Transcriptomic characterization and potential marker development of contrasting sugarcane cultivars[J]. Scientific Reports, 2018, 8(1): 1683.
[16] 鄢敏丽. 莲藕多酚氧化酶互作蛋白的筛选及验证[D]. 咸阳: 西北农林科技大学, 2019.
YAN M L. Screening and verification of polyphenol oxidase interacting proteins in lotus[D]. Xianyang: Northwest A&F University, 2009. (in Chinese)
[17] BECKER R A, CHAMBERS J M, WILKS A R. The new S language[M]. London: Taylor & Francis Group, 1988, 45(2): 935.
[18] QIN F, KAKIMOTO M, SAKUMA Y, MARUYAMA K, OSAKABE Y, TRAN L S P, YAMAGUCHI-SHINOZAKI K. Regulation and functional analysis of ZmDREB2A in response to drought and heat stresses in Zea mays L[J]. The Plant Journal, 2007, 50(1): 54-69.
[19] DU X, LI W, SHENG L, DENG Y, WANG Y, ZHANG W, CHEN S. Over-expression of chrysanthemum CmDREB6 enhanced tolerance of chrysanthemum to heat stress[J]. BMC Plant Biology, 2018, 18(1): 1-10.
[20] SAKUMA Y, LIU Q, DUBOUZET J G, ABE H, SHINOZAKI, K, YAMAGUCHI-SHINOZAKI K. DNA- binding specificity of the ERF/AP2 domain of Arabidopsis DREBs, transcription factors involved in dehydration- and cold-inducible gene expression[J]. Biochemical & Biophysical Research Communications, 2002, 290(3): 998-1009.
[21] FIELDS S, SONG O K. A novel genetic system to detect protein–protein interactions[J]. Nature, 1989, 340(6230): 245-246.
[22] STOCKINGER E J, GILMOUR S J, Thomashow M F. Arabidopsis thaliana CBF1 encodes an AP2 domain-cont¬aining transcriptional activator that binds to the C-repeat/ DRE, a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J]. Proceedings of the National Academy of Sciences, 1997, 94(3): 1035-1040.
[23] LEE S J, KANG J Y, PARK H J, KIM M D, BAE M S, CHOI H I, KIM S Y. DREB2C interacts with ABF2, a bZIP protein regulating abscisic acid-responsive gene expression, and its overexpression affects abscisic acid sensitivity[J]. Plant Physiology, 2010, 153(2): 716-727.
[24] 朱路平. 利用酵母双杂交方法筛选转录因子OsDREBA5- 1的互作蛋白[D]. 长沙: 湖南农业大学, 2015.
ZHU L P. Screening of interacting proteins with transcription factor OsDREBA5-1 using yeast two-hybrid system[D]. Changsha: Hunan Agricultural University, 2015.
[25] HERSHKO A, CIECHANOVER A. The ubiquitin system[J]. Annual Review of Biochemistry, 1998, 67(1): 425-479.
[26] VIERSTRA R D. The ubiquitin-26S proteasome system at the nexus of plant biology[J]. Nature Reviews Molecular Cell Biology, 2009, 10(6): 385-397.
[27] GLICKMAN M H, ADIR N. The proteasome and the delicate balance between destruction and rescue[J]. PLoS Biology, 2004, 2(1): e13.
[28] QIN F, SAKUMA Y, TRAN L S P, MARUYAMA K, KIDOKORO S, FUJITA Y, YAMAGUCHI-SHINOZAKI K. Arabidopsis DREB2A-interacting proteins function as RING E3 ligases and negatively regulate plant drought stress-resp¬onsive gene expression[J]. The Plant Cell, 2008, 20(6): 1693-1707.
[29] ZHANG N, YIN Y, LIU X, TONG S, XING J, ZHANG Y, YAO Y. The E3 ligase TaSAP5 alters drought stress responses by promoting the degradation of DRIP proteins[J]. Plant Physiology, 2017, 175(4): 1878-1892.
[30] BUESO E, RODRIGUEZ L, LORENZO-ORTS L, GONZALEZ-GUZMAN M, SAYAS E, MUÑOZ- BERTOMEU J, RODRIGUEZ P L. The single-subunit RING- type E3 ubiquitin ligase RSL 1 targets PYL 4 and PYR 1 ABA receptors in plasma membrane to modulate abscisic acid signaling[J]. The Plant Journal, 2014, 80(6): 1057-1071.
[31] BELDA-PALAZON B, RODRIGUEZ L, FERNANDEZ M A, CASTILLO M C, ANDERSON E M, GAO C, RODRIGUEZ P L. FYVE1/FREE1 interacts with the PYL4 ABA receptor and mediates its delivery to the vacuolar degradation pathway[J]. The Plant Cell, 2016, 28(9): 2291-2311.
[32] PAN W, ZHENG P, ZHANG C, WANG W, LI Y, FAN T, CAO S. The effect of ABRE BINDING FACTOR 4-mediated FYVE1 on salt stress tolerance in Arabidopsis[J]. Plant Science, 2020, 296: 110489.

