香蕉系统获得抗性相关基因对外源水杨酸的响应分析
段雅婕 郭志祥 曾莉 李舒 刘立娜 胡会刚 李伟明 白亭亭
摘 要:香蕉生產受多种病虫害和逆境胁迫的影响,由真菌病原引起的香蕉枯萎病、叶斑病和黑星病,细菌性病害软腐病和鞘腐病,以及非生物胁迫寒害等,是阻碍香蕉绿色可持续生产的严重问题。为探索香蕉生产上多种病害和寒害逆境的有效防控措施,本研究从外源水杨酸(SA)诱导植物系统抗性机理出发,通过实时荧光定量PCR(RT-qPCR)方法,分析外源水杨酸对香蕉系统抗性相关基因的诱导表达情况。结果显示,外源水杨酸能诱导感病品种‘巴西蕉’和抗病品种‘农科1号’香蕉植株内水杨酸合成途径关键基因显著上调表达,‘巴西蕉’中SK基因的相对表达量为对照的1.5倍以上,而‘农科1号’中该基因的相对表达量为对照的30倍以上;PAL基因在施用SA的‘巴西蕉’和‘农科1号’中整体表现出显著上调的趋势,在SA处理的‘农科1号’中,最高显著上调表达12.5倍,最低显著上调表达1.4倍,而在‘巴西蕉’中,最高显著上调表达3.1倍,最低显著上调表达1.7倍,SK和PAL 2个基因在抗病品种‘农科1号’中的上调幅度远远高于感病品种‘巴西蕉’;SA对CS和ICS基因的诱导上调幅度低于3倍,但在抗病品种‘农科1号’中的上调幅度仍高于感病品种‘巴西蕉’。信号传导途径转录因子NPR1和TGA、PR1基因显著上调表达,并且‘农科1号’比‘巴西蕉’诱导效果更明显。通过测定水杨酸处理的香蕉抗病相关基因对尖孢镰刀菌古巴专化型热带4号生理小种(Fusarium oxysporum f. sp. cubense tropical race 4, TR4)的响应情况,结果表明,TR4接种3 d可抑制‘巴西蕉’中多数PAL、NPR1和PR1基因的表达,但不会抑制‘农科1号’中多数PAL、NPR1和PR1基因的表达;在SA和TR4双重作用时,2个香蕉品种中的PAL、NPR1和PR1抗病相关基因被强烈诱导上调表达,PAL和POD防御酶活性显著增强。表明外源水杨酸具有诱导香蕉系统抗性抵御多种生物和非生物胁迫的潜在作用。本研究为香蕉生产上综合防控各种病害及提高香蕉抗逆性提供理论基础。
关键词:香蕉;诱导抗性;抗性基因;生物与非生物胁迫
中图分类号:S668.1 文献标识码:A
Analysis of Expression of Systemic Acquired Resistance-related Genes in Banana Induced by Exogenous Salicylic Acid
DUAN Yajie1, GUO Zhixiang2, ZENG Li2, LI Shu2, LIU Lina2, HU Huigang1, LI Weiming1, BAI Tingting2*
1. South Asia Tropical Crops Research Institute, Chinese Academy of Tropical Agriculture Sciences / Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs / Key Laboratory of Hainan Province for Postharvest Physiology and Technology of Tropical Horticultural Products, Zhanjiang, Guangdong 524091, China; 2. Agricultural Environment and Resources Institute, Yunnan Academy of Agricultural Sciences, Kunming, Yunnan 650205, China
Abstract: Banana production is affected by a variety of diseases, pests and abiotic stresses. Banana Fusarium wilt, sigatoka and black spot caused by fungal pathogens, soft rot and sheath rot caused by bacteria, abiotic stresses such as cold damage, are serious problems hindering banana green sustainable production. In order to explore effective prevention and control measures for a cultivar of diseases and cold stress in banana production, this study started from the mechanism of exogenous salicylic acid inducing plant system resistance, and analyzed the induced expression of exogenous salicylic acid (SA) on banana systemic resistance-related genes by the real-time fluorescent quantitative PCR (RT-qPCR) method. Results showed that exogenous SA could induce significant up-regulation of key genes in the SA synthesis pathway in banana plants. The relative expression level of SK gene in SA-treated susceptible ‘Brazilian’ was more than 1.5 folds than that in the control ‘Brazilian’, while the relative expression level of this gene in SA-treated tolerant ‘Nongke No. 1’ was more than 30 folds than that in the control ‘Nongke No. 1’. The PAL genes showed a significant up-regulation trend in both of SA-treated ‘Brazilian’ and ‘Nongke No. 1’. In the SA-treated ‘Nongke No. 1’, the highest significantly up-regulated expression of PAL was 12.5 folds, and the lowest significantly up-regulated expression was 1.4 folds. While in SA-treated ‘Brazilian’, the highest significantly up-regulated expression of PAL was 3.1 folds and the lowest significantly up-regulated expression was 1.7 folds. The up-regulation of SK and PAL genes in the tolerant cultivar ‘Nongke No. 1’ treated with SA was much higher than that in the susceptible cultivar ‘Brazilian’ treated with SA. SA induced up-regulation of CS and ICS genes by no more than 3 folds, but it still showed that the up-regulation in the tolerant cultivar ‘Nongke No. 1’ was higher than that in the susceptible cultivar ‘Brazilian’. NPR1, TGA, and PR1 genes were induced significantly up-regulated in both two cultivars. And ‘Nongke No. 1’ had a more obvious induction effect than ‘Brazilian’. The response of TR4-resistance genes in SA-treated bananas was also determined. Results showed that TR4 inoculation for 3 days could inhibit the expression of most PAL, NPR1 and PR1 genes in ‘Brazilian’, but not in ‘Nongke No. 1’. Under the dual treatment of SA and TR4, the TR4-resistance genes of PAL, NPR1 and PR1 in the two banana cultivars were strongly induced to be up-regulated. The activities of PAL and POD defense enzymes were significantly enhanced. This indicated that exogenous SA has the potential to induce systemic resistance in bananas against a variety of biotic and abiotic stresses. This research provides a theoretical basis for the comprehensive prevention and control of various diseases in banana production and the improvement of banana resistance.
Keywords: banana; induced resistance; resistant gene; biotic and abiotic stresses
DOI: 10.3969/j.issn.1000-2561.2022.01.002
香蕉是世界上贸易量最大的水果,也是非洲和南美洲等地数亿人赖以为生的粮食作物,我国是世界香蕉生产第二大国,也是世界香蕉消费第一大国[1-2]。香蕉生产上受多种限制因素的影响,目前全球香蕉产业首要面临的最严重威胁是香蕉枯萎病,该病由尖孢镰刀菌古巴专化型热带4号生理小种(Fusarium oxysporum f. sp. cubense tropical race 4, TR4)引起,到2019年5月,香蕉枯萎病在我国广东、海南、广西、福建和云南的香蕉主产区均有发生,生产上缺乏理想的防控技术,主要原因是目前未发现对枯萎病完全免疫的香蕉品种;化学农药和土壤消毒剂应用于大田的防治效果不明显,并且对土壤生态系统破坏较大;生物拮抗菌的应用可以直接抑制土壤中病原菌的生长蔓延,延缓香蕉枯萎病的发病时间,但拮抗菌在土壤中不易定殖的问题限制了其对枯萎病的防控效果;近年研发的香蕉枯萎病综合防控措施在香蕉枯萎病防控中取得了初步的效果[1],但也因防控技术复杂而未完全解决香蕉枯萎病的问题。
除香蕉枯萎病外,由真菌病原菌侵染引起的香蕉叶斑病和黑星病、细菌性软腐病和鞘腐病、非生物胁迫如寒害等,也是阻碍香蕉绿色生产的严重问题,尤其我国绝大部分香蕉产区都易受冬春寒流的侵袭,往往致使大规模蕉园遭受寒害影响[3],而轻微的寒害致使香蕉组织破裂,又增加了病害的发生,面对上述诸多问题,在香蕉生产上尚无统一有效的解决方法。诱导抗病性和抗逆性是植物潜在的免疫机制,可提高对各种胁迫的抵抗能力,是一种更为主動、经济、有效的抗性反应方式,具有重要的理论研究意义和实际应用价值[4]。
植物内源水杨酸(SA)是诱导植物产生系统获得抗性(SAR)的信号物质,它在植物体内具有多种生理调节作用,外施SA可诱导植物体内SA的积累,提高植物对多种生物和非生物胁迫的抵抗力[5-13]。SA在植物中具有2种合成途径:一种是异分支酸合酶(ICS)途径,分支酸经由ICS催化形成异分支酸,然后再由异分支酸丙酮酸裂解酶催化转变为水杨酸[14];另一种是苯丙氨酸解氨酶(PAL)途径,苯丙氨酸被PAL催化产生肉桂酸,肉桂酸经由几步催化转化成水杨酸[15]。病程相关基因非表达子(NPR1)是植物SAR信号传导过程关键的转录因子,位于SA合成途径的下游,NPR1与TGA等转录因子相互作用激活包括病程相关蛋白(PR)在内的许多抗病相关蛋白的产生[16];NPR1同时在植物低温胁迫应答中,通过与其他转录因子作用,促进低温诱导的热胁迫应答基因的表达,从而提高植物的低温适应能力[17-18]。因此,NPR1是介导植物生物胁迫与非生物胁迫的重要调控因子。
SA诱导抗性机制对农作物具有重要的保护作用,且SA具有高效、广谱、对环境无害、使用简单、成本低廉等优点。但是,国内外研究往往把SA对植物的保护作用局限于对某一种病害的抗性研究或非生物胁迫的抗逆性研究,尚未从整体水平研究SA对多种生物与非生物胁迫的系统诱导抗性。本研究基于前期转录组数据,获得香蕉水杨酸合成途径和诱导抗性相关的关键基因序列,在此基础上,对香蕉幼苗外施水杨酸,掌握香蕉水杨酸途径相关基因诱导表达变化情况,为系统提高香蕉同时对多种生物与非生物胁迫的抗性提供理论基础。
1 材料与方法
1.1 材料
‘巴西蕉’(Musa acuminate L. AAA group, ‘Brazilian’)和‘农科1号’(Musa acuminate L. AAA group, ‘Nongke No.1’)组培苗购于中国科学院华南植物研究所香蕉组培中心,将上述组培苗栽种于盛有无菌泥炭土和椰糠(比例为1∶1)的直径10 cm的盆钵内,置于温室中培养约80 d,选择6~7片叶且长势一致的香蕉幼苗用于SA处理,实验期间温室的气温为25~37℃,每月施用1次复合肥,保障香蕉生长所需的营养。
1.2 方法
1.2.1 实验设计及样品收集 称取SA(酷来搏CS9641)10 g溶于甲醇配成300 mmol/L母液,再将母液溶于单蒸水中配成300 μmol/L的工作液。对‘巴西蕉’和‘农科1号’香蕉幼苗采用300 μmol/L的SA进行灌根处理,每株植株直接浇灌50 mL水杨酸溶液,每2 d处理1次,连续处理5次,SA未处理的对照每盆浇灌等量的清水,共计2个处理:SA处理的‘巴西蕉’和SA处理的‘农科1号’;2个对照:清水处理的‘巴西蕉’和清水处理的‘农科1号’,每个处理和对照均设5个生物重复。共重复3次。分别在处理3次(SA-3)和5次(SA-5)1 d后,采集根组织样品,样品置于–80℃冰箱,保存备用。
SA连续处理5次后间隔1 d,采用伤根灌根法接种TR4于‘巴西蕉’和‘农科1号’香蕉幼苗,接种浓度为5×106 CFU/mL。分别采集清水处理的对照(CK)、接种TR4后3 d(TR4)、SA处理加TR4接种3 d(SA+TR4)的根组织样品。每个处理和对照均设5个生物重复,样品置于–80℃冰箱,保存备用。
1.2.2 酶活测定 参照过氧化物酶(POD)和多酚氧化酶(PPO)粗酶液的抽提方法[19-21]:取0.5 g植物材料,加入5 mL的0.05 mol/L磷酸盐缓冲液(pH 7.0,含1%聚乙烯吡咯烷酮),冰浴条件下充分研磨后转移至离心管中,4℃在12 000 r/min条件下离心20 min,上清液即为防御酶粗提取液。苯丙氨酸解氨酶(PAL)粗酶液的抽提方法:取0.5 g植物材料,加入5 mL的0.1 mol/L硼酸缓冲液(pH 8.8,含0.3 g/L巯基乙醇),冰浴条件下充分研磨后转移至离心管中,4℃在12 000 r/min条件下离心20 min,上清液即为PAL酶粗提取液。
POD酶活测定参照SCHAFFRATH等[19]的方法,在反应体系中加有0.1 mL粗酶液、2.8 mL 0.05 mol/L磷酸盐缓冲液(pH 7.0,含18 μmol/L愈伤木酚),再加入0.1 mL 0.1%(V/V)的过氧化氢启动反应,在470 nm波长下测定△OD值30 s内的变化。以每30 s增加0.01为1个酶活力单位(U),酶活性以U/mg表示。每个样品重复测定3次。
PAL酶活性测定参照KOUKOL等[20]的方法进行,在反应体系中加入1 mL酶粗提取液、2 mL硼酸缓冲液、1 mL浓度为0.02 mol/L的苯丙氨酸溶液,于30℃水浴30 min,随后加入0.2 mL的浓度为6 mol/L的盐酸终止反应,用不含有酶液的混合液作为参照,290 nm下测定吸光光度。以每分钟增加0.01为1个酶活力单位(U),酶活性以U/mg表示,每个样品重复测定3次。
PPO酶活性测定参照JIANG等[21]的方法进行,将0.2 mL的酶粗提液加入到3 mL浓度为100 mmol/L的邻苯二酚溶液,在398 nm下测定吸光度的增加值,每30 s记录1次OD值,以每30 s增加0.01为1个酶活力单位(U),酶活性以U/mg表示。每个样品重复测定3次。
1.2.3 RNA抽提及cDNA合成 根组织总RNA采用德国QIAGEN公司生产的植物总RNA提取试剂盒(Code No. 74903)提取,用Thermo核酸蛋白测定仪(NanoDrop 2000c)进行RNA浓度检测,质量合格的RNA用于下一步cDNA合成。以RNA为模板,采用TaKaRa反转录试剂盒(Code No. RR047A)反转录成cDNA链。
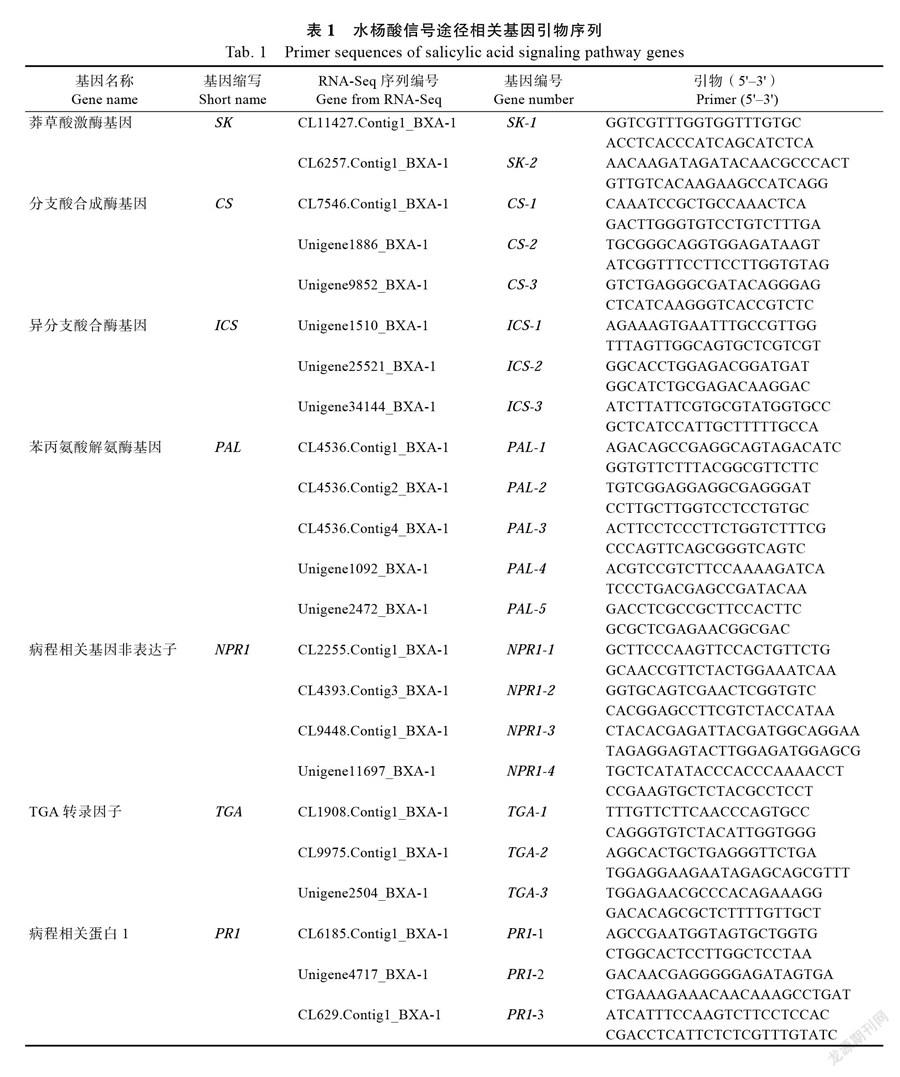
1.2.4 引物设计与基因相对表达量检测 根据本实验室获得的转录组测序结果(SRA accession number SRP026137),获得水杨酸信号传导途径关键基因和病程相关蛋白基因,以Primer 5.0软件设计特异性荧光定量引物(表1),实时荧光定量反应中内参基因选用香蕉RPS2基因[22]。以扩增效率95%<E<105%、相关性R2≥0.99、溶解曲线为单峰曲线为引物筛选标准,引物序列和退火温度见表1。使用荧光定量PCR仪(TaKaRa公司Thermal Cycler Dice Real Time System, TP700)对基因进行定量分析,荧光定量试剂盒为SYBRP remix Ex TaqTM(TaKaRa公司)。每个测定样品中的每个基因设置3个技术重复,以2-∆∆CT法计算各基因的表达量。
1.3 数据处理
使用SPSS 20.0软件单因素方差分析法对不同处理间各基因的相对表达量进行分析,在5%水平(P<0.05)上计算显著差异,使用Excel 2010软件进行制表和作图。
2 结果与分析
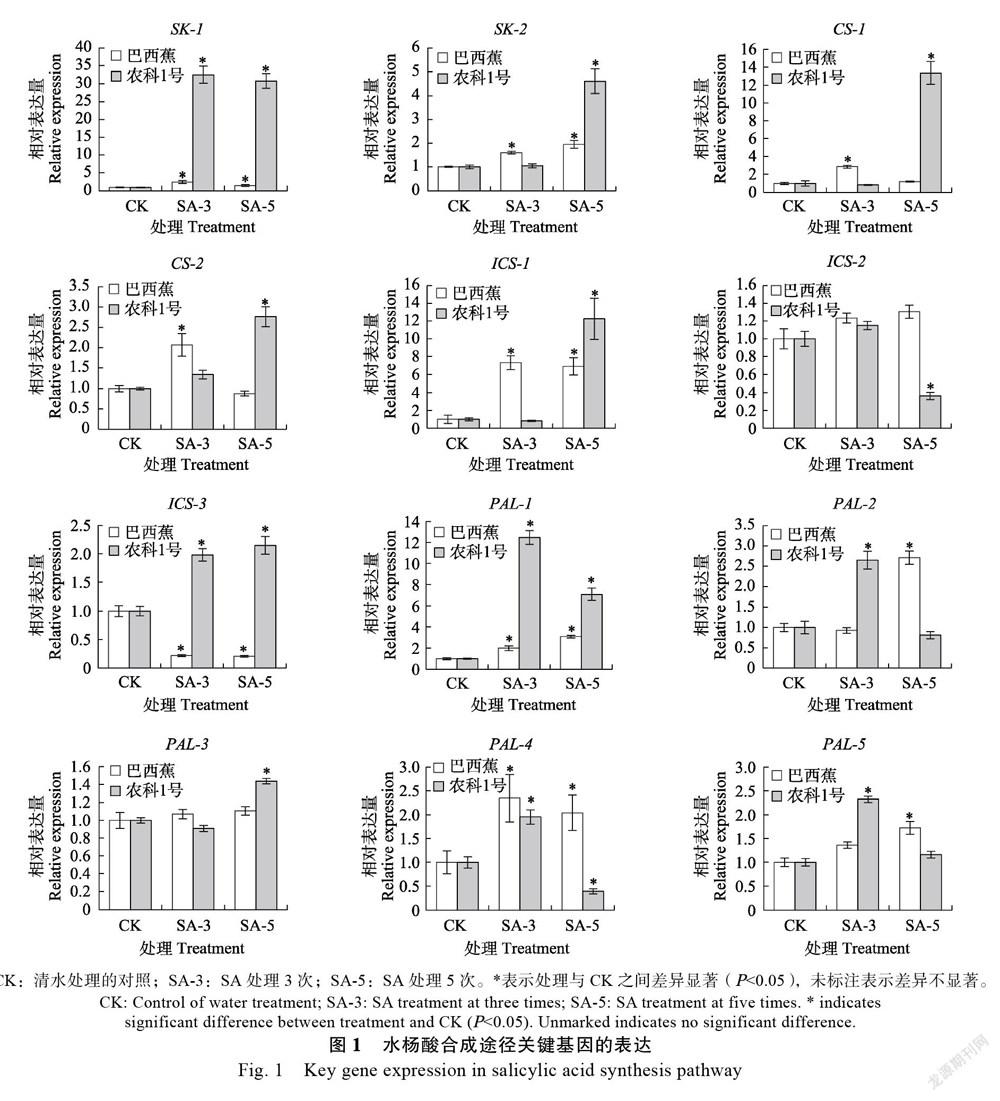
2.1 SA生物合成途径关键基因的表达分析
外源SA能诱导植物体内SA信号途径中正调控基因的表达,而这些基因的表达又会导致SA的迅速积累,从而形成一个SA信号的反馈放大回路[23]。植物体内SA生物合成是经莽草酸途径来完成的,莽草酸在莽草酸激酶(shikimate kinase, SK)和分支酸合成酶(CS)等酶的作用下转变为分支酸,再经异分支酸合酶(ICS)途径和苯丙氨酸解氨酶(PAL)途径合成SA。研究结果如图1所示,‘巴西蕉’和‘农科1号’香蕉幼苗施用SA 3次和5次时,2个SK基因均表现出显著上调表达,‘巴西蕉’中的SK-1基因相对表达量为对
照的1.5倍以上,而‘农科1号’中该基因的相对表达量为对照的30倍以上,上调幅度远远高于感病品种‘巴西蕉’;SK-2基因的相对表达量在‘巴西蕉’被SA处理3次和5次时均显著上调表达,为对照的1.6倍以上,在SA处理5次的‘农科1号’中,该基因相对表达量为对照的4.6倍。‘巴西蕉’中2个CS基因在SA处理3次时表现出显著上调表达,相对表达量是对照的2.1倍以上;而‘农科1号’中2个CS基因在SA处理5次时表现出显著上调表达,相对表达量是对照的2.8倍以上。SA处理的‘农科1号’中,ICS-1和ICS-3的相对表达量显著上调表达,是对照的2.1倍以上,而ICS-2显著下调表达;SA处理的‘巴西蕉’中,只有ICS-1表现为显著上调表达。PAL基因在施用SA的‘巴西蕉’和‘农科1号’中整体表现出了显著上调的趋势,5个PAL基因在SA处理的‘农科1号’中,最高显著上调表达12.5倍,最低显著上调表达1.4倍,而在‘巴西蕉’中,最高显著上调表达3.1倍,最低显著上调表达1.7倍。这些结果说明SA生物合成途径关键基因在外源SA处理的2个香蕉品种中表达差异较大,在抗病品种‘农科1号’中相对表达量要高于感病品种‘巴西蕉’。
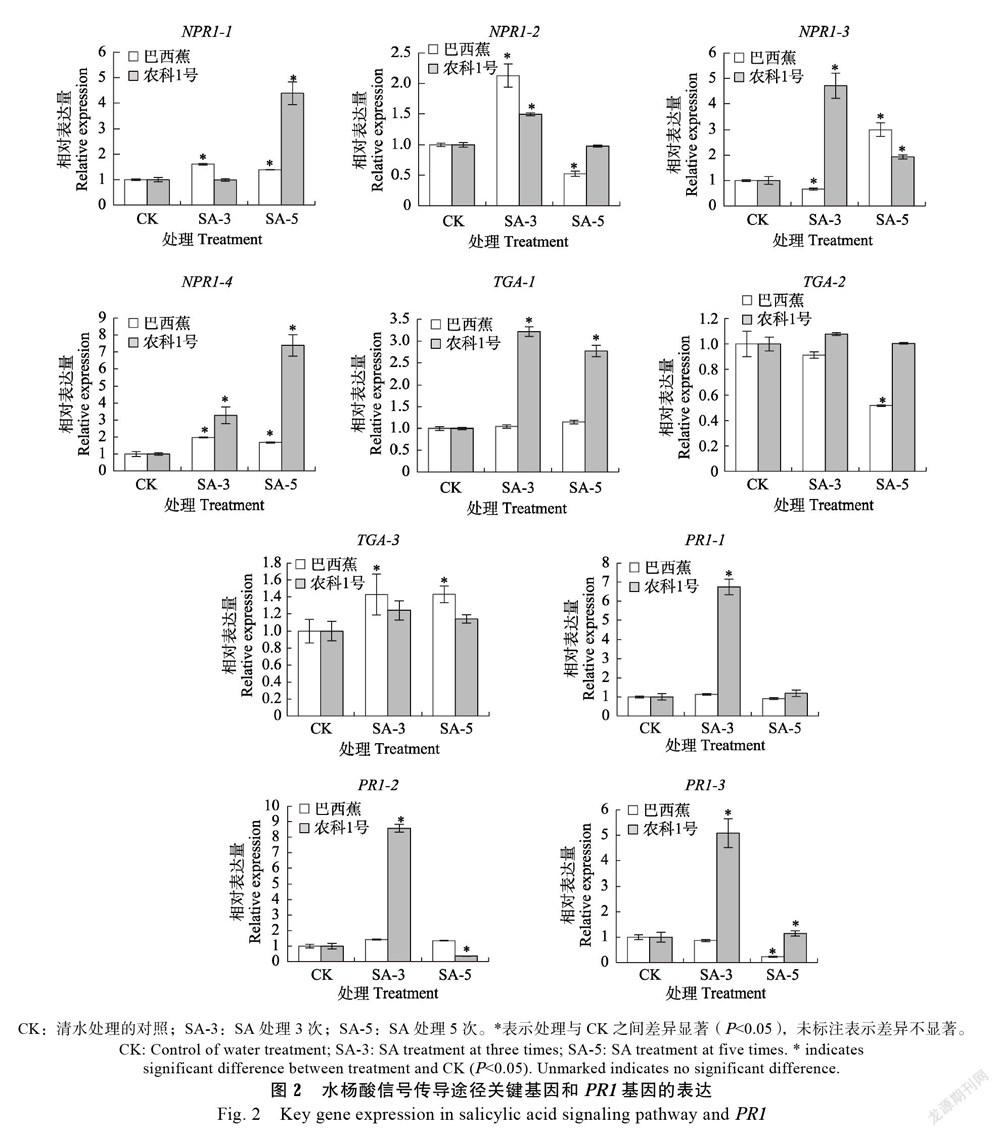
2.2 SA对SA信号传导中关键转录因子表达水平的影响
NPR1位于SA的下游,与TGA等转录因子相互作用,调控很多抗病相关基因的表达[16, 24]。研究测定外源SA处理后香蕉幼苗中SA信号传导中关键调控因子相关基因的表达变化情況(图2),结果显示3个NPR1基因,即NPR1-1、NPR1-2和NPR1-4在SA处理3次和5次的‘巴西蕉’中均显著上调表达,最高上调表达2.1倍,最低上调表达1.4倍,NPR1-3基因在SA处理3次的‘巴西蕉’中下调表达,但在SA处理5次的‘巴西蕉’中显著上调表达;NPR1在SA处理的‘农科1号’中整体表现为显著上调表达,最高上调表达7.4倍,最低上调表达1.5倍,但NPR1-1、NPR1-3和NPR1-4在‘农科1号’中的上调表达幅度要高于‘巴西蕉’,说明外源SA更易诱导抗病品种‘农科1号’中NPR1基因的上调表达。SA处理后,TGA-1在‘农科1号’中表现为显著上调表达,上调表达为对照的2.8倍以上,在‘巴西蕉’中无显著差异变化;TGA-2在‘巴西蕉’中表现为显著下调表达;TGA-3在SA处理的‘巴西蕉’中表现为显著上调表达,上调表达为对照的1.4倍,说明2个香蕉品种中,TGA转录因子对外源SA诱导具有不同的应答响应。
2.3 SA对病程相关蛋白1基因(PR1)表达的影响
最初发现病程相关蛋白是由于其在抗病过程中起着关键作用,但大量研究表明PR1基因广泛参与高盐、干旱和低温等逆境胁迫应答反应[25-26]。对水杨酸处理后的2个香蕉品种PR1基因的相对表达量进行检测(图2),结果发现2个PR1基因在SA处理3次的‘农科1号’中较对照显著上调表达,最高上调表达8.6倍,最低上调表达5.0倍;在SA处理5次的‘农科1号’中相对表达量降低或无差异表达。然而,‘巴西蕉’在SA处理3次和5次时几乎无显著表达变化,甚至PR1-3在SA处理5次时相对表达量降低,表明相对于‘巴西蕉’,‘农科1号’的PR1基因更易受外源SA诱导显著上调表达。
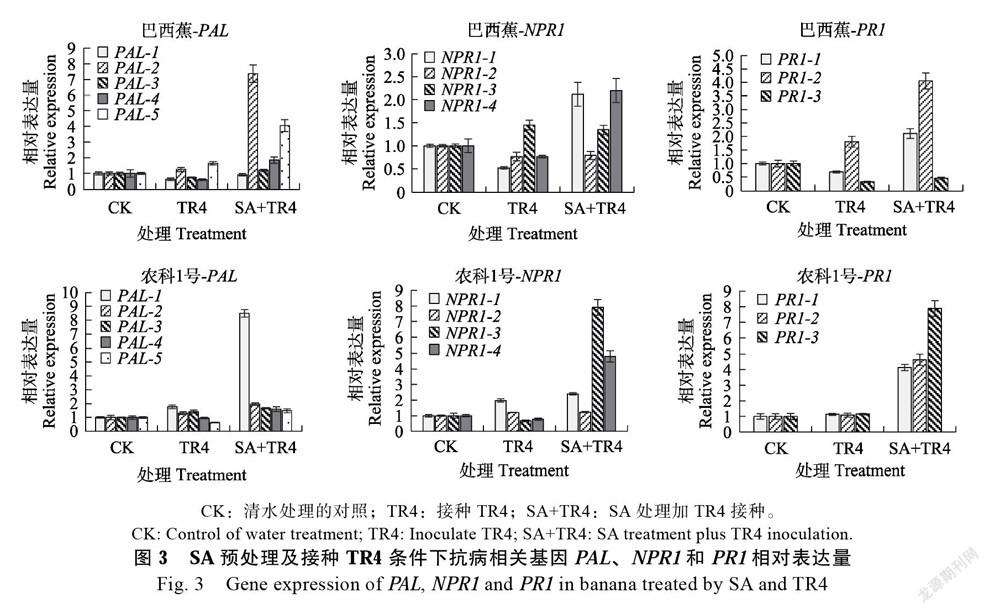
2.4 SA预处理诱导TR4侵染下香蕉抗病相关基因表达情况
对SA预处理后接种TR4的香蕉植株内抗病相关基因PAL、NPR1和PR1进行定量分析(图3),‘巴西蕉’受TR4侵染后大部分PAL、NPR1和PR1基因表现为下调表达,具体为3个PAL基因、3个NPR1基因和2个PR1基因显示出下调表达,其他基因PAL-2、PAL-5、NPR1-3和PR1-2为上调表达,上调表達倍数均不超过2;SA预处理的‘巴西蕉’受TR4侵染,多数基因表现为上调表达,PAL-2、PAL-5、NPR1-2、NPR1-4、PR1-1和PR1-2共6个基因的上调表达倍数均高于2倍,其中2个基因上调表达倍数高于4倍,说明TR4侵染‘巴西蕉’抑制多数抗病相关基因的表达,而SA则能激活抗病相关基因,使其在TR4侵染时上调表达。相比‘巴西蕉’,只接种TR4的‘农科1号’香蕉中抗病相关基因整体表现为轻微上调或无差异表达,SA预处理再接种TR4的香蕉中,PAL-1、NPR1-1、NPR1-3、NPR1-4、PR1-1、PR1-2和PR1-3共7个基因上调表达倍数均高于2倍,其中6个基因上调表达倍数高于4倍,说明‘农科1号’经SA预处理,再受TR4侵染时植株中的抗病相关基因也能被诱导上调表达,且诱导效果优于‘巴西蕉’。
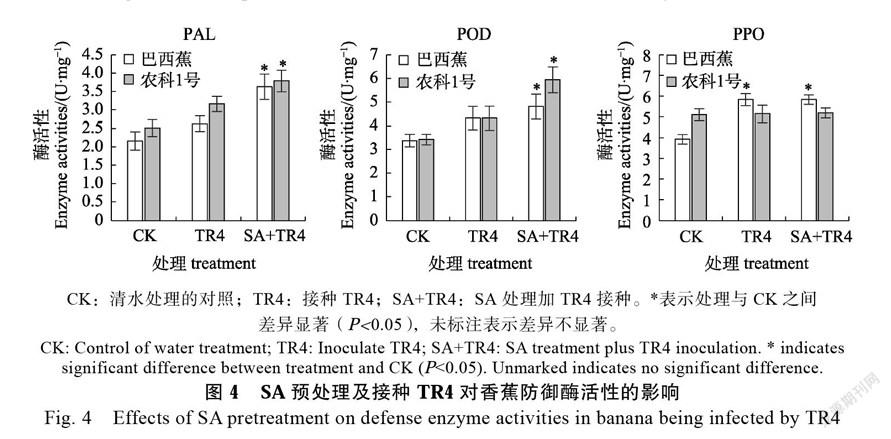
2.5 SA预处理对TR4侵染下香蕉PAL和POD酶活性的影响
对SA预处理后接种TR4的香蕉植株防御酶POD、PPO和PAL进行酶活性测定(图4),接种TR4的‘巴西蕉’和‘农科1号’植株中PAL和POD酶活性与对照相比略有上升,而先用SA处理再接种TR4的2个香蕉品种中PAL和POD酶
活显著升高;‘农科1号’对照植株中PPO酶活性高于‘巴西蕉’对照,但TR4接种和SA处理后接种TR4两个处理中‘农科1号’植株内PPO酶活性与对照相比无显著差异,TR4接种或SA处理后接种TR4的‘巴西蕉’植株内PPO活性比对照显著增高,说明SA预处理增强TR4侵染下香蕉的PAL和POD酶活性。
3 讨论
水杨酸(SA)作为一种信号分子在植物免疫反应中发挥着重要作用。研究表明SA参与植物抗病、抗寒等生物和非生物胁迫应答反应,对保护农作物具有重要意义。本研究通过实时荧光定量PCR方法测定外源水杨酸处理后2个香蕉品种‘巴西蕉’和‘农科1号’中水杨酸合成代谢途径关键基因的表达变化情况,结果显示外源水杨酸能诱导香蕉植株内水杨酸合成途径关键基因、转录因子NPR1和TGA、PR1基因显著上调表达,ENDAH等[27]将5 mmol/L的水杨酸喷施于香蕉叶部,能够诱导抗病品种‘GCTCV-218’和感病品种‘威廉姆斯’植株中NPR1基因上调表达,同
时检测到PR基因的表达量增加,NPR1在传导植物系统获得抗性和促进低温诱导的热胁迫从而提高植物的抗病和抗逆能力中具有重要作用[17, 23],PR1基因编码的PR1蛋白广泛存在于寄主植物中,具有限制真菌病原入侵和保护植物抵御逆境胁迫的功能[28]。因此,推测外源水杨酸能够激活香蕉根系水杨酸信号途径,诱导香蕉产生系统抗性,可在一定程度上保护香蕉免受多种病原菌的侵染和寒害等胁迫的影响。我国香蕉生产上面临枯萎病、黑星病、叶斑病、软腐病和寒害等诸多限制因素,黑星病和叶斑病以化学防治为主,然而,大量化学农药的使用会导致农田面源污染;香蕉枯萎病和软腐病属土传病害,尤其是香蕉枯萎病为香蕉生产上最主要的限制因子,只有极少数蕉园通过抗枯萎病品种和使用综合防控措施将香蕉枯萎病的发病率降低到可接受的水平,但同时又出现了其他问题,即控制住枯萎病,细菌性软腐病又上升成为严重威胁,已有研究报道外源水杨酸可诱导香蕉对枯萎病的系统抗性[29],也能诱导寄主植物对大斑病、黑星病、稻瘟病、软腐病等的抗性[30-33];低温胁迫下低浓度的SA预处理能提高香蕉幼苗保护酶如SOD、CAT和APX的活性,降低活性氧的积累,对香蕉幼苗细胞结构也具有一定的保护作用,从而提高了香蕉的抗寒性[34]。这些结果表明,水杨酸具有保护香蕉防控多种生物和非生物胁迫的潜在作用。
‘农科1号’香蕉是选育出的对香蕉枯萎病具有一定抗性的品种,该品种对香蕉细菌性软腐病也有中等抗性[35],本研究中,相比‘巴西蕉’,SA处理的‘农科1号’中水杨酸合成及抗病相关基因诱导表达程度更高。香蕉枯萎病是我国香蕉生产上最为严重、最难防治的一种毁灭性病害,测试水杨酸处理的香蕉抗病相关基因对TR4的响应情况,结果表明,TR4接种3 d后可抑制‘巴西蕉’中多数PAL、NPR1和PR1基因的表达,但不会抑制‘农科1号’中多数PAL、NPR1和PR1基因的表达;在水杨酸和TR4双重作用时,2个香蕉品种中的PAL、NPR1和PR1抗病相关基因被强烈诱导上调表达,PAL和POD防御酶活性显著增强,与WANG等[29]报道的水杨酸预处理降低病情指数的结果相符,这些结果说明病原菌侵染前水杨酸预处理对提高香蕉抗病性具有重要的作用,而抗病品种‘农科1号’系统抗病性相关基因更强烈地被诱导表达,推测其系统诱导抗病能力优于‘巴西蕉’。本研究从系统获得抗性出发,掌握水杨酸对香蕉的系统诱导抗性相关基因表达情况,为香蕉生产上综合防控技术的研发提供理论基础,但水杨酸诱导香蕉抵抗多种病害侵染和逆境胁迫的综合能力,需在温室和田间进一步验证,明确不同香蕉品种及不同生育期激发系统抗性诱导所需的水杨酸浓度,以期综合不同防控措施达到最优的抵抗多种病害侵染及逆境胁迫的效果。
参考文献
[1] 李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报, 2019, 40(5): 128-136.
LI H P, LI Y F, NIE Y F. Research status of occurrence and control of Fusarium wilt of banana[J]. Journal of South China Agricultural University, 2019, 40(5): 1-9. (in Chinese)
[2] NAYAR N M. The bananas: botany, origin, dispersal[M]. In: JANICK J. Horticultural Reviews: Volume 36. Hoboken, New Jersey: John Wiley and Sons, 2010.
[3] 王安邦, 金志强, 刘菊华, 贾彩虹, 张建斌, 苗红霞, 徐碧玉. 香蕉寒害研究现状及展望[J]. 生物技術通报, 2014(8): 28-33.
WANG A B, JIN Z Q, LIU J H, JIA C H, ZHANG J B, MIAO H X, XU B Y. The current situation and prospects of banana chilling stress[J]. Biotechnology Bulletin, 2014(8): 28-33. (in Chinese)
[4] 李琳琳, 李天来, 姜国斌, 金 华, 邹吉祥. 外源Ca2+对水杨酸诱导番茄抗灰霉病的增效机制[J]. 应用生态学报, 2015, 26(11): 3497-3502.
LI L L, LI T L, JIANG G B, JIN H, ZOU J X. Synergistion mechanism of exogenous Ca2+ to SA-induced resistance to Botrytis cinerea in tomato[J]. Chinese Journal of Applied Ecology, 2015, 26(11): 3497-3502. (in Chinese)
[5] VLOT A C, DEMPSEY D A, KLESSIG D F. Salicylic acid, a multifaceted hormone to combat disease[J]. Annual Review of Phytopathology, 2009, 47: 177-206.
[6] FU Z Q, DONG X. Systemic acquired resistance: turning local infection into global defense[J]. Annual Review of Plant Biology, 2013, 64: 839-863.
[7] SENARATNA T, TOUCHELL D, BUNN E, DIXON K. Acetyl salicylic acid (aspirin) and salicylic acid induce multiple stress tolerance in bean and tomato plants[J]. Plant Growth Regulation, 2000, 30(2): 157-161.
[8] DAT J F, LOPEZ-DELGADO H, FOYER C H, SCOTT I M. Parallel changes in H2O2 and catalase during thermotolerance induced by salicylic acid or heat acclimation in mustard seedlings[J]. Plant Physiology, 1998, 116(4): 1351-1357.
[9] MISHRA A, CHOUDHURI M A. Effects of salicylic acid on heavy metal-induced membrane deterioration mediated by lipoxygenase in rice[J]. Biologia Plantarum, 1999, 42(3): 409-415.
[10] 蔡新忠, 郑 重, 宋凤鸣. 水杨酸对水稻幼苗抗瘟性的诱导作用[J]. 植物病理学报, 1996(1): 9-12, 14.
CAI X Z, ZHENG Z, SONG F M. Effect of salicylic acid on the inductions of resistance to rice seedling blast[J]. Acta Phytopathologica Sinica, 1996(1): 9-12, 14. (in Chinese)
[11] 刘凤权, 王金生. 水杨酸诱导水稻幼苗抗白叶枯病研究[J]. 植物保护学报, 2000(1): 47-52.
LIU F Q, WANG J S. Preliminary study on resistance of rice seedling to leaf blight induced by salicylic acid[J]. Journal of Plant Protection, 2000(1): 47-52. (in Chinese)
[12] 王 铮, 顾毓敏, 潘义宏, 李兴勇, 李 彪, 郑 武, 邵小东. 水杨酸不同施用方式对诱导烟草抗病性的影响[J]. 植物保護, 2016, 42(4): 236-241.
WANG Z, GU Y M, PAN Y H, LI Y X, LI B, ZHENG W, SHAO X D. Effects of salicylic acid on the induced disease resistance of tobacco under different ways of application[J]. Plant Protection, 2016, 42(4): 236-241. (in Chinese)
[13] 金晓弟. 水杨酸浸种对低温胁迫下二叶期冬小麦生理的影响[J]. 山西农业科学, 2019, 47(10): 1687-1690, 1708.
JIN X D. Effects of salicylic acid soaking seeds on physiology of winter wheat in two-leaf stage under low temperature stress[J]. Journal of Shanxi Agricultural Sciences, 2019, 47(10): 1687-1690, 1708. (in Chinese)
[14] WILDERMUTH M C, DEWDNEY J, WU G, AUSUBEL F M. Isochorismate synthase is required to synthesize salicylic acid for plant defence[J]. Nature, 2001, 414(6863): 562-565.
[15] LEE H I, LEON J, RASKIN I. Biosynthesis and metabolism of salicylic acid[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(10): 4076-4079.
[16] KINKEMA M. Nuclear localization of NPR1 is required for activation of PR gene expression[J]. Plant Cell, 2000, 12(12): 2339-2350.
[17] 田 云. 水杨酸受体NPR1在植物低温胁迫应答中的新功能[J]. 生物学杂志, 2018, 35(6): 9-10.
TIAN Y. The novel function of SA receptor NPR1 in cold response in plant[J]. Journal of Biology, 2018, 35(6): 9-10. (in Chinese)
[18] OLATE E, JIMÉNEZ-GÓMEZ J M, HOLUIGUE L, SALINAS J. NPR1 mediates a novel regulatory pathway in cold acclimation by interacting with Hsfa1 factors[J]. Nature Plants, 2018, 4: 811-823.
[19] SCHAFFRATH U, SCHEINPFLUG H, REISENDR H J. An elicitor from Pyricularia oryzae induces resistance responses in rice: Isolation, characterization and physiological properties[J]. Physiology and Molecular Pathology, 1995(46): 293-307.
[20] KOUKOL J, CONN E E. The metabolism of aromatic compounds in higher plants IV. Purification and properties of the phenylalanine deaminase of Hordeum vulgare[J]. Journal of Biological Chemistry, 1961, 236(10): 2692-2698.
[21] JIANG A L, TIAN S P, XU Y. Effects of controlled atmospheres with high-O2 or high-CO2 concentrations on postharvest physiology and storability of “napoleon” sweet cherry[J]. Acta Botanica Sinica, 2002, 44(8): 925-930.
[22] CHEN L, ZHONG H Y, KUANG J F, LI J G, LU W J, CHEN J Y. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta, 2011, 234: 377-390.
[23] 汪 尚, 徐鹭芹, 张亚仙, 曾后淸, 杜立群. 水杨酸介导植物抗病的研究进展[J]. 植物生理学报, 2016, 52(5): 581-590.
WANG S, XU L Q, ZHANG Y X, ZENG H Q, DU L Q. Recent advance of salicylic acid signaling in plant disease resistance[J]. Plant Physiology Journal, 2016, 52(5): 581-590. (in Chinese)
[24] ZHENG Z, QUALLEY A, FAN B, DUDAREVA N, CHEN Z. An Important role of a BAHD acyl transferase-like protein in plant innate immunity[J]. The Plant Journal: for Cell and Molecular Biology, 2009, 57: 1040-1053.
[25] SEO P J, LEE A K, XIANG F, PARK C. Molecular and functional profiling of Arabidopsis pathogenesis-related genes: Insights into their roles in salt response of seed germination[J]. Plant & Cell Physiology, 2008, 49(3): 334-344.
[26] SEO P J, KIM M J, PARK J, KIM S, JEON J, LEE Y, KIM J, PARK C. Cold activation of a plasma membrane-tethered NAC transcription factor induces a pathogen resistance response in Arabidopsis[J]. The Plant Journal, 2010, 61(4): 661-671.
[27] ENDAH R, BEYENE G, KLGGUNDU A, BERG N V D, SCHLÜTER U, KUNERT K. Elicitor and Fusarium-induced expression of NPR1-like genes in banana[J]. Plant Physiology and Biochemistry, 2008, 46(11): 1007-1014.
[28] LC V L, EA V S. The families of pathogenesis related proteins, their activities, and comparative analysis of PR1 type proteins[J]. Physiological and Molecular Plant Pathology, 1999, 55: 85-97.
[29] WANG Z, JIA C, LI J, HUANG S, XU B, JIN Z. Activation of salicylic acid metabolism and signal transduction can enhance resistance to Fusarium wilt in banana (Musa acuminata L. Aaa Group, Cv. Cavendish)[J]. Functional & Integrative Genomics, 2015, 15(1): 47-62.
[30] 張 莹, 王艳辉, 郝 敏, 贾 慧, 韩建民, 董金皋. 水杨酸诱导对玉米大斑病抗性的影响[J]. 农业生物技术学报, 2008(3): 501-507.
ZHANG Y, WANG Y H, HAO M, JIA H, HAN J M, DONG J H. Effect of salicylic acid on resistance to Exserohilum turcicum[J]. Journal of Agricultural Biotechnology, 2008(3): 501-507. (in Chinese)
[31] 李红玉, 郭金魁, 周功克. 水杨酸诱导黄瓜抗黑星病抗性的部位差异和时效性[J]. 应用与环境生物学报, 1999(6): 640-642.
LI H Y, GUO J K, ZHOU G K. Position difference and time course of cucumber resistance to Cladosporium cucumerinum induced by salicylic acid[J]. Chinese Journal of Applied and Environmental Biology, 1999(6): 640-642. (in Chinese)
[32] 王瑞霞, 王振中, 纪春艳, 董章勇. 水杨酸诱导水稻抗菌物质对稻瘟病菌的抑制作用[J]. 华中农业大学学报, 2011, 30(2): 193-196.
WANG R X, WANG Z Z, JI C Y, DONG Z Y. Inhibitory activity of antibiotic substances extraction induced by salicylic acid in rice leaves against Magnaporthe grisea[J]. Journal of Huazhong Agricultural University, 2011, 30(2): 193-196. (in Chinese)
[33] LÓPEZMMÓPEZ M J, LIÉBANA E, MARCILLA P, BELTRÁ R. Resistance induced in potato tubers by treatment with acetylsalicylic acid to soft rot produced by Erwinia carotovora subsp. carotovora[J]. Journal of Phytopathology, 1995, 143: 719-724.
[34] KANG G Z, WANG Z X, XIA K F, SUN G C. Protection of ultrastructure in chilling-stressed banana leaves by salicylic acid[J]. Journal of Zhejiang University Science B (Biomedicine & Biotechnology), 2007(4): 277-282.
[35] 袁 月, 陈雪凤, 李华平, 梁家杰, 刘琼光. 香蕉细菌性软腐病菌的寄主范围及香蕉品种的抗性测定[J]. 华南农业大学学报, 2013, 34(1): 23-27.
YUAN Y, CHEN X F, LI H P, LIANG J J, LIU Q G. Symptoms of some host plants infected by pathogen of banana soft rot[J]. Journal of South China Agricultural University, 2013, 34(1): 23-27. (in Chinese)

