甘蔗镰孢菌碳水化合物结合模块效应基因Fs11724的分离鉴定及功能分析
李慧雪 黄振 周宇明 暴怡雪 姚姿婷 张木清 姚伟





摘 要:甘蔗鐮孢菌(Fusarium sacchari)是引起毁灭性病害甘蔗梢腐病(sugarcane pokkah boeng disease, PBD)的主要病原菌之一。病原菌分泌的效应蛋白在病原与植物互作中发挥至关重要的作用。本研究基于课题组前期甘蔗镰孢菌全基因测序数据,设计基因特异性引物,通过RT-PCR扩增得到一个新的含CBM4_9结构域的效应蛋白基因,并对其功能进行了初步探索。序列分析表明Fs11724基因开放阅读框822 bp,编码273个氨基酸,分子量为28.24 kDa,理论pI值为4.29,亲水性平均系数–0.072,属于亲水性分泌蛋白;通过农杆菌介导的烟草瞬时表达系统证实Fs11724抑制由BAX诱导的细胞程序性死亡,表明Fs11724具有潜在抑制寄主防御反应的毒性功能;同时,利用酵母分泌系统对其编码蛋白信号肽的分泌功能进行验证,确定该基因编码蛋白为典型分泌蛋白;qRT-PCR结果分析表明Fs11724在甘蔗镰孢菌侵染前、后期上调表达,表达量在168 hpi达到峰值。该研究表明Fs11724编码蛋白为甘蔗镰孢菌F. sacchari的一个效应蛋白,其信号肽具有分泌功能,并且可以在非寄主植物烟草上抑制BAX诱导的细胞坏死,在真菌侵染植物过程中显著表达,可能在调控植物免疫反应中发挥作用。研究结果为进一步研究病原–甘蔗互作,揭示甘蔗镰孢菌发病机制奠定基础。
关键词:甘蔗;Fusarium sacchari;CBM;效应蛋白;qRT-PCR
中图分类号:S432.1 文献标识码:A
Identification and Functional Analysis of Carbohydrate Binding Module Effector Gene Fs11724 of Fusarium sacchari
LI Huixue1,2, HUANG Zhen1,3*, ZHOU Yuming1,2, BAO Yixue1,3, YAO Ziting1,2, ZHANG Muqing1,3**, YAO Wei1,2,3**
1. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning, Guangxi 530004, China; 2. Guangxi Key Laboratory of Sugarcane Biology, Nanning, Guangxi 530004, China; 3. College of Agriculture, Guangxi University, Nanning, Guangxi 530004, China
Abstract: Fusarium sacchari is one of the main pathogens causing the devastating disease (sugarcane pokkah boeng disease, PBD). Effector proteins secreted by pathogens play an important role in the interaction between pathogens and plants. In this study, the gene-specific primer was designed based on the previous sequencing data of the whole genome of F. sacchari. A new effector protein gene containing the CBM4_9 domain (carbohydrate-binding module, CBM) was amplified by reverse transcription PCR (RT-PCR). Subsequently, we conducted a preliminary exploration of its function. Sequence analysis showed that Fs11724 contained a 822 bp open reading frame (ORF) encoding a protein of 273 amino acids residues with predicted molecular mass of 28.24 kDa and theoretical isoelectric point (pI) of 4.29. Through hydrophobicity analysis by ProtParam, the grand average of hydropathicity (GRAVY) of the protein encoded by Fs11724 was –0.072, which was less than zero, indicating that the protein encoded by Fs11724 might be a hydrophilic secreted protein. The toxic function of Fs11724 gene was identified by Agrobacterium-mediated transient expression system in Nicotiana benthamiana, The result showed that Fs11724 suppressed BAX-triggered programmed cell death in N. benthamiana leaves, indicating its potential toxic function on inhibiting host plant defense response. At the same time, the secretory function of the predicted signal peptide of Fs11724 was verified by yeast secretory system, as a result, the protein encoded by Fs11724 was identified as a typical secretory protein. In addition, the gene expression level was monitored by quantitative real-time PCR (qRT-PCR) experiments. The results and analysis of qRT-PCR indicated that the expression of Fs11724 showed the overall upregulated trend not only at the early phase of F. sacchari infestation but also at the late phase of F. sacchari infestation. And the gene expression reached the highest expression level at 168 hours post inoculation (hpi). In conclusion, our results in this study suggested that the protein encoded by Fs11724 was an extracellular effector protein of F. sacchari. The signal peptide of this protein had secretory function. In addition, Fs11724 could inhibit BAX-induced programmed cell death in non-host plant N. benthamiana and significantly expressed in the process of pathogenic fungi infecting plants. Therefore, it was speculated that Fs11724 might play a role in regulation of plant immune response. The results would lay a foundation for further research on pathogen-sugarcane interaction and revealing the molecular pathogenesis of F. sacchari.
Keywords: sugarcane; Fusarium sacchari; CBM; effector protein; qRT-PCR
DOI: 10.3969/j.issn.1000-2561.2022.01.005
甘蔗(Saccharum spp.)是我国最重要的糖料作物,蔗糖产量占全国食糖总量的90%以上[1]。由多种镰孢菌引起的甘蔗梢腐病(pokkah boeng disease, PBD)是影响我国甘蔗生产的重要真菌性病害,近几年该病害在中国蔗区呈明显加重趋势[2],尤其云南蔗区一些高感品种梢腐病的爆发导致甘蔗减产30.2%~48.5%,蔗糖分下降2.63%~ 5.21%[3]。Fusarium sacchari CNO-1的最适生长温度为28~32℃,高温高湿气候促使其产生大量分生孢子而引发PBD,它不仅是夏季引起PBD的主要病原菌[4],同时也引发甘蔗镰刀菌萎蔫病(sugarcane Fusarium wilting disease)[5],严重影响蔗茎产量与含糖量,给甘蔗产业造成极大的经济损失。深入研究甘蔗镰孢菌与甘蔗互作、调控甘蔗镰孢菌侵染及致病的分子机制对有效防治PBD具有重要意义。
在植物与病原菌的长期相互作用中,植物进化出双层防御系统[6]。植物利用细胞膜表面模式识别受体(pattern recognition receptors,PRRs)识别某些病源性分子,如病原体相关分子模式(pathongen- associated molecular patterns,PAMPs)或损伤相关分子模式(damage-associated molecular patterns,DAMPs)触发第一层防御反应,即PTI(PAMP- triggered immunity)反应[7]。其中几丁质是真菌细胞壁的主要成分,也是进化相对保守的PAMPs,几丁质酶可被植物分泌到质外体,降解为几丁质低聚糖,被植物表面PRRs识别后激活PTI反应[8];除此之外,典型DAMPs如细胞壁降解产物胞外ATP(eATP)和植物激发子肽(Pep1),可作为内源信号分子激发植物类PTI反应[9-10]。病原菌为克服植物基础防御,通过分泌效应蛋白到植物细胞质外体或者细胞质内干扰或者破坏寄主PTI以增强自身毒力,提高适应性。植物也在进化过程中产生特异的抗性基因(resistance,R)来识别病原菌效应蛋白,由此触发第二层防御反应,即ETI(effector-triggered immunity)反应[6]。ETI最明显特征之一是引发植物超敏反应(hypersensitive response,HR),即导致病原体攻击部位的细胞快速死亡,以此限制病原体传播[11]。植物细胞壁是植物抵抗病原菌的第一道屏障,植物病原菌通过分泌碳水化合物活性酶(carbohydrate-active enzymes,CAZymes)降解植物细胞壁,导致植物受害;而植物则通过释放植物细胞壁降解酶的抑制物质来减弱植物细胞壁的降解,以抵御病原菌的入侵[12]。病原真菌为了保护自身细胞壁主要成分几丁质不被植物几丁质酶所识别和降解,一类本身没有催化活性但具有碳水化合物结合模块(carbohydrate-binding modules,CBMs)的真菌效应蛋白质,分泌到质外体与几丁质或几丁质寡糖结合,通过靶向和促进与底物的长时间相互作用增强真菌CAZyme活性或者协助真菌逃逸寄主植物的识别,属于质外体效应蛋白,也是抵御PTI相关酶的“抑制剂”[12-14]。如番茄叶霉菌(Cladosporium fulvum)的CBM14效应蛋白(Avr4)分泌到植物胞外空间与几丁质结合,促进黄枝孢霉成功致病[15];黄枝孢霉的CBM50效应蛋白Ecp6(含LysM模序的效应蛋白)通过竞争性结合几丁质寡糖,抑制几丁质触发的植物免疫反应[16]。稻瘟病菌(Magnaporthe oryzae)效应蛋白Slp1、萝卜炭疽病菌(Colletotrichum higginsianum)效应蛋白ChELP1和ChELP2均含有LysM模序(CBM50),通过阻断几丁质和植物膜受体的結合,从而协助病原菌逃避几丁质触发的PTI反应[17-18]。非苜蓿轮枝菌(Verticillium nonalfalfae)的效应蛋白VnaChtBP含CBM18结合模块,不仅能保护真菌细胞壁几丁质免受宿主几丁质酶的水解,也能螯合几丁质寡聚体逃逸几丁质触发的宿主植物免疫识别[19]。可见,病原真菌通过分泌含CBMs的效应蛋白保护几丁质不被寄主免疫受体识别或通过竞争性结合几丁质寡聚复合物可能成为病原真菌逃逸几丁质触发的免疫反应的一种普遍策略。在最近的研究中我国首次发现大丽轮枝菌(Verticillium dahliae)CBM1效应蛋白基因(VdCBM1)具有抑制寄主免疫反应的功能,并协同糖苷水解酶共同操控寄主先天免疫反应,同时也发现病原碳水化合酶类通过偶联CBM1结构域自我调控免疫反应协助病原侵染的进化机制[20]。因此,推测CBM效应蛋白在病原-植物互作中发挥着至关重要的作用。随着高通量测序技术的发展,越来越多的CBM效应蛋白基因被挖掘,如上所述的一些CBM类效应蛋白也相继在不同的病原真菌中被鉴定,但总体来说CBM效应蛋白作为非酶蛋白,其在植物免疫中的功能及作用机制还是知之甚少。
目前对于甘蔗镰孢菌引起的发病机制、甘蔗与镰孢菌的互作、甘蔗参与镰孢菌病理反应的重要功能基因的挖掘等基础研究鲜有报道。本研究基于课题组前期甘蔗镰孢菌基因组数据中获得的分泌蛋白序列(未公布),通过生物信息学分析,以致病菌F. sacchari RNA为模板,通过RT-PCR克隆得到1个含碳水化合物结合模块CBM4_9的候选效应蛋白基因,并从烟草瞬时表达、信号肽分泌功能、基因表达特征等3个方面对其功能进行初步分析,以确定其在甘蔗镰孢菌侵染过程中的作用,为进一步揭示甘蔗与病原菌互作的分子机理奠定重要的理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 供试甘蔗品种为广西大学培育的‘中蔗1号’[21],该品种为梢腐病易感品种,采自扶绥甘蔗种植基地半年蔗茎段,于广西大学校内温室大棚桶栽,长至5叶期时用于接种实验;供试烟草(Nicotiana benthamiana)由本实验室提供,于25℃,60%湿度条件下温室培养,光暗时间L∶D=10∶14。
1.1.2 菌株及载体 甘蔗镰孢菌Fusarium sacchari由本实验室分离纯化,于PDA培养基28℃恒温培养;大肠杆菌Trans1-T1感受态,购自北京全式金生物技术有限公司,于LB培养基37℃恒温培养;农杆菌GV3101(pJIC SA_Rep),购自上海唯地生物技术有限公司,于LB培养基28℃恒温培养;酵母菌株YTK12,由中国农业科学院刘文德老师馈赠,30℃条件下恒温培养。PVX病毒载体由西北农林科技大学康振生院士馈赠;载体pSUC2,mg87-pSUC2,Avr1b-pSUC2由中国农业科学院刘文德老师馈赠。
1.1.3 主要试剂 TaKaRa MiniBEST Universal RNA Extraction Kit、PrimeScript™ RT reagent Kit (Perfect Real Time)、TB Green® Premix Ex Taq™ II 购自宝日医生物技术有限公司;pEASY®-Basic Seamless Cloning and Assembly Kit、pEASY®- Blunt Zero Cloning Kit购自北京全式金生物;Taq酶、高保真酶购自南京诺唯赞生物科技股份有限公司;DNA纯化回收试剂盒、质粒小提试剂盒购自北京天根生化科技有限公司;Frozen-EZ Yeast Transformation II Kit T2001(Zymo Research)、卡那霉素、庆大霉素、利福平、抗霉素A购自索莱宝生物科技有限公司;CMD-W、YPRAA复合培养基购自北京酷来搏科技有限公司;LB培养基、PDA培养基、YPDA均按照常规配方配制。
1.2 方法
1.2.1 生物信息学分析 利用在线软件ExPASy- Proparam(https://web.expasy.org/protparam/)对Fs11724编码蛋白氨基酸序列进行理化性质分析。参考真菌效应蛋白预测方法[22],利用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)和SMART(http://smart.embl-heidelberg.de/)在线预测是否含有信号肽并确定信号肽序列位置;TMHMM Server 2.0 (http://www.cbs.dtu.dk/ser¬vices/TMHMM/)在线预测有无跨膜螺旋;PredGPI(http://gpcr2.biocomp. unibo.it/predgpi/pred.htm)在线预测是否含有GPI锚定位点;利用在线软件TargetP 1.1 Server(http://www.cbs.dtu.dk/ser-vices/TargetP-1.1/index.php)进行亚细胞定位预测。利用Conserved Domain Search(https://www. ncbi.nlm.nih.gov)在线预测蛋白保守结构域。
1.2.2 目的基因克隆及载体构建 根据甘蔗镰孢菌基因组中获得分泌蛋白的cDNA序列,利用在线软件CE Design(http://www.vazyme.com)设计Fs11724基因的ORF框无缝克隆引物,结合NCBI Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/ primer-blast/)检测引物特异性(引物序列见表1)。以实验室保存的F. sacchari RNA反转录得到的cDNA为模板,以特异性引物Fs11724-PVXF/R进行PCR扩增得到目的基因片段,连接至pEASY克隆载体(全式金),挑取阳性克隆送上海生工测序验证。以限制性内切酶Cla Ⅰ和Sal Ⅰ双酶切PVX载体,实现载体线性化,利用无缝克隆(in-fusion cloning)技术按照pEASY®-Basic Seamless Cloning and Assembly Kit连接目的基因和PVX载体,转化至大肠杆菌Trans1-T1,提取质粒后送上海生工生物工程有限公司测序。
1.2.3 农杆菌介导的烟草瞬时表达试验 将PVX空载及PVX重组载体通过冻融法转化至农杆菌GV3101中,利用基因特异性引物检测阳性农杆菌转化子。挑取阳性转化子在含有50 μg/mL Kan,20 μg/mL Rif,50 μg/mL Gen的LB培养液中,28℃,220 r/min培养2 d。取10 mL菌液于50 mL灭菌离心管中,4000 r/min离心4 min收集菌体,以10 mL 10 mmol/L MgCl2洗涤菌体3次,最后用10 mmol/L MgCl2悬浮菌体,并调节OD600至0.4~0.5,悬浮液于28℃暗适应2 h后进行侵染。选用4~6周的烟草,用去掉针头的一次性无菌注射器在叶片背面轻压渗透注射。将携带PVX空载及含Fs11724基因的农杆菌悬浮液分别渗透注入,注射范围用黑色记号笔进行标记。24 h后,将携带BAX基因的农杆菌悬浮液注射到同一位点,渗透注射后的烟草避免灯光直射,7 d后观察症状并拍照,期间注意观察叶片症状变化。
1.2.4 Fs11724信号肽分泌功能验证 采用酵母信号肽筛选(yeast signal peptide screen, YSST)和化学催化法(2,3,5-triphenyltetrazolium chloride, TTC)验证Fs11724信号肽的分泌功能[23-24]。以突变型酵母菌株YTK12作为转化菌株,其缺失蔗糖转化酶基因SUC2及色氨酸合成酶基因;载体pSUC2T7M130RI(pSUC2)含有色氨酸合成酶基因,以及1个缺失信号肽和起始密码子ATG的蔗糖转化酶基因SUC2,只有插入具有分泌功能的基因或片段时,缺失的SUC2基因才能被启动表达并分泌到培养基中,将蔗糖或者棉籽糖转化为酵母生长所需的葡萄糖。根据在线软件SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)和SMART(http://smart.embl.de/)预测Fs11724编码蛋白的信号肽序列,设计特异性引物Fs11724 SP-pSUC2F/R(表1)扩增信号肽序列,连接至EcoR Ⅰ、Xho Ⅰ双酶切的pSUC2载体,转入大肠杆菌Trans1-T1,提取质粒测序。利用酵母转化试剂盒Frozen-EZ Yeast Transformation II Kit T2001(Zymo Research)制备酵母感受态,将质粒转化至酵母菌株YTK12,挑取在以蔗糖为碳源的CMD-W培养基上生长的阳性克隆,在以棉籽糖为碳源的YPRAA培养基上划线验证信号肽的分泌功能。同时将阳性克隆接种于10 mL YPDA培养基中,30℃震荡培养2 d;取1.5 mL菌液,12 000 r/min离心30 s,ddH2O洗涤菌体2次,最终在750 μL ddH2O悬浮菌体里加入250 μL 10 mmol/L醋酸-醋酸鈉缓冲液(pH 4.7),500 μL 10%蔗糖溶液,37℃孵育10 min;12 000 r/min离心30 s,取200 μL上清液加1.8 mL 0.1% TTC静置10 min,观察颜色变化,拍照保存。Avr1b是大豆疫霉中的分泌型效应蛋白,其信号肽具有分泌活性,作为本实验的阳性对照;Mg87是稻瘟菌中的非分泌蛋白,其信号肽没有分泌活性,作为本实验的阴性对照[25]。若预测的信号肽具有分泌功能,蔗糖转化酶基因SUC2启动表达,可以将蔗糖转化酶分泌至细胞外,使无色的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)还原为不可溶的红色物质1,3,5-三苯甲臜(1,3,5-triphenylformazan),因此通过TTC显色可以进一步确定其信号肽的分泌功能。
1.2.5 目的基因表达模式分析 采用针刺接种法[26],用1 mL无菌注射器将100 μL甘蔗镰孢菌CNO-1的分生孢子悬浮液(1×106个/mL)接种至长势一致的5叶期甘蔗幼苗的生长点附近,在接种后0、12、24、48、72、120、168、216 h的每株接种点下部叶鞘位置进行取样,将样品置于液氮中迅速冷冻后,–80℃贮藏备用。每个时间点包括3株不同植株、同一植株的3个叶片。样品采集后立即液氮速冻,保存于–80℃备用。利用TaKaRa MiniBEST Universal RNA Extraction Kit(TaKaRa)试剂盒提取总RNA,PrimeScript™ RT reagent Kit(Perfect Real Time)反转录得到cDNA。根据Fs11724基因序列设计荧光定量PCR引物Fs11724-qRTF/R(表1)。以FvActin 作为内参基因[27],引物为FvActinF/R(表1)。应用Roche LightCycler96系统,分别以各个取样时间点的cDNA为模板(50 ng/μL),使用TB Green荧光染料法进行PCR扩增。反应体系20 μL:cDNA 2 μL,上下游引物2 μL,TB Green 10 μL,超纯水6 μL。PCR反应程序如下:预变性95℃ 30 s;两步法扩增 95℃ 15 s,60℃ 30 s,45 cycles;融解曲线95℃ 15 s,95℃ 60 s,97℃ 1 s;降温37℃ 30 s。每個反应设置3个重复。反应结束后,按照2-ΔΔCT法[28]分析Fs11724基因在甘蔗镰孢菌侵染甘蔗不同阶段的相对表达量。
2 结果与分析
2.1 Fs11724基因生物信息学分析
Fs11724基因开放阅读框(open reading frame, ORF)为822 bp,编码273个氨基酸,其编码蛋白分子量为28.24 kDa,理论pI值为4.29,亲水性平均系数–0.072,属于亲水性蛋白。通过SignalP 4.1和SMART软件同时预测Fs11724信号肽序列,Fs11724编码蛋白的273个氨基酸,前21个氨基酸为信号肽序列(1~21 aa: MASQRLFAAF AALSIIIGSEA),预示该蛋白可能具有分泌功能(图1)。利用软件TMHMM Server V2.0跨膜区预测结果显示该蛋白无跨膜结构,PredGPI预测无GPI锚点位点,TargetP 1.1 Server定位预测发现该蛋白定位于信号肽导向的分泌途径,推测Fs11724基因编码蛋白为经典分泌蛋白并分泌至细胞外发挥作用。利用NCBI CD search对其保守结构域进行分析,结果显示Fs11724编码蛋白序列含有一个碳水化合物结合结构域CBM4_9(图1)。
2.2 Fs11724基因的克隆
根据已经获得的甘蔗镰孢菌Fs11724基因的ORF设计基因特异性引物Fs11724-PVXF/R,以实验室保存的F. sacchari RNA为模板,进行RT-PCR扩增。1.5%琼脂糖凝胶电泳检测得到长度约822 bp大小的特异条带(图2),克隆测序获得的序列与基因组分析获得的序列一致。
2.3 Fs11724抑制BAX在本氏烟草叶片上诱导的细胞坏死
BAX在植物体内诱导的细胞坏死与病原菌诱导的超敏反应(hypersensitive response, HR)在生理特性上具有相似性[29],且以BAX诱导的细胞程序性坏死(programmed cell death, PCD)试验已被广泛运用于多种病原菌效应基因的功能研究[30-32]。因此本实验以空载EV为阴性对照,BAX作为激发烟草叶片超敏反应的阳性对照,通过农杆菌介导的烟草瞬时表达鉴定Fs11724基因毒性功能。按照图3B所示,将携带有空载EV及Fs11724基因的农杆菌悬浮液渗透注射至本氏烟草叶片相应位点,24 h后注射携带BAX基因的重组菌液,7 d后取样拍照。如图3A,单独注射空载和Fs11724基因的位点没有发生细胞坏死,而在注射EV+BAX和单独注射BAX位点均观察到细胞坏死,说明BAX在烟草叶片中成功表达并且诱导植物防御反应,同时也表明空载本身对BAX诱导细胞坏死作用无影响。在共表达Fs11724和BAX的注射位点没有出现坏死病斑,Fs11724成功抑制BAX诱导的细胞坏死(30个重复中27个重复表现抑制),说明Fs11724是一个可抑制HR反应的效应蛋白基因,具有潜在抑制寄主防御反应的毒性功能。
2.4 Fs11724信号肽分泌功能验证
CMD-W培养基不含酵母生长所需色氨酸,以蔗糖、葡萄糖为碳源。YPRAA培养基以棉籽糖为唯一碳源。YTK12缺失蔗糖转化酶基因SUC2及色氨酸合成酶基因;载体pSUC2含有色氨酸合成酶基因,以及一个缺失信号肽和起始密码子ATG的蔗糖转化酶基因SUC2。因此,缺陷型菌株YTK12在CMD-W及YPRAA上均不能生长,而转入pSUC2载体的酵母菌株可依赖载体本身含有的色氨酸操纵子功能在缺乏色氨酸的CMD-W平板上生长。当载体pSUC2插入具有分泌功能且含有起始密码子ATG的信号肽片段时,SUC2基因启动表达,分泌蔗糖转化酶使酵母在以棉籽糖为碳源的YPRAA培养基上正常生长。如图4所示,携带空载体pSUC2或mg87非分泌信号肽的酵母不能在YPRAA培养基中生长,而含有分泌蛋白Avr1b信号肽或Fs11724信号肽的酵母转化子在YPRAA培养基中可以正常生长,表明Fs11724信号肽具有分泌功能。Fs11724蛋白信号肽与阳性对照Avr1b信号肽使TTC溶液变红色,而阴性对照Mg87信号肽不能使TTC溶液变色,说明插入的Fs11724信号肽与Avr1b信号肽片段使蔗糖转化酶基因SUC2启动表达,并将蔗糖转化酶分泌至细胞外,使无色的TTC还原为不可溶的红色物质1,3,5-三苯甲臜,进一步证明Fs11724信号肽具有分泌活性。
2.5 Fs11724基因表达模式分析
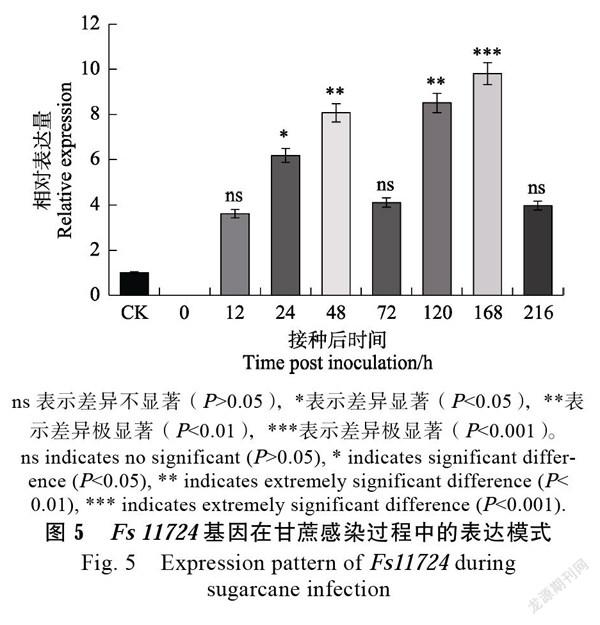
通过qRT-PCR对Fs11724基因在F. sacchari侵染甘蔗过程中的表达模式进行分析。以Fs11724在F. sacchari菌丝体的表达量作为对照(设相对表达量为1),Excel软件绘制表达模式图,结果如图5所示,Fs11724基因在病菌侵染甘蔗过程中呈现2个诱导表达峰值,第一个峰值出现在侵染早期,表达量从12~48 h呈现梯度式升高,48 h表达量达到最高,約为菌丝表达量8.1倍;72 h表达量呈断崖式下降;第二个峰值从120 h开始,表达量显著升高,168 h达到最高,约为菌丝表达量9.8倍,与在菌丝体的表达量存在极显著差异。由此可见,Fs11724基因不仅在侵染初期诱导表达,并且在后期真菌由寄生转腐生阶段显著表达,推测Fs11724基因在病原侵染甘蔗早期、后期发挥作用。
3 讨论
目前已在多种病原微生物中报道了CBM类基因,CBM家族基因众多,在病原菌与植物互作中发挥不同的功能。GUI等[20]发现大丽轮枝菌(V. dahliae)中一个含有CBM1结构域的基因可以在本氏烟草叶片上抑制GH12引起的细胞坏死,说明CBM1可能与植物的免疫反应有关;BURG等[15]克隆了番茄叶霉病菌(C. fulvum)中的CBM14基因,发现该基因编码的蛋白可以结合真菌几丁质,保护真菌菌丝免受植物几丁质酶的降解;VOLK等[19]从黄萎病病原菌(V. nonalfalfae)中克隆到1个CBM18基因,可以干扰寄主的免疫反应,说明该基因在参与植物防御方面发挥重要功能。本研究在甘蔗梢腐病病原菌基因组基础上,通过结构域分析得到了一个具有CBM4_9结构域的新基因Fs11724,通过侵染烟草发现,Fs11724可以在烟草叶片上抑制BAX诱导的细胞坏死,说明该基因可能在抑制植物免疫过程中发挥功能,推测该基因可能作为毒力因子发挥功能。但是该基因在病原菌与植物互作中,通过怎样的方式发挥功能,发挥何种具体形式的功能,还需要进一步实验探究。
真菌效应蛋白通常依赖常规的内质网-高尔基体途径分泌至细胞外发挥作用[33],在这一过程中,信号肽通过引导新合成蛋白靶向分泌途径以确保蛋白的胞外分泌,其功能必不可少。如大丽轮枝菌效应基因VdEG1和VdEG3可在烟草中诱导细胞坏死,缺失信号肽后其诱导坏死功能丧失,说明其功能的发挥需要VdEG1和VdEG3的细胞外分泌[20]。本研究中,通过信号肽分泌功能验证,发现Fs11724信号肽具有分泌功能,表明Fs11724编码的蛋白是一个典型的分泌蛋白。但其信号肽的缺失是否会影响其功能的发挥,需要进一步的探究。
之前的研究中,稻瘟菌CBM50效应蛋白Slp1在侵染早期被快速诱导表达且在稻瘟菌感染水稻后的24~28 h观察到在植物-真菌界面上积累[18];萝卜炭疽病菌效应蛋白ChELP1和ChELP2在侵染后40 h表达量最高,并证实在早期活体寄生阶段参与几丁质触发的免疫反应[17]。Fs11724在侵染早期的诱导表达说明该基因可能参与早期抑制寄主防御反应过程。此外,甘蔗镰孢菌作为一种兼性腐生菌,需经历从活体寄生阶段到死体营养阶段的转变[4],在这个过程中,病原真菌以扩增碳水化合物活性酶种类及数量或增强碳水化合物酶活性引起寄主植物死亡完成营养生长[34],Fs11724基因后期诱导高表达,推测有可能通过增强碳水化合物酶活性,参与到寄转腐阶段植物碳水化合物的降解。
目前许多研究集中于参与逃避几丁质引发的免疫的质外体效应蛋白的功能特性上,尤其是真菌CBM50/LysM效应蛋白[13]。如前所述的CBM18、CBM14等碳水化合物结合模块效应蛋白利用类似策略参与植物免疫调控[15, 19],对于CBM家族中是否还有其他成员参与类似机制有待进一步挖掘。基于以上分析,Fs11724编码的蛋白为甘蔗镰孢菌F. sacchari的一个效应蛋白,其信号肽具有胞外分泌活性,Fs11724可以在非寄主植物烟草上抑制BAX诱导的细胞坏死,并在真菌侵染植物过程中显著表达,因此推测Fs11724可能在调控植物免疫反应中发挥作用。但CBM4_9的分子生物学功能及Fs11724是否真能如我们推测的,通过参与真菌几丁质保护逃逸几丁质触发的免疫反应而协助病原菌侵染还需要进一步的实验数据支撑。本研究首次在甘蔗镰孢菌中鉴定了一个含CBM4_9的效应蛋白基因并对其功能进行初步解析,为进一步研究病原-甘蔗互作分子机理奠定基础,同时有助于阐明甘蔗抗感梢腐病的机制,为抗病品种培育和病害防控提供参考。
参考文献
[1] LI Y R, SONG X P, WU J M, LI C N, LIANG Q, LIU X H, WANG W Z, TAN H W, YANG L T. Sugar industry and improved sugarcane farming technologies in China[J]. Sugar Tech, 2016, 18(6): 603-611.
[2] XU S Q, WANG J H, WANG H X, BAO Y X, LI Y S, GOVINDARAJU M, YAO W, CHEN B S, ZHANG M Q. Molecular characterization of carbendazim resistance of Fusarium species complex that causes sugarcane pokkah boeng disease[J]. BMC Genomics, 2019, 20(1): 115.
[3] 单红丽, 李文凤, 张荣跃, 王晓燕, 李 婕, 仓晓燕, 尹 炯, 罗志明, 黄应昆. 甘蔗梢腐病暴发流行原因及产量糖分损失测定[J]. 中国糖料, 2018, 40(3): 40-42, 45.
SHAN H L, Li W F, ZHANG R Y, WANG X Y, LI J, CANG X Y, YIN J, LUO Z M, HUANG Y K. Analysis on epidemic reason of sugarcane pokahh boeng and its losses on yield and sucrose content[J]. Sugar Crops of China, 2018, 40(3): 40-42, 45. (in Chinese)
[4] MENG J R, HAUNG H J, LI Y X, LI Y J, LI J Q, CHEN B S. First report of Fusarium sacchari causing sugarcane pokkah boeng in China[J]. Plant Disease, 2020, 104(5): 1553.
[5] BAO Y X, HUANG Z, LI T M, YAO Z T, POWELL C A, ZHANG M Q. First report of Fusarium andiyazi causing sugarcane pokkah boeng disease in China[J]. Plant Disease, 2020, 104(1): 286.
[6] JONES J D G, DANGL J L. The plant immune system[J]. Nature, 2006, 444(7117): 323-329.
[7] YU X, FENG B M, HE P, SHAN L B. From chaos to harmony: responses and signaling upon microbial pattern recognition[J]. Annual Review of Phytopathology, 2017, 55(1): 109-137.
[8] PUSZTAHELYI T. Chitin and chitin-related compounds in plant-fungal interactions[J]. Mycology, 2018, 9(3): 189-201.
[9] TANAKA K, CHOI J, CAO Y R, STACEY G. Extracellular ATP acts as a damage-associated molecular pattern (DAMP) signal in plants[J]. Frontiers in Plant Science, 2014, 5(1): 446.
[10] CHOI H W, KLESSIG D F. DAMPs, MAMPs, and NAMPs in plant innate immunity[J]. BMC Plant Biology, 2016, 16(1): 232.
[11] BALINT-KURTI P. The plant hypersensitive response: concepts, control and consequences[J]. Molecular Plant Pathology, 2019, 20(8): 1163-1178.
[12] LYU X L, SHEN C C, FU Y P, XIE J T, JIANG D H, LI G Q, CHENG J S. Comparative genomic and transcriptional analyses of the carbohydrate-active enzymes and secretomes of phytopathogenic fungi reveal their significant roles during infection and development[J]. Scientific Reports, 2015, 5: 15565.
[13] ROCAFORT M, FUDAL I, MESARICH C H. Apoplastic effector proteins of plant-associated fungi and oomycetes[J]. Current Opinion in Plant Biology, 2020, 56: 9-19.
[14] CANTAREL B L, COUTINHO P M, RANCUREL C, BERNARD T, LOMBARD V, HENRISSAT B. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for glycogenomics[J]. Nucleic Acids Research, 2009, 37(1): D233-D238.
[15] BURG V, Uvaprd U, JOOSTEN M, WIT D. Cladosporium fulvum Avr4 protects fungal cell walls against hydrolysis by plant chitinases accumulating during infection[J]. Molecular Plant-Microbe Interactions, 2006, 19(12): 1420-1430.
[16] JONGE R D, ESSE H P V, KOMBRINK A, SHINYA T, DESAKI Y, BOURS R, KROL S V D, SHIBUYA N, JOOSTEN M H A J, THOMMA B P H J. Conserved fungal LysM effector Ecp6 prevents chitin-triggered immunity in plants[J]. Science, 2010, 329(5994): 953-955.
[17] TAKAHARA H, HACQUARD S, KOMBRINK A, HUGHES H B, HALDER V, ROBIN G P, HIRUMA K, NEUMANN U, SHINYA T, KOMBRINK E, SHIBUYA N, THOMMA B P H J, O'Connell R J. Colletotrichum higginsianum extracellular LysM proteins play dual roles in appressorial function and suppression of chitin-triggered plant immunity[J]. New Phytologist, 2016, 211(4): 1323-1337.
[18] MENTLAK T A, KOMBRINK A, SHINYA T, RYDER L S, OTOMO I, SAITOH H, TERAUCHI R, NISHIZAWA Y, SHIBUYA N, THOMMA B P H J, TALBOT N J. Effector-mediated suppression of chitin-triggered immunity by Magnaporthe oryzae is necessary for rice blast disease[J]. The Plant Cell, 2012, 24(1): 322-335.
[19] VOLK H, MARTON K, FLAJŠMAN M, RADIŠEK S, TIAN H, HEIN I, PODLIPNIK Č, THOMMA B P H J, KOŠMELJ K, JAVORNIK B, BERNE S. Chitin-binding protein of Verticillium nonalfalfae disguises fungus from plant chitinases and suppresses chitin-triggered host immunity[J]. Molecular Plant-Microbe Interactions, 2019, 32(10): 1378-1390.
[20] GUI Y J, CHEN J Y, ZHANG D D, LI N Y, LI T G, ZHANG W Q, WANG X Y, SHORT D P G, LI L, GUO W, KONG Z Q, BAO Y M, SUBBARAO K V, DAI X F. Verticillium dahliae manipulates plant immunity by glycoside hydrolase 12 proteins in conjunction with carbohydrate-binding module 1[J]. Environmental Microbiology, 2017, 19(5): 1914-1932.
[21] 張姗姗, 张沛然, 兰仙软, 李 茹, 黄有总, 陈保善. 中蔗系列甘蔗品种的黑穗病抗性鉴定[J]. 中国糖料, 2019, 41(1): 41-44.
ZHANG S S, ZHANG P R, LAN X R, LI R, HUANG Y Z, CHEN B S. Identification of smut resistance in sugarcane Zhongzhe cultivars[J]. Sugar Crops of China, 2019, 41(1): 41-44. (in Chinese)
[22] ZHANG Y, WEI J, QI Y, LI J Y, AMIN R, YANG W X, LIU D Q. Predicating the effector proteins secreted by Puccinia triticina through transcriptomic analysis and multiple prediction approaches[J]. Frontiers in Microbiology, 2020, 11: 538032-538032.
[23] JACOBS K A, COLLINS-RACIE L A, COLBERT M, M., DUCKETT M, GOLDEN-FLEET M, KELLEHER K, KRIZ R, LAVALLIE E R, MERBERG D, SPAULDING V, STOVER J, WILLIAMSON M J, MCCOY J M. A genetic selection for isolating cDNA encoding secreted proteins[J]. Gene, 1997, 198(1-2): 289-296.
[24] LINK T I, VOEGELE R T. Secreted proteins of Uromyces fabae: similarities and stage specificity[J]. Molecular Plant Pathology, 2010, 9(1): 59-66.
[25] GU B, KALE S D, WANG Q H, WANG D H, PAN Q N, CAO H, MENG Y L, KANG Z S, TYLER B M, SHAN W X. Rust secreted protein Ps87 is conserved in diverse fungal pathogens and contains a RXLR-like motif sufficient for translocation into plant cells[J]. PLoS One, 2011, 6(11): e27217.
[26] WANG Z P, SUN H J, GUO Q, XU S Q, WANG J H, LIN S H, ZHANG M Q. Artificial inoculation method of pokkah boeng disease of sugarcane and screening of resistant germplasm resources in subtropical China[J]. Sugar Tech, 2017, 19(3): 283-292.
[27] LIN Z Y, WANG J H, BAO Y X, GUO Q, POWELL C A, XU S Q, CHEN B S, ZHANG M Q. Deciphering the transcriptomic response of Fusarium verticillioides in relation to nitrogen availability and the development of sugarcane pokkah boeng disease[J]. Scientific Reports, 2016, 6(1): 139-165.
[28] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR[J]. Methods, 2001, 25(4): 402-408.
[29] LACOMME C, CRUZ S S. Bax-induced cell death in tobacco is similar to the hypersensitive response[J]. Proceedings of the National Academy of Sciences, 1999, 96(14): 7956-7961.
[30] MING G, FANG T, WAMBOLDT Y, ALFANO J R. The majority of the type III effector inventory of Pseudomonas syringae pv. tomato DC3000 can suppress plant immunity[J]. Molecular Plant-Microbe Interactions, 2009, 22(9): 1069- 1080.
[31] WANG Q Q, HAN C Z, FERREIRA A O, YU X L, YE W W, TRIPATHY S, KALE S D, GU B, SHENG Y T, SUI Y Y, WANG X L, ZHANG Z G, CHENG B P, DONG S M, SHAN W X, ZHENG X B, DOU D L, TYLER B M, WANG Y C. Transcriptional programming and functional interactions within the Phytophthora sojae RXLR effector repertoire[J]. The Plant Cell, 2011, 23(6): 2064-2086.
[32] MA L, LUKASIK E, GAWEHNS F, TAKKEN F L W. The use of agroinfiltration for transient expression of plant resistance and fungal effector proteins in Nicotiana benthamiana leaves[J]. Methods in Molecular Biology, 2012, 835: 61-74.
[33] CONESA A, PUNT P J, LUIJK N V, VAN DEN HONDEL C A M J J. The secretion pathway in filamentous fungi: a biotechnological view[J]. Fungal Genetics and Biology, 2001, 33(3): 155-171.
[34] 陳相永, 陈捷胤, 肖红利, 桂月靖, 李 蕾, 戴小枫. 植物病原真菌寄生性与分泌蛋白组CAZymes的比较分析[J]. 植物病理学报, 2014, 44(2): 163-172.
CHEN X Y, CHEN J Y, XIAO H L, GUI Y J, LI L, DAI X F. The comparative analysis of secreted CAZymes in phytopathogenic fungi with different lifestyle[J]. Acta Phytopathologica Sinica, 2014, 44(2): 163-172. (in Chinese)

