茉莉花香气相关基因JsTPS启动子的克隆与活性分析
林俊杰 李小婷 陈雪津 崔萌 吉玉婷 叶乃兴 陈桂信





摘 要:以茉莉(Jasminum sambac)的花苞為材料,采用染色体步移技术,分离出JsTPS基因的5端调控序列,对该启动子序列进行顺式作用元件预测。根据茉莉花TPS基因启动子的顺式作用元件分布,扩增出5个不同片段长度的启动子,分别命名为JsTPS-1(494 bp)、JsTPS-2(689 bp)、JsTPS-3(1016 bp)、JsTPS-4(1466 bp)和JsTPS-5(2040 bp),应用GATEWAY技术,构建5个不同长度融合GUS基因的植物表达载体,用农杆菌GV3101侵染烟草叶片,对转化后的烟草叶片进行GUS染色。检测不同片段长度启动子活性,找出该启动子的关键活性区域,对其功能进行初步分析,序列分析结果表明:克隆得到的JsTPS启动子序列长度为2040 bp,该序列包含TATA-box、G-box、CAAT-box等启动子核心元件、光响应元件(ACE、ATCT-motif、Box 4、3-AF1 binding site、G-Box、Sp1和GT1-motif)和激素响应元件[茉莉酸甲酯响应元件(TGACG-motif、CGTCA-motif)、ABRE脱落酸响应元件、生长素响应元件(TGA-box、TGA-element)、水杨酸响应元件(TCA-element)、赤霉素响应元件(GARE-motif)]等,说明该基因的表达可能受到光照、激素(ABA、生长素、茉莉酸、茉莉酸甲酯和水杨酸)的诱导。GUS染色结果表明:其JsTPS-1启动子几乎不染色,JsTPS-2染色相对较弱,而JsTPS-3的染色程度高于JsTPS-4、JsTPS-5,且是5个不同缺失片段中染色最深的片段;GUS酶活性检测结果显示,不同缺失片段长度酶活性与染色结果一致,JsTPS-1的GUS酶活性最低,随着启动子片段加长,GUS酶活性增强,在片段长度为JsTPS-3时酶活性最强,在JsTPS-4、JsTPS-5片段长度,GUS酶活下降。JsTPS启动子至少包括–788~0 bp这段区域才能驱动JsTPS起始转录,相比较其他片段,发现在–1016~0 bp区域时启动子的活性表现最强。推测可能在–1016~–689 bp中含有水杨酸响应(TCA-element)、光响应(3-AF1 binding site)等元件增强启动子的活性,而在–1466~–1016 bp中含有赤霉素负调控响应元件减弱JsTPS启动子的活性。本研究为进一步开展调控茉莉花香气释放研究提供理论基础。
关键词:茉莉花;萜类合成酶;启动子;顺式作用元件;启动子活性
中图分类号:S685.16 文献标识码:A
Cloning and Activity Analysis of JsTPS Promoter of Jasminum sambac Aroma Related Gene
LIN Junjie, LI Xiaoting, CHEN Xuejin, CUI Meng, JI Yuting, YE Naixing*, CHEN Guixin*
College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract: Jasmine (Jasminum sambac) bud was used as the material, and the chromosome walking technology was used to isolate the 5 end regulatory sequence of JsTPS, and predict the promoter cis-acting element for this sequence. According to the cis-acting element distribution of the TPS gene promoter in jasmines, 5 promoters with different fragment lengths were amplified, named JsTPS-1 (494 bp) and JsTPS-2 (689 bp) , JsTPS-3 (1016 bp), JsTPS-4 (1466 bp) and JsTPS-5 (2040 bp), then 5 plant expression vectors with different fragment lengths fused with GUS gene by GATEWAY technology were constructed. Tobacco leaves were infected with GV3101 Agrobacterium to perform Gus staining. Sequence analysis showed that the sequence length of the cloned JsTPS promoter was 2040 bp. It contained the core elements of the promoter such as TATA-box, G-box, CAAT-box and light response elements (ACE,ATCT-motif, Box 4, 3-AF1 binding site, G-Box, Sp1 and GT1-motif), hormone-related response elements such as methyl jasmonate response Element (TGACG-motif, CGTCA-motif), ABRE abscisic acid response element, auxin response element (TGA-box, TGA-element), salicylic acid response element (TCA-element), gibberellin response element (GARE-motif), etc., which indicating that the expression of this gene may be induced by light and hormones (ABA, auxin, jasmonic acid, methyl jasmonate and salicylic acid). The results of GUS staining showed that the JsTPS-1 promoter hardly stained, and the staining of JsTPS-2 was relatively weak. The staining degree of JsTPS-3 was higher than that of JsTPS-4 and JsTPS-5, and it was stained in five deepest deletion fragments. According to the GUS enzyme activity test results, the enzyme activity results of different missing fragment lengthswere consistent with the staining results. The GUS enzyme activity of JsTPS-1 was the lowest. As the promoter fragment lengthened, the GUS enzyme activity increased. When the fragment length was JsTPS-3, the activity was the strongest. The JsTPS promoter must include at least –788 bp to 0 bp to drive initiate transcription. Compared with other fragments, it is found that the promoter activity is the strongest in the region of –1016 bp to 0 bp. It is speculated that –1016 bp to –689 bp may contain salicylic acid response (TCA-element), light response (3-AF1 binding site) and other elements to enhance promoter activity, while –1466 bp to –1016 bp contains gibberellin negative regulatory response elements to weaken the activity of the JsTPS promoter. The study would provide a theoretical basis for further research on regulating aroma release of jasmine.
Keywords: Jasminum sambac; terpene synthase; promoter; cis-acting elemen; promoter activity
DOI: 10.3969/j.issn.1000-2561.2022.01.006
茉莉花[Jasminum sambac (L.) Ait.]是木犀科素馨属的花卉,原产印度,具有较高的经济价值。茉莉用途广泛,是一种重要的香料作物,花朵可用于窨制花茶、制作香水和提取精油等。茉莉花萃取香气的方法有很多,比如PRAGADHEESH等[1]和李丽华等[2]通过固相微萃取(SPME)等方法可萃取茉莉花香气成分,而在茉莉花当中芳香化合物[3-4]成分中主要有萜烯类化合物、酯类、酸类、醇类和酮类及其他化合物等,其中成分含量最高的是酯类,其次是萜烯类化合物,而α-法尼烯则是萜烯类化合物中含量最多的一类。根据报道,现已发现两条合成途径合成萜烯类化合物,其中一条为甲羟戊酸途径(MEV),生成三萜和倍半萜类化合物如α-法尼烯等;另一条为甲基赤藓醇磷酸(methylerythritol phosphate, MEP)途径,合成多种单萜和双萜化合物[5]。
萜类合成酶(TPS)是MEV途径的末端酶类,它们都能够催化FPP和GPP生成萜烯类化合物,在TPS家族中包括了7个亚家族,其中含有一个α-法尼烯合成途径的分支[6-7]。由于TPS基因家族的多样性,并且TPS基因是倍半萜和三萜等特类化合物合成最下游的基因,导致了萜类芳香物质的丰富多样性,在植物芳香物质的合成中起到了重要作用[8]。在植物香气调控研究中,已经在佛手[9]、腊梅[10]、百合[11]、桂花[12-13]、茶树[14]中分离出TPS家族基因并对该类基因调控芳香性物质进行了较深入的研究。萜类合成酶不仅在香气物质合成起到了关键作用,这些萜类合成酶通过基因调控参与合成并释放萜类物质来抵抗外界的胁迫以及病虫害等,研究中发现,在植物中TPS基因对外界胁迫具有调控作用[15]。前人对茉莉花香气成分有了大量的研究分析,但对于这些调控基因的功能进行深入验证的研究比较少。TPS是合成倍半萜α-法尼烯最下游的关键酶类,目前只有关于其基因的分析报道,对启动子方面还未有研究,茉莉花的产香机制还未有透彻的研究。研究TPS基因启动子在茉莉花香气中的作用为改良茉莉品质及遗传提供理论基础。
本研究以双瓣茉莉为材料,采用染色体步移技术,分离出JsTPS基因的5端上游调控序列,对该序列进行启动子进行顺式作用元件预测,应用Gateway技术,构建5个不同片段长度的5端调控序列融合GUS基因的植物表达载体,用农杆菌GV3101侵染烟草叶片,建立瞬时表达体系,对转化的烟草叶片进行GUS染色,检测不同片段长度5端调控序列的活性,找出该启动子的关键活性区域。
1 材料与方法
1.1 材料
1.1.1 试验材料 以福建农林大学茉莉花种植资源圃的茉莉花为材料。采摘盛花时期的茉莉花朵用液氮速冻,研磨成粉末状,–80℃保存备用。gateway载体pDNOR207、pMDC163和本氏烟草种子由本课题组提供。
1.1.2 试剂 多糖多酚植物基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒(北京天根)、Genome Walking Kit(TaKaRa)、Mach1-T1、pBM16A-T(北京博迈德)、农杆菌GV3101(北京全式金)、GUS染色试剂盒(北京中科瑞泰)。
1.2 方法
1.2.1 茉莉花JsTPS基因启动子的扩增 根据JsTPS基因序列,设计3条特异性引物(表1),分別命名为JsTPS-SP1、JsTPS-SP2、JsTPS-SP3。以基因组DNA为模板,参照Genome Walking kit试剂盒染色体步移步骤,连续3轮PCR扩增,扩增产物连接pBM16A-T载体并转化Mach1-T1感受肽,菌液验证正确后送至上海尚亚生物技术有限公司测序,将获得的启动子序列用PlantCARE软件进行顺式作用元件预测。
1.2.2 JsTPS基因启动子缺失片段载体构建 根据JsTPS启动子顺式作用元件预测结果,按顺式作用元件位置设计5个不同长度的启动子5端缺失片段,分别在5端ATG上游494、689、1016、1466、2040 bp处设计特异性引物作为上游引物,分别命名为qJsTPS-F1、qJsTPS-F2、qJsTPS-F3、qJsTPS-F4、qJsTPS-F5,以qJsTPS-R为下游引物(表2),并在引物前加上能与载体特
异性结合的attB接头引物。将扩增后的产物在BP酶的作用下构建到入门载体pDONR207上,结果正确的再通过LR酶构建到表达载体pMDC163上,将检测正确的表达载体转化农杆菌GV3101。
1.2.3 农杆菌转化本氏烟草与GUS染色分析 将构建成功的5个不同片段pMDC163-JsTPS表达质粒分别转化到农杆菌GV3101中,PCR菌液验证后扩大培养,OD600值为0.8左右,将培养基更换为重悬缓冲液[10 mmol/L MES-KOH(pH 5.6、10 mmol/L MgCl2、150 μmol/L乙酰丁香酮],调整OD600值为0.8左右,室温静置3~5 h后,将其注射到生长4周左右的本氏烟草叶片中,暗培养1 d正常培养1 d后备用。
取侵染后的烟草叶片进行GUS染色,将烟草叶片剪成若干个边长为0.5 cm的方块浸没在GUS染液中,37℃避光培养12 h左右,之后将材料转入95%无水乙醇中脱色2~3次,至阴性对照材料为白色,且出现的蓝色底物不再褪色,在激光共聚焦显微镜FV1200下对注射的叶片进行镜检。
根據Bradford蛋白浓度测定试剂盒的说明书进行烟草叶片的总蛋白提取及浓度测定。根据GUS基因定量检测试剂盒的方法和荧光分光光度计检测GUS基因的活性。
2 结果与分析
2.1 JsTPS启动子的分离与顺式作用元件分析
以茉莉花DNA为模板,通过染色体步移技术和测序确定获得1条2040 bp的启动子序列(图1)。将启动子序列导入PlantCARE网站后,对其顺式作用元件进行预测,部分元件结果显示(图2、表3):该序列含有关键启动子核心元件如TATA-box、G-box、CAAT-box等;其中还主要包含了一些激素和环境相关的响应元件,如:光响应元件(ACE、ATCT-motif、Box 4、3-AF1 binding site、G-Box、Sp1、GT1-motif)、茉莉酸甲酯响应元件(TGACG-motif、CGTCA-motif)、脱落酸响应元件(ABRE)、生长素响应元件(TGA-box、TGA-element)、水杨酸响应元件(TCA-element)、赤霉素响应元件(GARE-motif)、无氧诱导所必需的顺式作用调节元件ARE、能与MYB结合的位点CCAAT-box等。根据这些功能元件,可初步推测JsTPS启动子在茉莉花的生长发育过程中,主要受环境和激素的调控。
2.2 JsTPS启动子缺失片段的扩增
根据JsTPS启动子顺式作用预测结果,设计5个不同缺失启动子片段,本研究根据JsTPS启动子的顺式作用元件分析预测结果,通过构建5个不同缺失程度的启动子片段,并进行PCR扩增(图3),分别命名为:JsTPS-1(494 bp)、JsTPS-2(689 bp)、JsTPS-3(1016 bp)、JsTPS-4(1466 bp)和JsTPS-5(2040 bp)。JsTPS-1保留了部分响应元件如GARE-motif赤霉素响应元件、Box 4光响应元件、CGTCA-motif和TGACG-motif茉莉酸甲酯响应元件、ABRE脱落酸响应元件、TGA- element生长素反应元件等;JsTPS-2中多了2个跟光有关的调控元件(BOX-4和G-box)、1个TGA-box生长素调节元件;JsTPS-3中增加了水杨酸参与调控的响应元件(TCA-element)、光响应元件(3-AF1 binding site)等;启动子片段JsTPS-4中增加了光反应元件(ACE、ATCT- motif)、赤霉素响应元件(TATC-box);在JsTPS-5中增加了脱落酸响应元件(ABRE)和光相关调控元件(GT1-motif)。
2.3 JsTPS启动子缺失片段载体的构建
利用Gateway技术,将扩增产物5个缺失目的片段通过BP反应构建到入门载体pDONR207上,在通过LR反应重组置换到pMDC163植物表达载体上,菌液验证结果如图4显示,成功构建5个不同缺失片段的植物表达载体。将其结果分别命名为pMDC163-JsTPS-1、pMDC163-JsTPS-2、pMDC163-JsTPS-3、pMDC163-JsTPS-4、pMDC163- JsTPS-5。
2.4 农杆菌的转化烟草与GUS染色分析
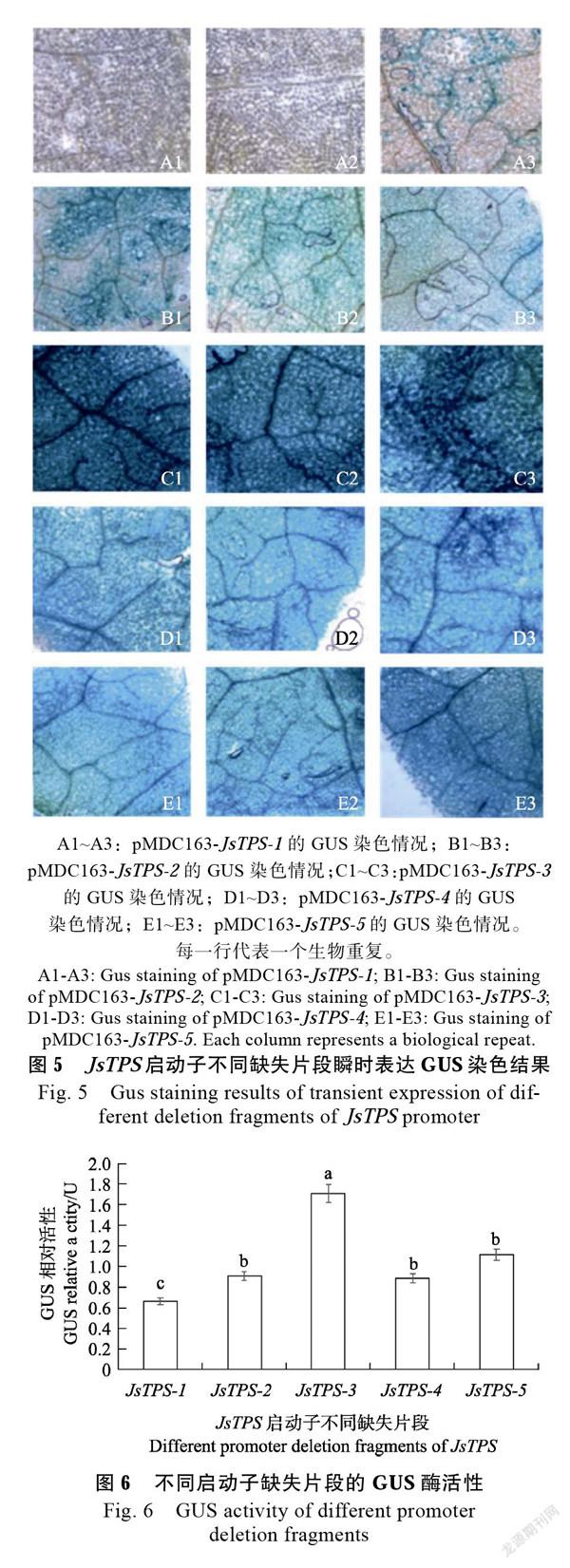
将构建好的载体转化农杆菌GV3101,并注射烟草,为了研究侵染烟草后该基因启动子不同缺失片段在表达上的差异,对其进行GUS染色,结果如图所示(图5):在不同启动子缺失片段的瞬时表达中,烟草叶片呈现不同程度的染色情况。在含有pMDC163-JsTPS-1的烟草叶片中,3个生物重复只有1个叶片有非常微弱的浅蓝色斑点,其他叶片则没有发现染色情况;含pMDC163- JsTPS-2的叶片中,在显微镜中能观察到稀疏分散的蓝色斑点,且斑点多数分布在叶脉周围。而侵染进pMDC163-JsTPS-3基因的烟草叶片用肉眼可直观地观察到叶片完全染色,且呈深蓝色;而在含有pMDC163-JsTPS-4和pMDC163-JsTPS-5的烟草叶片GUS染色结果显示,可以观察到均匀的蓝色,但染色程度没有pMDC163-JsTPS-3的深,只有在叶脉周围分布深蓝色斑点。
在GUS酶活性测定中(图6)JsTPS-1的GUS酶活最低,随着启动子片段加长,GUS酶活性增强,在片段长度为JsTPS-3时酶活性最强,在JsTPS-4、JsTPS-5时,GUS酶活下降。结合顺式作用元件预测结果,TATA-box集中在–788~0 bp区域内,而JsTPS-1启动子片段长度仅483 bp且该启动子没有出现转录活性,JsTPS-2启动子只出现微弱的启动活性,说明TATA-box是JsTPS起始转录的必须元件,在JsTPS启动子中至少要包括–788~0 bp这段区域才能驱动JsTPS起始转录。JsTPS-3启动子(1016 bp)启动子活性最强,说明在–1016~–689 bp中可能含有增强启动子活性的关键元件,能启动GUS基因高度表达,并且与其他片段的启动子有明显差异。随着片段变长,JsTPS-4、JsTPS-5启动子的活性出现下调现象,说明在–1466~–1016 bp中含有负调控元件减弱JsTPS启动子活性。根据顺式作用元件预测结果,水杨酸响应元件(TCA- element)、光响应元件(3-AF1 binding site)可能具有增强JsTPS的启动子活性的功能。
3 讨论
启动子包含了许多能够响应基因表达的关键调控元件,启动子的顺式作用元件预测对研究基因在植物体内调控表达具有重要作用。为进一步探究启动子的功能、活性,通常构建启动子缺失片段植物表达载体,通过在植物上瞬时表达或者稳定遗传表达,研究该基因启动子的组织特异性和启动子活性区域。本试验通过克隆获得茉莉花JsTPS启动子序列,并预测其顺式作用元件,通过瞬时表达找出启动子的活性区域,对其功能进一步分析鉴定。
通過克隆获得JsTPS 5端上游调控序列,顺式作用元件预测结果表明,该基因启动子序列含有关键启动子核心元件如TATA-box、CAAT-box、G-Box等,还包含了与激素、光相关的响应元件,说明该基因可能受光照条件和激素的影响。在对青蒿[16]的TPS启动子研究中发现,该植物TPS基因启动子受茉莉酸和脱落酸的调控。在其他植物中如铁皮石斛[17]、百合[11]等多数都含有昼夜规律调控的元件,但未在茉莉花JsTPS启动子中预测到该功能元件,并且JsTPS中也还未预测到跟逆境胁迫相关的顺式作用元件。研究发现,激素响应的元件可以间接参与调控植物的胁迫反应, MARIANGELA等[18]通过试验发现,沉默TPS基因的植物显示出与对照组有不同组成的挥发物释放,从而减少蚜虫吸引力。许多单萜类物质具有抗氧化性也说明了TPS基因可能间断地参与了植物生长历程中抗逆胁迫的调控。因此JsTPS可能参与调控茉莉花基因抗逆性和香气物质产生,是否受各类激素的调控,还需要进一步对JsTPS基因进行功能验证。
本研究运用JsTPS启动子顺式作用元件的预测分布情况,构建出了5个不同长度启动子融合植物表达载体,再转化烟草叶片,让外源基因JsTPS瞬时表达在植物叶片上。GUS染色和活性检测结果显示,插入最短片段的启动子几乎没有出现染色的情况,说明–493~0 bp启动子片段活性低,之后随着JsTPS启动子长度的增长,启动子活性增强。根据预测的TATA-box元件位置在–782~0 bp之间,研究发现该元件对基因的起始转录起到重要作用,可能由于片段JsTPS-1和JsTPS-2没有包含该核心启动元件所以显示出微弱的染色情况,但随着长度越长,转录表达的活性就越来越高。插入外源基因JsTPS-3的植株染色结果表示,肉眼可直观观察到该片段启动子GUS染色颜色比前2个片段颜色深,而TATA-box元件都定位在JsTPS-3内,所以判断TATA-box是JsTPS基因起始转录的关键元件之一。结合JsTPS启动子的GUS基因酶活性检测结果,与GUS染色的结果一致,在不同片段长度的启动子中JsTPS-3的酶活表达最高,染色最深,所以判断JsTPS-3具有强启动子活性的区域或元件。而在pMDC163- JsTPS-4和pMDC163-JsTPS-5的GUS染色和酶活性检测中发现,这2个区域的启动子活性没有pMDC163-JsTPS-3启动子活性高,pMDC163- JsTPS-4和全长片段的启动子GUS活性表达量基本一样。在刺梨[19]的GGP启动子研究中发现全长片段比缺失片段的启动子活性强,推测–1949~ 2089 bp是具有增强启动活性的区域,第二个缺失片段长度的启动子表达量出现下调的现象,说明在该区域出现减弱启动子活性的负调控区域或元件。该研究结果与本研究相似,依此推断在pMDC163-JsTPS-3到pMDC163-sTPS-4之间的区域,即–1016~–1466 bp片段内含有负调控作用的元件。在构建启动子缺失片段载体时候JsTPS-3比前2个片段增加了水杨酸参与调控的响应元件(TCA-element)、光响应元件(3-AF1 binding site),该启动子的启动活性明显高于前2个片缺失片段,所以本研究推断水杨酸响应元件和3-AF1光响应元件可能增强启动子高表达。随着片段变长,JsTPS-4、JsTPS-5启动子的活性出现下调现象,JsTPS-4增加了一个TATC-ox赤霉素响应元件,没有启动活性的JsTPS-1也包含了一个TATC-box赤霉素响应元件,说明TATC-box赤霉素响应元件可能抑制JsTPS启动子活性。
在崔萌等[20]的研究中发现,JsGDS启动子不同的片段长度、元件缺失或增加都可能导致其在植物不同组织中的表达活性,导致功能性不同。在白桦[21]JMJ18启动子活性检测中发现,在瞬时转化表达的组培苗中不同部位都具有GUS染色情况,证明该基因在植物各组织内都能表达并发挥功能。因此需要对JsTPS启动子进行组织表达活性试验,更近一步探究启动子在茉莉花中的功能。目前研究启动子组织特异性的方法除了通过稳定遗传转化到烟草、拟南芥等模式植物中,有的通过原体组培苗上瞬时表达就可以进行研究,这种方法相比前者周期更短,能够快速鉴定启动子的功能活性以及组织特异性。
综上所述,本研究克隆获得的JsTPS 5端上游调控序列,顺式作用元件预测发现JsTPS基因启动子含有与多种激素、光相关的响应元件。GUS染色结果与酶活性检测表明,JsTPS启动子至少包括–788~0 bp这段区域才能驱动JsTPS起始转录,相比较其他片段,发现在–1016~0 bp区域时启动子的活性表现最强。推测可能在–1016~–689 bp区域内的水杨酸响应(TCA-element)、光响应(3-AF1 binding site)等元件增强启动子的活性,而在–1466~~1016 bp区域中含有赤霉素负调控响应元件从而减弱JsTPS启动子的活性。本实验探究了JsTPS启动子的基础功能,但对JsTPS基因启动子的一些元件是否发挥作用还未进一步确定,所以还需要对植物进行不同处理来研究激素在JsTPS启动子中的调控作用,以及这些响应元件在JsTPS启动子的功能。
参考文献
[1] PRAGADHEESH V S, YADAV A, CHANOTIYA C S, ROUT P K, UNIYAL G C. Monitoring the emission of volatile organic compounds from flowers of Jasminum sambac using solid-phase micro-extraction fibers and gas chromatography with mass spectrometry detection[J]. Natural Pro¬duct Communications, 2011, 6(9): 1333-1338.
[2] 李丽华, 郑 玲, 刘晓松. 固相微萃取气质联用分析茉莉花的香气成分[J]. 化学分析计量, 2006, 15(2): 37-39.
LI L H, ZHENG L, LIU X S. Analysis of Jasmin fragrance isolated with solid phase microextraction by GC-MS[J]. Chemical Analysis and Meterage, 2006, 15(2): 37-39. (in Chinese)
[3] ITO Y. Identification of potent odorants in Chinese Jasmine green tea scented with flowers of Jasminum sambac[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4878-4884.
[4] LIN J, CHEN Y, ZHANG P, REN M X, XU H R, WANG X C. A novel quality evaluation index and strategies to identify scenting quality of Jasmine tea based on headspace volatiles analysis[J]. Food Science & Biotechnology, 2013, 22(2): 331–340.
[5] 韓 婷, 杜 方. 植物萜烯类合成的转录调控研究进展[J]. 山西农业科学, 2020, 48(10): 1686-1692.
HAN T, DU F. Research progress on regulation of transcription factors related to plant terpene[J]. Journal of Shanxi Agricultural Sciences, 2020, 48(10): 1686-1692. (in Chinese)
[6] VEZZARO A, KRAUSE ST, NONIS A, RAMINA A,DEGENHARDT J,RUPERTI B. Isolation and characterization of terpene synthases potentially involved in flavor development of ripening olive (Olea europaea) fruits[J]. Journal of Plant Physiology, 2012, 169(9): 908-14.
[7] 岳跃冲, 范燕萍. 植物萜类合成酶及其代谢调控的研究进展[J]. 园艺学报, 2011, 38(2): 379-388.
YUE Y C, FAN Y P. The terpene synthases and regulation of terpene metabolism in plants[J]. Horticultural Plant, 2011, 38(2): 379-388. (in Chinese)
[8] DEGENHARDT J, KLLNER T G, GERSHENZON J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants.[J]. Phytochemistry, 2009, 69(15): 1621-1637.
[9] 徐娅莹. 佛手萜类芳香物质的器官差异与合成相关基因鉴别[D]. 杭州:浙江大学, 2019.
XU Y Y. Spatial and temporal distribution of volatile terpenoids and identification of formation related genes in finger citron[D]. Hangzhou: Zhejiang University, 2019. (in Chinese)
[10] 文 娟. 蜡梅萜类合成酶基因CpTPS10和CpTPS14的克隆表达与功能研究[D]. 武汉:华中农业大学, 2019.
WEN J. Cloning, expression and functional study of terpenoid synthase genes CpTPS10 and CpTPS14 from Chimonanthus praecox[D]. Wuhan: Huazhong Agricultural University, 2019. (in Chinese)
[11] 王 婷. 百合花香分类、LhTPS基因表达与启动子克隆研究[D]. 晋中:山西农业大学, 2019.
WANG T. Classification of lily flowers, LhTPS gene expression and promoter cloning[D]. Jinzhong: Shanxi Agricultural University, 2019. (in Chinese)
[12] 曾祥玲, 邹晶晶, 王彩云. 桂花萜烯合酶(TPS)的生物信息学与原核表达分析[J]. 广西植物, 2019, 39(5): 624-632.
ZENG X L, ZHOU J J, WANG C Y. Bioinformatic and prokaryotic expression analysis of terpene synthase (TPS) from Osmanthus fragrans[J]. Guihaia, 2019, 39(5): 624-632. (in Chinese)
[13] 刘 偲, 席 婉, 袁金梅, 朱琳琳, 陈洪国, 邹晶晶, 郑日如, 王彩云. 桂花‘莲籽丹桂’芳樟醇合酶基因OfTPS5的克隆及功能鉴定[J]. 园艺学报, 2020, 47(2): 310-320.
LIU S, XI W, YUAN J M, ZHU L L, CHEN H G, ZOU J J, ZHENG R R, WANG C Y. Molecular cloning and functional characterization of linalool synthase gene OfTPS5 in Osmanthus fragrans ‘Lianzi Dangui’ flowers[J]. Horticultural Plant, 2020, 47(2): 310-320. (in Chinese)
[14] 张尚蕊. 基于萜烯合酶家族分析的茶树β-石竹烯合酶筛选与功能验证[D]. 合肥:安徽农业大学, 2020.
ZHANG S R. Screening and functional verification of tea -caryophyllenes synthase based on the analysis of the terpene synthase family [D]. Hefei: Anhui Agricultural University, 2020. (in Chinese)
[15] KARUNANITHI P S, BERRIOS DI, WANG S, DAVIS J, ZERBE P. The foxtail millet (Setaria italica) terpene synthase gene family[J]. The Plant Journal, 2020, 103(2): 781- 800.
[16] 陈 俏, 付雪晴, 颜廷祥, 石 璞, 赫小龙, 唐克轩. 青蒿非分泌型腺毛特异TPS7基因啟动子的克隆及功能分析[J]. 上海交通大学学报(农业科学版), 2016, 34(6): 21-28.
CHEN Q, FU X Q, YAN T X, SHI P, HE X L, TANG K X. Cloning and analysis of the promoter of a non-glandular trichome specific gene TPS7 in Artemisia annua L[J]. Journal of Shanghai Jiaotong University(Agricultural Science), 2016, 34(6): 21-28. (in Chinese)
[17] YU Z, ZHAO C, ZHANG G, SILVA J A T D, DUAN J. Genome-wide identification and expression profile of TPS gene family in Dendrobium officinale and the role of dotps10 in linalool biosynthesis[J]. International Journal of Molecular Sciences, 2020, 21(15): 5419.
[18] MARIANGELA C, PASQUALE C, SIMONE B, GIANDOMENICO C,ANTONIO G, MASSIMO M, RAO R, EMILIO G. TPS genes silencing alters constitutive indirect and direct defense in tomato[J]. International Journal of Molecular Sciences, 2018, 19(9): 2748.
[19] 张书轩. 刺梨GGP基因启动子的克隆、分析及其功能验证[D]. 贵阳: 贵州大学, 2018.
ZHANG S X. Cloning, analysis and functional verification of GGP promoter of rosa Roxburghii Tratt[D]. Guiyang: Guizhou University, 2018. (in Chinese)
[20] 崔 萌, 刘志钦, 叶乃兴, 陈桂信. 茉莉花香气相关基因JsGDS启动子的克隆及功能分析[J]. 分子植物育种, 2021, 19(2): 441-447.
CUI M, LIU Z Q, YE N X, CHEN G X. Cloning and functional analysis of the aroma-related gene JsGDS promoter from Jasminum sambac[J]. Molecular Plant Breeding, 2021, 19(2): 441-447. (in Chinese)
[21] 王万奇, 齐婉竹, 赵秋爽, 曾 栋, 刘 轶, 付鹏跃, 曲冠证, 赵曦阳. 白桦BpJMJ18基因启动子克隆及表达分析[J]. 植物研究, 2020, 40(5): 751-759.
WANG W Q, QI W Z, ZHAO Q S, ZENG D, LIU Y, FU P Y, QU G Z, ZHAO X Y. Cloning and expression analysis of BpJMJ18 gene promoter in Betula platyphylla[J]. Bulletin of Botanical Research, 2020, 40(5): 751-759. (in Chinese)

