羊肚菌菌盖干腐病病原菌鉴定及培养特性研究
黄慧 张晓勇 郑欢 蔡青苡 罗佳佳 罗凯 李树江 杨友联
摘要
菌盖干腐病是羊肚菌Morchella spp.出菇后发生最严重的病害之一,常给羊肚菌生产造成较大损失。为明确引起贵州六盘水地区羊肚菌菌盖干腐病致病菌种类,采用单孢分离法从六盘水地区3个羊肚菌栽培点的菌盖干腐病样品上分离到9个菌株。基于形态学及ITS和LSU基因序列分析将9个菌株鉴定为长孢卵单隔孢霉Diplospora longispora。培养特性研究表明,该菌最适的培养基为PCA,最适氮源为蛋白胨与硝酸铵,最适碳源为葡萄糖与麦芽糖,菌丝生长及孢子萌发最适温度为15~25℃,最适pH为6~10;当温度超过30℃菌丝即停止生长,孢子无法萌发。
关键词
羊肚菌;菌盖干腐病;长孢卵单隔孢霉;系统鉴定;培养特性
中图分类号:
S436.461
文献标识码:A
DOI:10.16688/j.zwbh.2020537
Identification and cultural characterization of Diplospora longispora associated with pileus rot disease on cultivated morel
HUANG Hui1,ZHANG Xiaoyong1,ZHENG Huan1,CAI Qingyi1,LUO Jiajia1,
LUO Kai2,LI Shujiang1,YANG Youlian1*
(1. School of Biological Sciences and Technology, Liupanshui Normal University, Liupanshui553004, China;
2. Liupanshui Academy of Agricultural Sciences, Guizhou Province, Liupanshui553004, China)
Abstract
Pileus rot disease widely occurs and often causes serious yield losses of cultivated morel. In order to identify the pathogen of pileus rot disease, nine strains were obtained by singlespore isolation in three cultivation sites of Liupanshui city. Based on morphological characteristics and ITS and LSU sequence analysis, the nine strains were identified as the same species, Diplospora longispora. Cultural characterization showed that PCA was the optimal medium for colony growth, the optimal nitrogen sources were peptone, ammonium nitrate, and the optimal carbon sources were glucose and maltose. The best temperature and initial pH ranges for spore germination and mycelial growth were 15 25℃ and 6 10, respectively. When the temperature exceeded 30℃, the mycelium stopped growing and the spores failed to germinate.
Key words
morel;pileus rot disease;Diplospora longispora;phylogenetic analysis;cultural characteristics
羊肚菌Morchella spp. 是一類珍稀的大型食用真菌,其营养丰富,味道鲜美,深受消费者青睐。人工种植的羊肚菌普遍发生各种真菌性病害,常常造成较为严重的经济损失。目前,在羊肚菌上报道的真菌病害主要有由变红镰刀菌Fusarium incarnatum和木贼镰刀菌F.equiseti交互引起的烂柄病(stipe rot)[1]、长毛拟青霉Paecilomyces penicillatus引起的白霉病(white mold disease)[2]、长孢卵单隔孢霉Diplospora longispora引起的菌盖干腐病(pileus rot disease)[3]及曲霉Aspergillus sp.引起的羊肚菌白腐病(morel white rot)[4]。
近年来,随着贵州六盘水市羊肚菌种植面积不断扩大,菌盖干腐病已成为种植中最大的风险点之一。菌盖干腐病属低温型病害,在每年的2月—4月,温度10~20℃、湿度较大的拱棚下暴发较为严重。该病先在羊肚菌菌盖上形成白色绒毛状小菌落,后随着病害部位扩大而逐渐萎缩、干枯和穿孔,国内学者还将其称为霉菌性枯萎病[5]。
前人对羊肚菌菌盖干腐病已有一定研究,但在病原菌的系统分类鉴定上还存在很多不足,对病原菌的生长特性也还缺乏相关的研究,不利于该病的田间识别及防治。本研究对六盘水羊肚菌主产区广泛发生的菌盖干腐病样品进行病原菌的分离与鉴定,并研究了病原菌的最佳生长条件等,旨在为羊肚菌菌盖干腐病田间准确识别及防治提供理论支持。
1材料与方法
1.1病害调查与病原菌分离
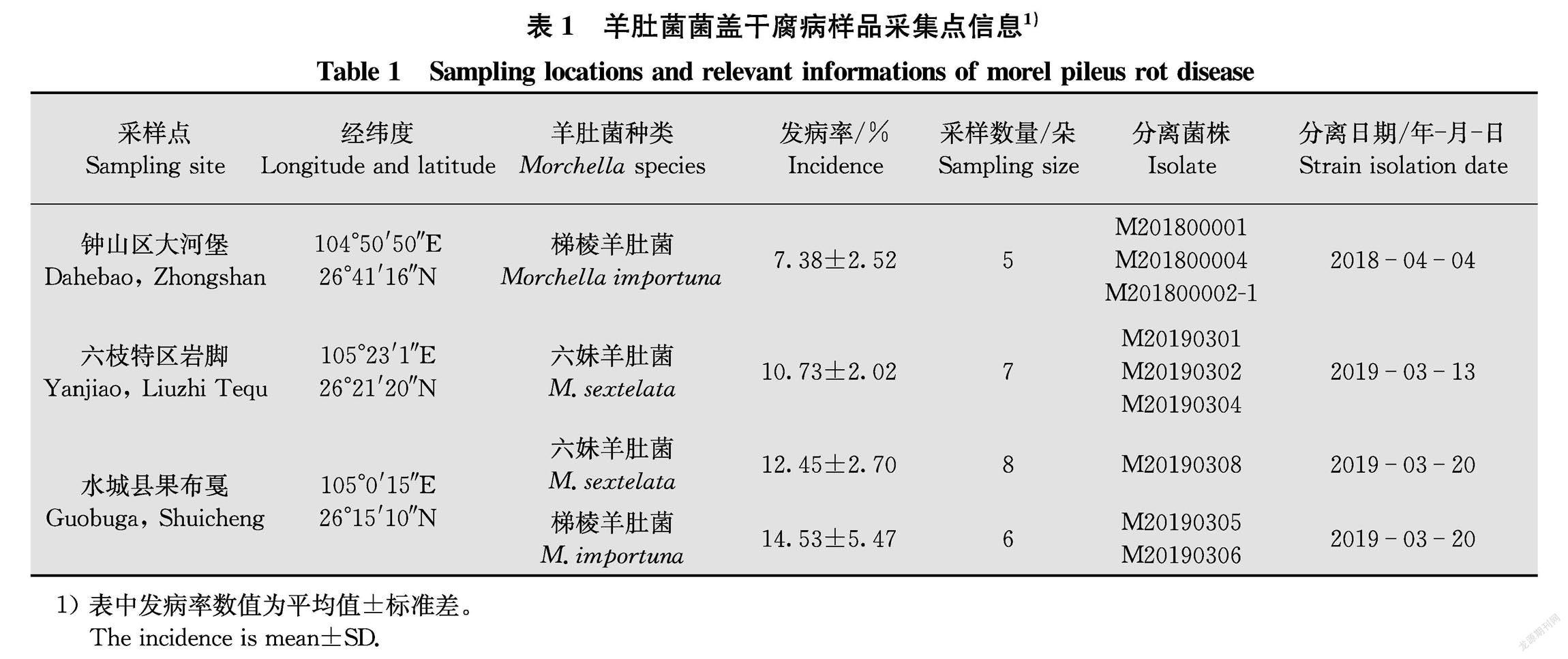
于2018年和2019年羊肚菌收获季节分别从贵州六盘水钟山区大河堡、六枝特区岩脚和水城县果布戛3个羊肚菌规模化种植基地进行该病的调查和取样。 在每个栽培点随机选取3个小拱棚进行菌盖干腐病发病率统计。将采集的菌盖干腐病羊肚菌单独装入保鲜袋中带回实验室,用单孢分离法从各点感病羊肚菌病害部位分离得到9个菌株(表1)。菌株在PDA试管斜面上培养15 d后置于4℃ 保藏备用。
1.2病原菌形态学鉴定
将菌株接种于PDA(potato dextrose agar)平板,置于25℃进行活化培养。用6 mm直径打孔器从菌落边缘打取菌饼接入另一个PDA平板中央,设置3次重复,在25℃自然光照下培养10 d后测量菌落直径,观察菌落特征。收集菌落表面菌丝和子实体,以蒸馏水为载浮剂制备临时装片,置于显微镜下观察菌株形态特征。
1.3病原菌分子鉴定
将供试菌株以三点法接种于PDA平板培养基上,置于25℃恒温培养15 d后刮取菌丝,用改良的CTAB法提取菌株DNA[6]。扩增的目的序列分别为内转录间隔区(ITS)和28S 核糖体大亚基序列(rDNALSU)2个基因片段。选用真菌rDNAITS 通用引物ITS1和ITS4扩增ITS片段,选用引物LROR和LR5 扩增大亚基LSU片段,PCR反应体系及扩增程序参考Maharachchikumbura等[7]的方法。扩增产物经1% 琼脂糖凝胶电泳检测后,由北京擎科生物技术有限公司进行纯化和测序。将所得序列在GenBank中运用BLAST进行同源序列检索,查找与其相似性较高的菌株,用MEGA X软件以邻接法(neighborjoining, NJ)构建系统发育树,确定菌株的分类地位。
1.4菌株致病性鉴定
取新鲜、健康无损伤的尖顶羊肚菌Morchella conica子实体,用75%乙醇喷雾菌盖后,用无菌水轻轻冲洗3次,无菌吸水纸吸干水珠后放置于超净工作台中吹干表面水分。菌柄切口处用无菌湿棉球包住后平置于塑料盒内,吸取50 μL 106个/mL孢子悬浮液滴于菌盖凹坑内,每朵接种1点。试验重复3次。接种后盖好盖子放置于20℃黑暗培养5 d观察发病情况。
1.5菌株生长和孢子萌发的最佳培养温度及pH
用6 mm打孔器打取菌落边缘菌饼单点接种于PDA平板中央,并分别置于0、5、10、15、20、25、30℃和35℃等8个温度环境中,10 d后测量菌落直径。用1 mol/L的NaOH或HCl分别调节PDA培养基pH至4、5、6、7、8、9、10、11、12和13等10个梯度,将打取的菌饼(d=6 mm)单点接种于不同pH的PDA平板中央,置于25℃下培养10 d后测量菌落直径。试验设置3次重复。用移液枪吸取100 μL 106个/mL孢子悬浮液加入PDA平板,均匀涂布后分别置于上述8个温度环境中;取100 μL孢子悬浮液均匀涂布于上述不同pH的PDA平板上,放置于25℃自然光照条件下进行培养。2 d后将不同温度和pH处理下的涂布平板置于Olympus BX51显微镜10×10低倍镜下随机选取10个视野统计分生孢子萌发情况。每个温度和pH设置3次重复。
1.6菌株最佳培养基配方、碳源和氮源筛选
(1)最佳培养基筛选。设置PDA培养基、查氏培养基CHM(NaNO3 3 g,K2HPO4 1 g,MgSO4 ·7H2O 0.50 g,KCl 0.50 g,FeSO4 0.01 g,蔗糖30 g,琼脂粉15 g,蒸馏水1 000 mL,pH 7.0~7.2)[8]、平板计数琼脂培养基PCA(胰蛋白胨5 g,酵母膏粉2.5 g,葡萄糖1 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0±0.2)、合成低营养琼脂培养基SNA(KH2PO40.2 g,KCl 0.2 g,KNO3 1.0 g,MgSO4·7H2O 0.5 g,葡萄糖0.2 g,琼脂15 g,蒸馏水1000 mL,自然pH)[9]和沙氏固体培养基SDA(蛋白胨10 g,琼脂20 g,葡萄糖40 g,蒸馏水1 000 mL,自然pH)[10]来研究不同培养基对菌株菌丝体生长的影响。用6 mm打孔器在活化菌株菌落边缘打取菌饼分别接种于上述培养基平板中央,置于25℃自然光照條件下培养10 d后测量各平板内菌落直径(mm),试验设置3次重复。
(2)碳源、氮源筛选。以查氏培养基CHM为基础培养基,分别将其中的蔗糖以同质量的葡萄糖、麦芽糖、可溶性淀粉和甘油替换,即得不同碳源的培养基;将查氏培养基中的硝酸钠以同质量的硝酸钾、氯化铵、硫酸铵和蛋白胨替换配制成不同氮源的培养基。置于25℃的自然光条件下培养10 d后测量各处理平板上的菌落直径(mm),试验设置3次重复。
1.7数据处理与分析
采用DPS v7.05软件进行数据方差分析和多重比较。
2结果与分析
2.1病害调查与菌株形态学鉴定
调查发现,几乎所有的羊肚菌种植地都发现感染菌盖干腐病的子实体,但各地发病情况不一,发病率普遍在5%~15%,部分发病较重的小拱棚内可达20%以上,给人工种植羊肚菌的产量和质量造成较为严重影响(表1)。
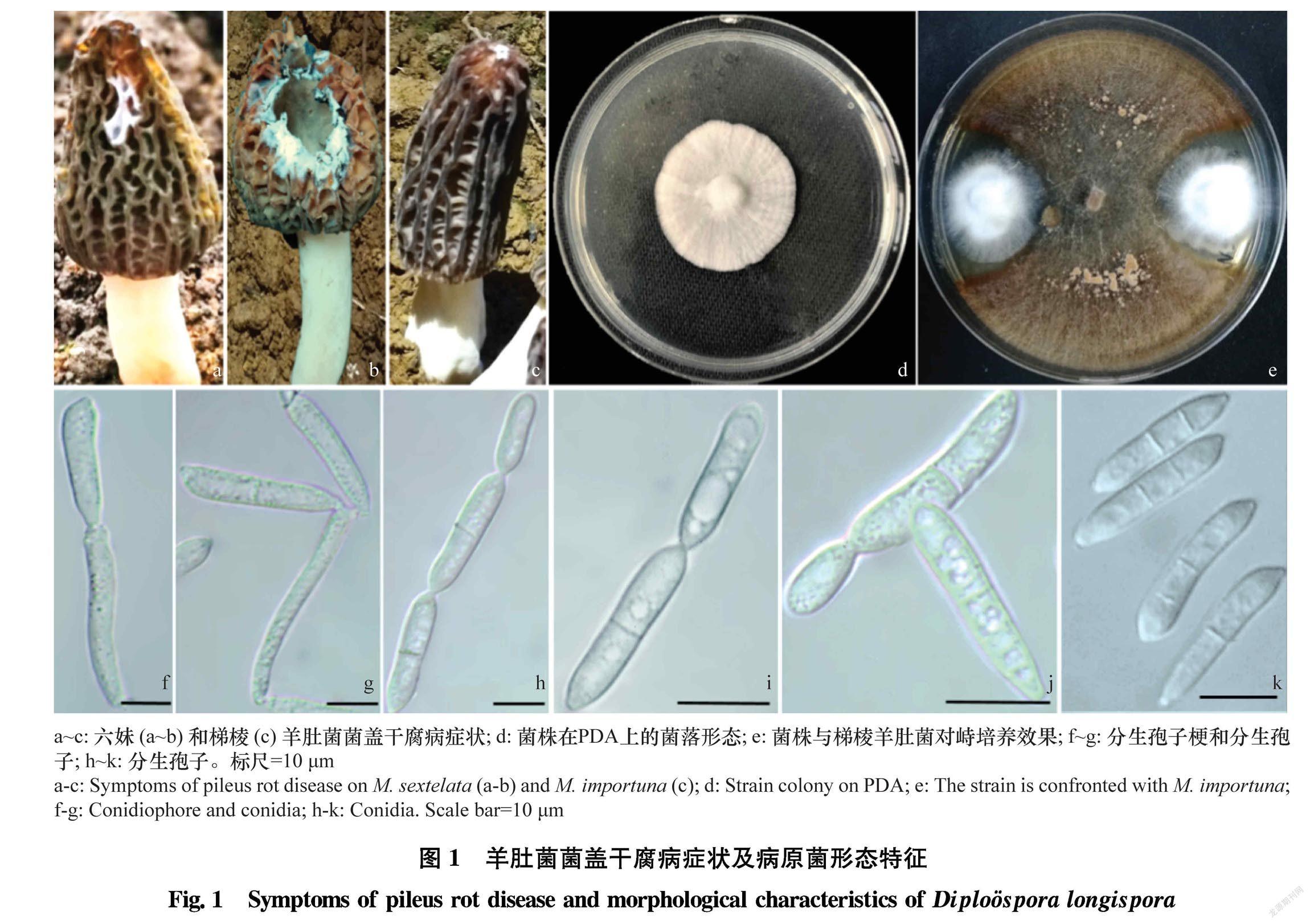
菌盖干腐病主要发生于菌盖,菌柄上少见。该病发病初期在羊肚菌菌盖上形成5~10 mm不规则白色绒毛状霉斑,后逐渐扩大,侵染部位萎缩、干枯甚至形成10~20 mm的大穿孔(图1a~c)。在PDA平板上,菌株在25℃下培养10 d菌落直径31~35 mm,边缘整齐,表面干燥,雪白色绒毛状,有明显轮状花纹,背面淡黄色(图1d)。与梯棱羊肚菌于平板内对峙培养下,菌株早期可释放抑制羊肚菌菌丝生长的代谢产物,形成明显的抑菌圈,后病原菌菌丝侵入羊肚菌菌落内(图1e)。分生孢子梗透明,细长,棍棒状,大小为(23.25~75.20) μm ×(1.91~3.72) μm,平均(56.22±15.2) μm×(3.22±0.43) μm (n=30),顶端形成1~2串分生孢子链,分生孢子脱落后留下明显的凸痕(图1f~g)。 分生孢子全为链生,透明,棍棒状或长柠檬形,大小为(16.25~22.18) μm×(3.68~5.79) μm,平均 (20.41±4.95) μm ×(4.78±0.63) μm(n=30),常有圆形或椭圆形疣点,1~3个隔(多为1个),隔处稍缢缩(图1h~k)。基于形态特征分析,初步将9个菌株鉴定为长孢卵单隔孢霉Diplospora longispora Matsushima T.[10]。
2.2菌株分子生物学鉴定
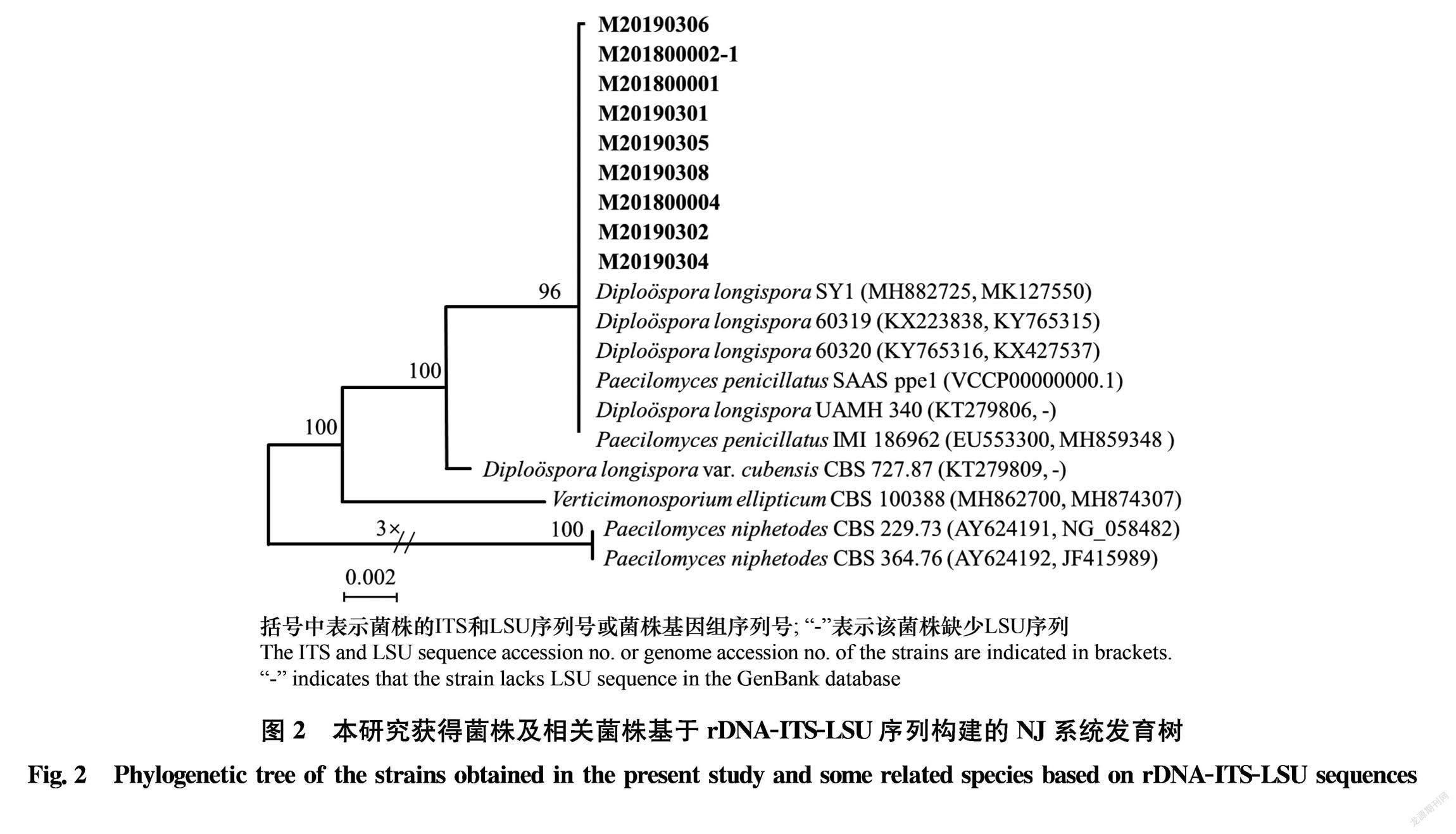
将本研究获得的9株菌株的ITS和LSU序列与从GenBank中下载的10个同源性较高的序列,以Paecilomyces niphetodes CBS 229.73和P.niphetodes CBS 364.76作为外类群,用MEGA X软件构建NJ系统发育树(图2)。9个菌株都与长毛拟青霉P.penicillatus和长孢卵单隔孢霉以96%的支持率聚为一支。结合形态特征,长毛拟青霉的安瓿瓶状小梗一般3~5个聚合为扫帚状,分生孢子为无隔的单细胞,椭圆形或梨形,大小仅为(6~7.5) μm×(4.0~5.0) μm,与长孢卵单隔孢霉差异非常大[10 11]。因此基于形态学及rDNAITSLSU基因序列分析,将9个菌株鉴定为Diplospora longispora Matsushima T.
2.3菌株致病性测定
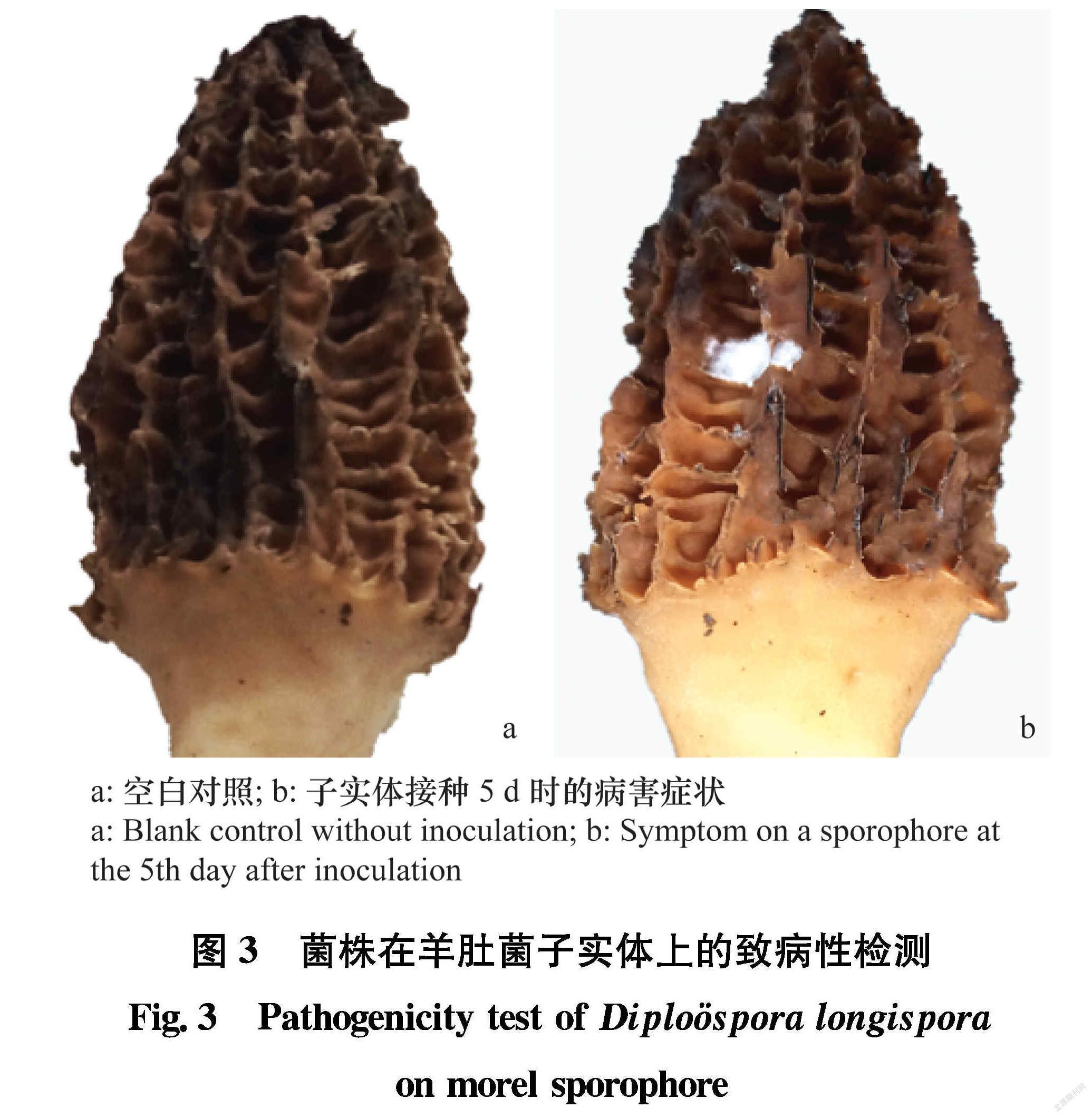
将菌株接种于健康羊肚菌菌盖上,20℃下培养5 d后,接种处形成5~10 mm左右的白色霉层,被侵染的菌褶出现坏死、干枯,与田间早期症状一致(图3)。再次挑取白色霉层进行分离,所得菌株菌落及形态特征与原菌株一致。
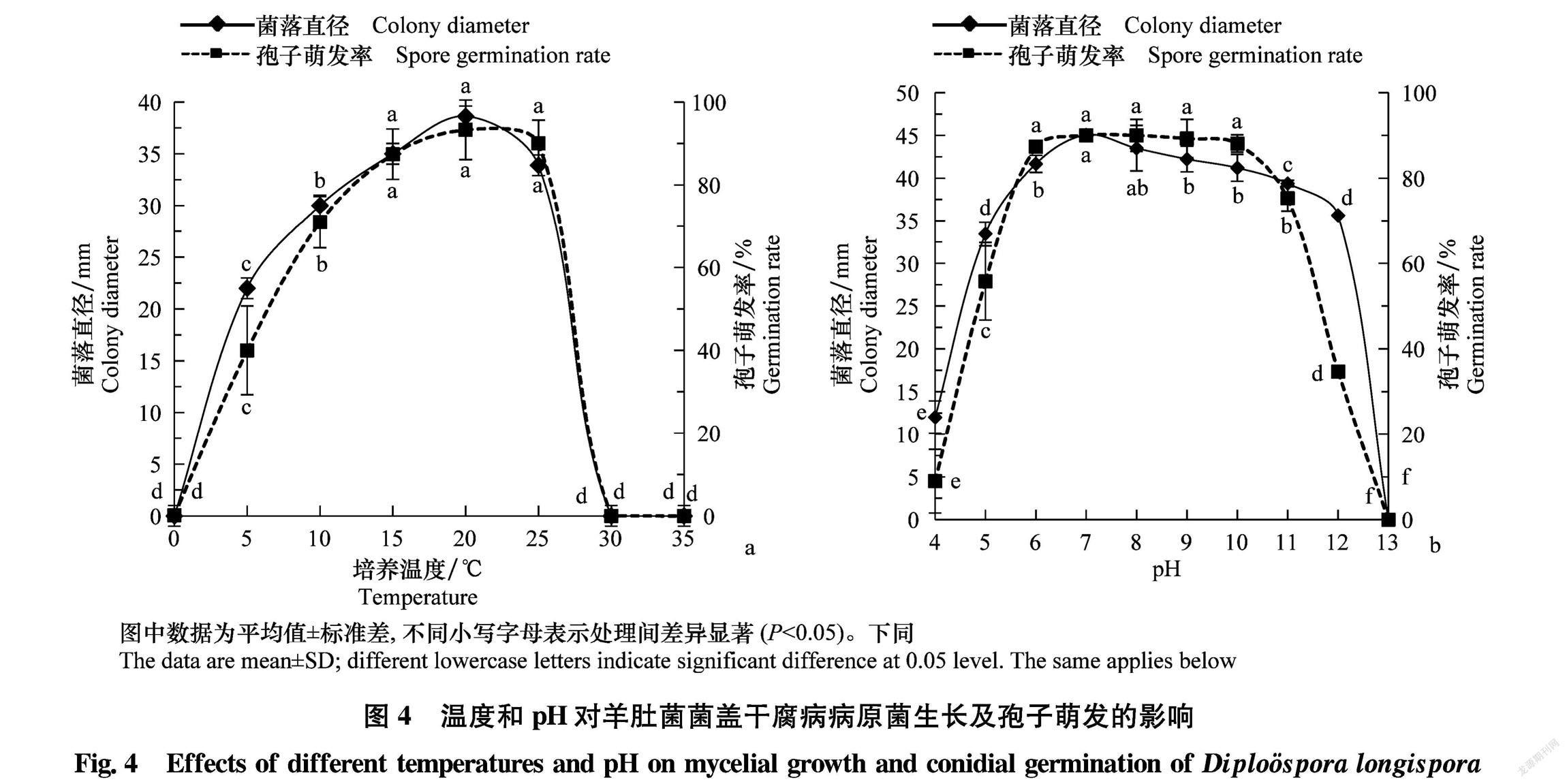
2.4培养温度和pH对菌株生长及孢子萌发的影响
不同培养温度和pH对病原菌生长及孢子萌发的影响均达到显著水平(图4)。
5~25℃菌丝均可生长,孢子可萌发,在15~25℃处理下菌丝生长和孢子萌发率差异不显著,温度超过30℃菌丝停止生长,孢子不萌发(图4a)。说明该菌对冷凉环境适应性较强,菌丝生长及孢子萌发最适温度为15~25℃,不耐30℃以上的高温。该菌对培养基pH的要求不严格,在pH 4~12范围内孢子可部分萌发,菌丝可正常生长, pH 6~11适宜菌丝生长,尤以pH 7时生长最快;分生孢子 在pH 6~10时萌发率显著高
于其他处理(图4b)。说明该菌孢子萌发的最适pH为6~10。
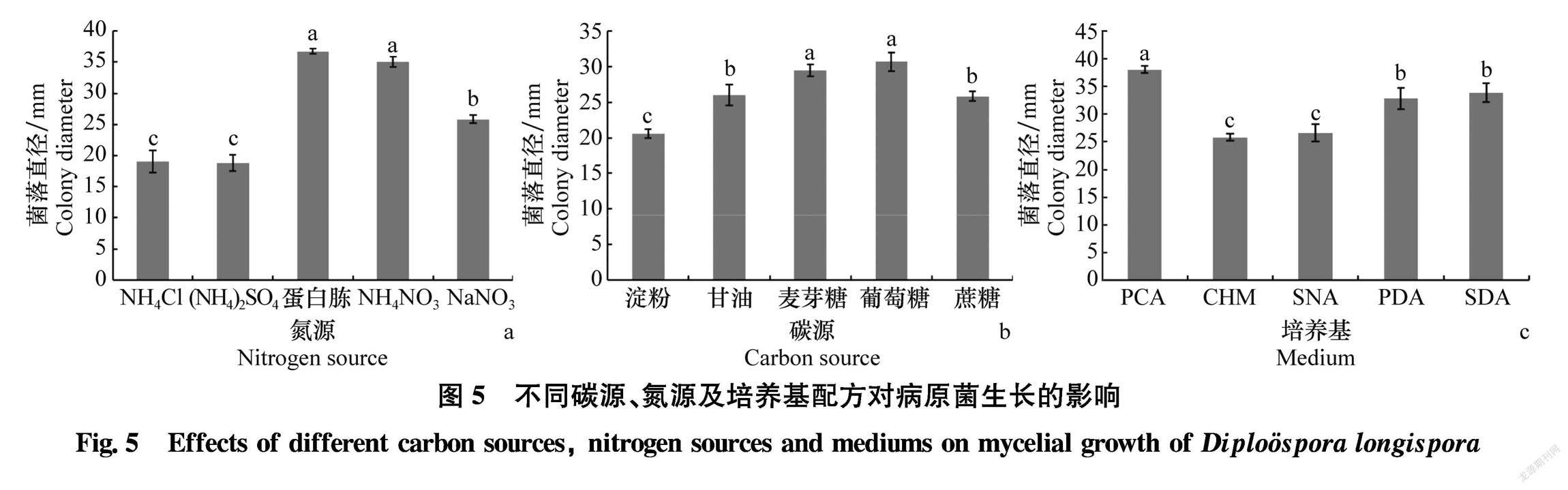
2.5碳源、氮源和不同培养基对病原菌生长的影响
不同氮源、碳源及培养基处理对病原菌生长的影响达到显著水平(图5)。该菌在以蛋白胨与硝酸铵为氮源的培养基中生长速率显著高于其他氮源处理,说明该菌的生长对氮素要求较高(图5a)。菌株在以葡萄糖和麦芽糖为碳源的培养基中的菌落直径显著大于其他处理(图5b);不同培养基显著影响菌株生长,菌株在PCA培养基上的生长速率显著高于其他培养基,沙氏培养基与PDA次之,在查氏培养基和合成培养基中生长速率最为缓慢,再次印证该菌生长对氮源需求较高(图5c)。说明该菌最适氮源为蛋白胨与硝酸铵,最适碳源为葡萄糖与麦芽糖,最适生长培养基为PCA。
3讨论
菌盖干腐病也称霉菌性枯萎病,是羊肚菌人工种植中危害最为严重的病害之一。广泛栽培的梯棱羊肚菌M.importuna、六妹羊肚菌M.sextelata和七妹羊肚菌M.eptimelata等都可感染此病[12],该病害在早春羊肚菌发菇和收获期间传播迅速,常造成较为严重的产量、质量损失。本研究中,9个菌株经ITS和LSU序列联合分析与长毛拟青霉和长孢卵单隔孢霉以极高支持率聚为一支,这与前人用ITS序列分析所得出的结果一致[3]。长毛拟青霉和长孢卵单隔孢霉都是在20世纪70年代根据形态特征确立的,二者除了都有链生的分生孢子外,其他形态特征差异极大。长毛拟青霉的分生孢子链基部是一个安瓿瓶状的小梗,且3~5个聚合形成扫帚状的分生孢子梗,而长孢卵单隔孢霉的分生孢子梗细长,顶部直接着生1~2串链状分生孢子,无小梗结构;其次,二者最明显的差异在于分生孢子结构,长毛拟青霉的分生孢子为无隔的单细胞,椭圆形或梨形,大小仅为(6.0~7.5) μm×(4.0~5.0) μm,而长孢卵单隔孢霉的分生孢子为棍棒状或长柠檬形,大小为(16.25~22.18) μm×(3.68~5.79) μm,有1~3个隔将孢子分隔为2~4个细胞[10 11]。基于形态学及ITS和LSU序列分析,将本研究的9个菌株鉴定为长孢卵单隔孢霉。
在症状上,羊肚菌菌盖干腐病与He等报道的白霉病高度相似,如发病条件及早期菌盖上雪白色的霉层,以及后期病斑干枯、收缩直至穿孔等特征[2]。有学者认为羊肚菌白霉病就是菌盖干腐病,He等也通过ITS序列分析发现长毛拟青霉与长孢卵单隔孢霉高度同源[2],但部分研究指出仅凭ITS序列分析而未经严格的形态学比较即将病原菌鉴定为长毛拟青霉,其鉴定过程缺乏严谨性和科学性[3 5]。研究已证实拟青霉属Paecilomyces是一个复合属,形态相近的两个种其DNA碱基序列可能差异很大[13]。从目前在GenBank上发布的Diplospora属相关序列来看,这个属极有可能也是复合属,已报道的長孢卵单隔孢霉及其两个亚种与Diplospora属已登记的其他5个种的ITS碱基序列差异很大,从理论上来讲可能并不都属于Diplospora属,但由于已报道的种极少,难以建立系统性的分类标准,更多分类细节还需进一步研究予以验证。
在生产中发现,从未种植过羊肚菌的大棚内也会暴发菌盖干腐病。长孢卵单隔孢霉的来源可能有两个。He等认为长孢卵单隔孢霉是羊肚菌的内生菌,他们从健康的梯棱羊肚菌中分离到长孢卵单隔孢霉,且分离频率高达10%[3]。但不排除他们的分离材料已感染了病原菌,但还未表现症状。我们在大量纯培养的羊肚菌平板上未发现类似长孢卵单隔孢霉的污染菌落。从GenBank和USDA中已报道的菌株来看,长孢卵单隔孢霉还可从豪猪粪便、人类皮肤、芋Colocasia antiquorum var. esculenta和代儿茶Dichrostachys cinerea等多种材料上分离得到[14 15],说明长孢卵单隔孢霉在环境中有一定分布,在条件适宜时即可导致羊肚菌发生菌盖干腐病。
本研究发现,长孢卵单隔孢霉对不同pH的适应性极强,菌丝在pH为6~11的条件下都可较快生长,孢子萌发率也高于50%,而多数羊肚菌栽培种菌丝及子实体生长最适pH为6.5~7.5,pH超过8即显著抑制菌丝生长和子实体形成[16],说明传统的石灰土壤消毒法不但不能有效抑制该菌在土壤中的潜藏,还会造成羊肚菌减产。本研究表明,长孢卵单隔孢霉在30℃以上的温度下其菌丝停止生长,孢子也失去萌发性能,说明该菌对高温非常敏感,在生产中可以利用这一特征来防治该菌对羊肚菌的侵染,如利用火焰消毒法对栽培地进行高温消毒,降低羊肚菌栽培土壤中病害初侵染源的数量。杜习慧等调查发现,在野外火烧迹地里很容易发现野生羊肚菌,且第一年大量出菇, 在随后的2~3 年里逐渐消失[17],极有可能与高温火烧改变病原菌在土壤里的种群分布有直接的关系,下一步还需进一步研究。
参考文献
[1]GUO Mengpei, CHEN Kang, WANG Gangzheng, et al. First report of stipe rot disease on Morchella importuna caused by Fusarium incarnatum, F.equiseti species complex in China [J]. Plant Disease, 2016, 100(12):2530.
[2]HE Xiaolan, PENG Weihong, MIAO Renyun, et al. White mold on cultivated morels caused by Paecilomyces penicillatus [J]. FEMS Microbiology Ecology, 2017, 364(5): 1-5.
[3]HE Peixin, LI Congcong, CAI Yingli, et al. First report of pileus rot disease on cultivated Morchella importuna caused by Diplospora longispora in China [J]. Journal of General Plant Pathology, 2017, 84(1): 65 69.
[4]余苗, 尹琪, 何培新. 羊肚菌白腐病病原菌的分离与鉴定[J]. 北方园艺, 2020(7): 142-145.
[5]刘伟, 蔡英丽, 何培新, 等. 羊肚菌栽培的病虫害发生规律及防控措施[J]. 食用菌学报, 2019, 26(2):128 -134.
[6]张颖慧, 魏东盛, 邢来君, 等. 一种改进的丝状真菌DNA提取方法[J]. 微生物学通报, 2008, 35(3):466 -469.
[7]MAHARACHCHIKUMBURA S S N, GUO Liangdong, CAI Lei, et al. A multilocus backbone tree for Pestalotiopsis, with a polyphasic characterization of 14 new species [J]. Fungal Diversity, 2012, 56(1):95- 129.
[8]周晓榕, 高翔, 王建国, 等. 营养和农药对蜡蚧轮枝菌生长发育的影响[J]. 植物保护, 2006, 32(5): 23- 25.
[9]张晓勇, 李树江, 王亮, 等. 山茶灰斑病病原菌鉴定及防治药剂初步筛选[J]. 植物保护, 2019, 45(4): 209 215.
[10] MATSUSHIMA T. Icones microfungorum a matsushima lectorum [M]. Japan: Kobe, 1975: 61.
[11] SAMSON R A. Paecilomyces and some allied Hyphomycetes [J]. Studies in Mycology, 1974, 6:1-119.
[12] 刘伟, 蔡英丽, 何培新, 等. 羊肚菌栽培的病虫害发生规律及防控措施[J]. 食用菌学报, 2019, 26(2):128 134.
[13] INGLIS P, TIGANO M. Identification and taxonomy of some entomopathogenic Paecilomyces spp. (Ascomycota) isolates using rDNAITS sequences [J]. Genetics and Molecular Biology, 2006, 29(1):132-136.
[14] U.S. National Library of Medicine. National center for biotechnology information [EB/OL]. [2021 01 30]. https:∥www.ncbi.nlm.nih.gov.
[15] United States Department of Agriculture. Agricultural research service: fungal databases [EB/OL]. [2021 01 30]. https:∥nt.arsgrin. gov/fungaldatabases.
[16] 賀新生. 羊肚菌生物学基础、菌种分离制作与高产栽培技术[M]. 北京: 科学出版社, 2017: 82.
[17] 杜习慧, 赵琪, 杨祝良. 羊肚菌的多样性、演化历史及栽培研究进展[J]. 菌物学报, 2014,33(2):183 197.
收稿日期:2020-10-13修订日期:2020-11-27
基金项目:
贵州省特色重点实验室建设项目(黔教合KY 字[2017]012);2019年贵州省大学生创新创业训练计划(20195201506);六盘水市科技计划(520202016HK07,5202020180307);2018年度六盘水师范学院项目“微生物学教学团队”(LPSSYjxtd201802)
* 通信作者
Email:547086119@qq.com

