手术联合125I粒子治疗口腔涎腺腺样囊性癌患者可能作用机制分析
李立恒, 周 军, 张 敏, 王 芹, 安 峰, 张丽娟, 汪 佳, 张 凡
(1.河北北方学院附属第一医院, 河北 张家口 0750002.河北省张家口市第一医院口腔科, 河北 张家口 0750003.张家口学院临床学院, 河北 张家口 075000)
涎腺腺样囊性癌(ACC)是口腔颌面常见恶性肿瘤,手术切除是治疗ACC的主要方法,因ACC独特的肿瘤解剖部位及生物学特性、以及功能保存的需要,常导致手术切除部位及范围不足,术后易发生血行转移、局部复发的风险[1]。外照射辅助治疗因使用剂量受限,可能影响辅助治疗临床疗效[2]。植入125I粒子近距离放射治疗在保证肿瘤靶区较高照射剂量的同时,能有效减少对靶区外正常组织的损伤[3]。相关研究表明,ACC是一种侵袭性强、具有高度转移潜能的恶性肿瘤,血行转移是其主要生物学特征,各种相关生长因子异常表达,也是影响术后疗效的主要因素[4]。抑制血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFEG)、基质金属蛋白酶-9(MMP-9)表达已成为治疗ACC的关键“靶点”[5]。本文以此为切入点,分析手术联合125I粒子治疗ACC患者临床疗效及可能作用机制。
1 资料与方法
1.1一般资料:选择2016年4月至2018年3月收治的ACC患者86例为研究对象,采用随机数字表法分为观察组和对照组各43例。其中:观察组随访脱落2例,对照组随访脱落4例,最终纳入病例80例。男36例,女44例,年龄25~72岁,平均(51.50±7.21)岁。两组ACC患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
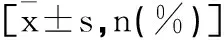
表1 两组ACC患者一般资料比较
1.2纳入标准与排除标准:纳入标准:①均符合涎腺ACC相关诊断标准,且经术后病理检查确诊;②有明确的手术指征,且行切除术或根治术治疗者;③TNM分期Ⅰ~Ⅳ期;④无远处转移者。排除标准:①术前接受放化疗者;②合并其他恶性肿瘤者;③合并严重心、肝、肾等脏器功能障碍者;④随访脱落者。
1.3方法:对照组行手术治疗。明确组织诊断后,采取原发灶部分切除术、局部扩大切除术、联合根治性切除术等方法,术中保证手术安全边缘,尽量切除干净可能侵犯的周围组织。观察组采用手术联合125I粒子治疗。125I粒子采用术中同期植入法,肿瘤切除后,采用德国Brain LAB 公司Vector Vision Compact导航系统获取术中图像,导入北京飞天兆业科技有限公司三维立体定向放射治疗计划系统(TPS),勾画靶区,覆盖肿瘤及手术切除范围(向外扩展10~15mm)。对于手术切缘阴性者,给予处方剂量60~80Gy;对于切缘安全距离不足或有肿瘤残余者,给予处方剂量80~120Gy。计划完成要求:至少95%靶体积位于100%处方剂量曲线内,95%靶体积接受剂量超过处理剂量。根据治疗计划,依次植入所有I粒子(北京智博高科技生物技术有限公司),粒子平行排列(间距10mm)。
1.4观察指标:①临床疗效:随访3年,参照WHO“实体瘤疗效评价标准”(RECIST)[7],分为完全缓解(病变完全消失且维持时间≥4周)、部分缓解(肿瘤病灶最大径与最大垂直径乘积减少>50%,维持时间≥4周)、稳定(肿瘤病灶两径乘积减少<25%或增大<25%)、病变进展(肿瘤病灶两径乘积增大>25%或出现新病灶)。缓解率=(完全缓解+部分缓解)/总例数×100%;疾病控制率=(完全缓解+部分缓解+稳定)/总例数×100%。②血清生长因子:治疗前,治疗6个月,采集患者空腹静脉血4mL,3000r/min离心10min取血清,采用日立7600型全自动生化分析仪检测VEGF、bFEG、MMP-9含量。检测方法:酶联免疫吸附法,试剂均来自北京晶美生物工程有限公司。
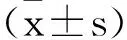
2 结 果
2.1临床疗效比较:随访3年,两组均无死亡病例。观察组ACC患者缓解率、控制率高于对照组(P<0.05)。见表2。
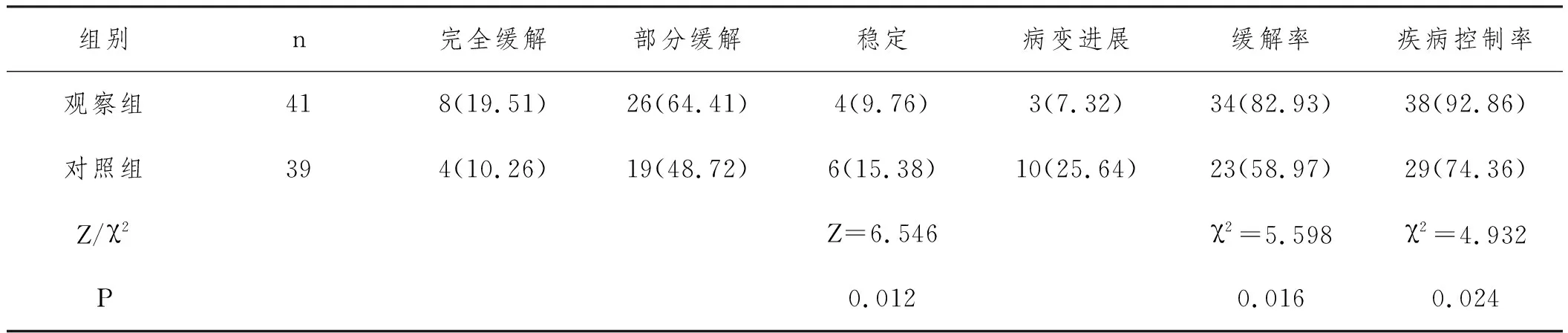
表2 两组ACC患者临床疗效比较n(%)
2.2相关生长因子含量比较:治疗前,两组ACC患者血清VEGF、bFEG、MMP-9含量比较,差异无统计学意义(P>0.05);治疗6个月,两组患者血清VEGF、bFEG、MMP-9含量低于同组治疗前(P<0.05),观察组ACC患者血清VEGF、bFEG、MMP-9含量低于对照组(P<0.05)。见表3。
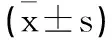
表3 两组ACC患者治疗前后相关生长因子含量比较
3 讨 论
ACC好发于涎腺,约占涎腺恶性肿瘤的24%,因其极易侵袭神经并沿神经生长,被誉为最具破坏性和不可预见性的头颈部恶性肿瘤[8]。在不影响正常功能的情况下尽可能完全切除肿瘤组织是治疗ACC的主要原则,但临床很难做到这一点[9]。术后辅助放化疗的目的在于根除残存癌细胞,控制复发率,但ACC是对放化疗敏感性较差的恶性肿瘤,增强放化疗剂量又存在放射性损伤的风险。如何寻找有效的术后辅助治疗方案,一直是ACC临床治疗关注的焦点。
近距离放射治疗是将放射源置入肿瘤组织或肿瘤组织旁进行照射的一种方法,通过CT等影像确定置入位置、勾画靶区、设计置入剂量,能保证最佳放射治疗效果[10]。125I粒子属于一种低能量放射性核素,半衰期约60d,有效放射半径1.7cm,体内有效作用时间长达120d。低能量使其治疗射线穿透组织不到1cm,几乎不损伤周围正常组织。靶区内高放射剂量持续照射能有效抑制肿瘤细胞有丝分裂,最大程度杀伤肿瘤细胞[11]。125I粒子植入治疗也被称为“粒子刀”、“立体伽玛刀”,可达到手术刀式的“靶向”治疗效果。李聪等[12]研究报道,手术联合125I粒子植入治疗口腔颌面ACC患者,3年局部控制率、无瘤生存率分别为90.0%、73.9%,本文研究中,随访3年,观察组ACC患者缓解率、疾病控制率分别为82.93%、92.86%,说明手术联合125I粒子治疗ACC患者效果值得肯定。
ACC发病机制尚不十分清楚,但可以肯定是,ACC属于一种具有高度生长发育转移潜能的恶性肿瘤。VEGF可通过增强血管通透性等途径,促进肿瘤细胞的生长与新生毛细血管网的建立。也可通过促进内皮细胞增殖等途径,促进新生毛细胞血管的形成[13]。bFGF为成纤维细胞有丝分裂原,可通过促进血管生成等途径,诱导肿瘤细胞侵袭和转移。MMP-9可通过降解细胞外基膜、诱导VEGF释放等途径,促进癌细胞生长和侵袭[14]。相关研究表明,ACC患者血清VEGF、bFGF、MMP-9含量异常升高,且升高程度与ACC病理分级明显相关[15]。125I粒子照射射线能直接作用于生物大分子,促进生物大分子的电离,破坏具有生命功能的核酸、蛋白质和酶等机体物质。也可通过作用于水产生一系列辐射分解产物,间接作用于生物大分子,诱导其物理与化学变化。同时电离辐射也可诱导肿瘤供血管内皮细胞损伤,阻断肿瘤血供,造成局部性坏死。基础研究表明,125I能有效抑制涎腺ACC模型大鼠成瘤细胞中MMP-2、VEGF的表达[16]。本文研究中,治疗6个月,观察组患者血清VEGF、bFEG、MMP-9含量低于对照组,郭洁等[17]将125I粒子置入应用于肝癌切入术后患者(30例),也有类似的文献报道,说明手术联合125I粒子可能通过降低血清VEGF、bFEG、MMP-9含量,实现抑制肿瘤生长和侵袭的目的。
本文研究结果表明,手术联合125I粒子治疗可能通过降低血清VEGF、bFEG、MMP-9含量,抑制肿瘤生长等途径,达成提高口腔涎腺ACC患者临床疗效的目的。需要指出的是,本文仅仅分析了手术联合I粒子治疗影响ACC患者相关生长因子的表象,尚缺乏具体路径的深入分析,同时也缺乏临床疗效与VEGF、bFEG、MMP-9的相关性分析,需要后续研究中不断完善。

