胎盘早剥孕妇血液中凝血因子等参数的变化研究
路艳辉
胎盘早剥为妊娠晚期严重并发症,若能及时发现,可避免弥散性血管内凝血(DIC)以及孕妇胎儿其他严重不良结局[1,2]。胎盘早剥是指妊娠20周或分娩期,正常位置的胎盘在胎儿娩出前,部分或全部从子宫壁剥离,胎盘早剥起病隐匿、进展快、症状重,是妊娠晚期出血的重要原因之一,由于胎盘附着部位、剥离部位、剥离程度不同,临床表现差异很大,若处理不及时可威胁母儿生命,是产科临床工作中常见且较严重并发症之一,易造成严重并发症,新生儿结局也较差。胎盘早剥其发病机制主要是胎盘附着部位的底蜕膜螺旋小动脉发生痉挛,急性动脉硬化,引起远端毛细血管缺血、坏死、破裂而出血,形成血肿,逐渐扩大,使胎盘与子宫壁剥离而导致胎盘早期剥离,形成血肿,导致胎盘与子宫壁剥离。因此对重度子痫前期患者未临产出现腹痛及阴道流血一定要警惕胎盘早剥的可能。目前胎盘早剥尚无快速特异的实验室诊断标准,B 超是诊断胎盘早剥最重要的辅助检查手段,对临床症状不典型者特别是后壁胎盘早剥者一定要重视患者的主诉,严密观察胎心及腹部体征,阴道流血情况及时 B 超、胎监、血红蛋白、血小板及凝血功能的动态监测,明确诊断及早终止妊娠,减少母婴损伤。本文通过对胎盘早剥孕妇血液中胎盘生长因子(PLGF)、不对称二甲基精氨酸(ADMA)、一氧化氮(NO)、肌酐(Cr)、凝血因子、血小板参数的变化的回顾性分析,旨在为早期判断胎盘早剥提供依据,报道如下。
1 资料与方法
1.1 一般资料 选择2018年5月至2021年5月在我院住院的胎盘早剥[3]孕妇78例为观察组,以及同期住院的正常孕妇78例(正常孕妇组)、妊高症[4]孕妇78例(妊娠期高血压孕妇组)作为对照组。观察组胎盘早剥孕妇78例,年龄19~43 岁,平均年龄(27.4±2.8)岁;孕龄27~35周,平均(28.9±1.4)周;胎盘Ⅰ度早剥56例,胎盘Ⅱ度早剥者14例,胎盘Ⅲ度早剥8例;初产妇62例,经产妇16例。正常孕妇组正常孕妇78例,年龄 18~44 岁,平均年龄(26.7±2.4)岁;初产妇60例,经产妇18例。妊娠期高血压孕妇组妊高症孕妇,年龄 17~43 岁,平均年龄(27.1±2.7)岁;其中经确诊妊娠期高血压者5例,子痫前期61例,妊娠合并高血压者8例,慢性高血压并发子痫前期4例。本次研究已通过我院医学伦理会批准,并取得所有孕妇以及其家属的同意。所有孕妇均未合并其他心、脑、肺等慢性疾病、神经精神疾病等。3组孕妇的一般资料具有均衡性。
1.2 方法 对3组孕妇血液中凝血因子、血小板参数进行检测,记录凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、血纤维蛋白原(FIB)、血二聚体-D(D-D)、血小板计数(PLT)、血小板体积分布宽度(PDW)、平均血小板体积(MPV),并进行对比分析。胎盘早剥孕妇、妊高症孕妇以及正常孕妇各78例抽静脉血2 ml,经离心机分离血浆(3 000 r/min,10 min)后,应用希森美康全自动血凝分析仪(型号CS5100)进行PT、APTT、D-D、TT、FIB检测。采用迈瑞全自动血细胞分析仪(型号BC-6800plus)进行PDW、MPV、PLT测定。应用全自动雅培(型号160001)进行NO、Cr、BUN、UA测定。应用干式荧光免疫分析仪进行PLGF、ADMA、游离雌三醇(uE3)测定。
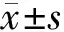
2 结果
2.1 3组孕妇凝血功能比较 3组孕妇PT、APTT、FIB、D-D差异有统计学意义(P<0.05)。其中,PT、APTT妊娠期高血压孕妇组最短、观察组最长(P<0.05);D-D中妊娠期高血压孕妇组最高,正常孕妇组最低(P<0.05);FIB水平中妊娠期高血压孕妇组最高,胎盘早剥孕妇组最低(P<0.05)。3组孕妇TT差异无统计学意义(P>0.05)。见表1。

表1 3组孕妇凝血功能比较
2.2 3组孕妇血小板计数及形态学比较 3组孕妇PLT、PDW、MPV间差异有统计学意义(P<0.05)。其中,PDW、MPV妊娠期高血压孕妇组最高,正常孕妇组最低(P<0.05);PLT水平妊娠期高血压孕妇最低,正常孕妇组最高(P<0.05)。见表2。

表2 3组孕妇血小板计数及形态学比较
2.3 3组孕妇肌酐(Cr)、尿素氮(BUN)、尿酸(UA)比较 3组孕妇BUN、Cr间差异有统计学意义(P<0.05)。BUN、Cr胎盘早剥孕妇组最高,正常孕妇组最低(P<0.05)。见表3。

表3 3组孕妇尿素氮、肌酐、尿酸比较
2.4 3组孕妇PLGF、ADMA、uE3、NO比较 3组孕妇ADMA、uE3、NO差异有统计学意义(P<0.05)。其中,ADMA、uE3、NO胎盘早剥孕妇组最高,正常孕妇组最低(P<0.05)。见表4。

表4 3组孕妇血浆内NO、血清ADMA、胎盘生长因子PLGF和uE3水平比较
3 讨论
胎盘早剥的病因尚未完全阐明,过去通常认为与血管病变,机械性因素,子宫静脉压突然升高等因素有关,现认为妊娠期高血压疾病,尤其重度子痫前期与胎盘早剥有密切关系,重度子痫前期患者中胎盘早剥的发生率是正常妊娠胎盘早剥发生率的 3 倍。
胎盘早剥危及母婴生命,是妊娠晚期出血的重要原因之一。有多种原因可导致胎盘早剥:当孕妇合并慢性肾脏病、慢性高血压、妊娠期高血压疾病,尤其是全身血管疾病时,底蜕膜螺旋小动脉就会产生痉挛,继而硬化,引起远端毛细血管供给组织缺血、坏死,以致破裂出血,当血液流至底蜕膜层形成血肿,导致胎盘从子宫壁剥离[5-7]。或由其他因素,如脐带过短或绕颈、上一胎儿娩出过快使宫内压力急剧下降等原因结局[8,9]。当胎盘剥离时,胎盘与子宫壁之间存在凝血块,同时因胎盘不能立即娩出,孕妇机体内源性、外源性凝血系统被激活,随着大量凝血因子、纤维蛋白原消耗量增加,很快发展成为 DIC[10,11]。另外,早剥的蜕膜以及胎盘绒毛逐步放出大量的凝血活酶因子,而凝血活酶因子进入母体循环系统后,导致凝血系统被激活,出现凝血功能的亢进,导致DIC风险增加[12-14]。据报道,DIC几乎与胎盘早剥同时发生[15,16]。故及早了解胎盘早剥孕妇血液中凝血因子的变化至关重要。
胎盘早剥常表现为突发阴道出血、轻度到中度腹痛和/或背痛,是产妇和围产儿发生并发症及死亡的重要原因,所以及早发现胎盘早剥并预测产后结局对提升围产期安全具有重要意义。本研究发现发生胎盘早剥的孕妇在妊娠过程中凝血功能的变化特征与正常妊娠过程不同,特别是FIB在发生胎盘早剥孕妇的妊娠中晚期会表现下降趋势。
发生胎盘早剥的孕妇PT、APTT和TT水平从孕晚期开始比正常妊娠延长,FIB在妊娠中期后没有表现持续升高的趋势,且在临产时低于正常妊娠组,提示在胎盘早剥发生过程中有凝血因子的过度激活[17-19]。文献报道,在胎盘早剥发生过程中,凝血酶一方面可因蜕膜出血导致蜕膜细胞释放组织因子,从而生成凝血酶;另一方面,蜕膜缺氧诱导血管内皮生长因子形成,诱导组织因子的异常表达,而激活凝血酶。
本研究通过胎盘早剥以及妊娠高血压孕妇、正常孕妇之间凝血因子、血小板、胎盘生长因子、不对称二甲基精氨酸、游离雌三醇、一氧化氮、肌酐、尿素氮、尿酸参数之间的差异发现,PT、APTT妊娠期高血压孕妇组最短、胎盘早剥孕妇组最长(P<0.05);D-D中妊娠期高血压孕妇组最高,正常孕妇组最低(P<0.05);FIB水平中妊娠期高血压孕妇组最高,胎盘早剥孕妇组最低(P<0.05)。PDW、MPV妊娠期高血压孕妇组最高,正常孕妇组最低(P<0.05);PLT水平妊娠期高血压孕妇最低,正常孕妇组最高(P<0.05);ADMA、uE3、NO、Cr、BUN,胎盘早剥孕妇组最高,正常孕妇组最低(P<0.05);3组孕妇TT、PLGF、UA水平差异无统计学意义(P>0.05)。提示胎盘早剥、妊娠高血压均可影响凝血指标,血小板参数及胎盘生长因子、ADMA、uE3、NO、Cr、BUN、UA等,妊娠晚期严密监测这些指标可以及早发现异常情况,对于早期判断及预防不良后果有重要意义[20-22]。

