miR-452-5p调控YTHDF2肝细胞癌细胞凋亡和铁死亡的机制研究
王雪梅
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型(>85%),其病死率位居世界第二,近几年肝细胞癌的新发病例数和死亡数逐年增长,尤其在中国[1]。对于肝细胞癌早期的患者进行肝脏切除、肝移植或局部消融有助于患者的预后,而晚期或肝硬化患者的预后很差[2]。微小RNA(miRNA)是一种短链非编码的内源保守的18~22个核苷酸之间的RNA片段,通过调控靶基因的转录、翻译而抑制蛋白的表达,以此参与人类几乎所有疾病的发展[3]。miR-452-5p为众多新发现的miRNA之一[4]。m6A作为真核细胞mRNA上最常见的内部修饰之一,对基因的表达十分重要[5]。YTH结构域家族2(YTH domain family ,member 2,YTHDF2)是最有效的m6A结合蛋白,可通过结合含有m6A的结合位点的基因以削弱其稳定性[6]。最新报道显示,YTHDF2能够降解肿瘤启动子并抑制癌基因的mRNA表达[7]。铁死亡是近年提出的一种调节性细胞死亡方式,主要依赖于细胞内铁和脂质活性氧(reactive oxygen species,ROS)积累所引起的细胞死亡[8]。本研究旨在探索miR-452-5p、YTHDF2调节肝细胞癌细胞凋亡、铁死亡的作用机制。
1 材料与方法
1.1 材料 L02、SMMC-7721、HepG2、Huh7、Hep3B细胞购自美国菌种保藏中心;活性氧检测试剂盒(DCFH-DA荧光探针法)购自北京百奥莱博公司;细胞计数试剂盒(cell counting Kit,CCK8)购自日本同仁;实时荧光定量聚合酶链式反应(real time fluorescence quantitative polymerase chain reaction,RT-qPCR)试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)细胞凋亡检测试剂盒购自上海碧云天;细胞免疫荧光法检测细胞中ROS含量;双荧光素酶报告基因检测试剂盒购自美国Promega;所有miR-con、miR-452-5p mimics、anti-miR-con、anti-miR-452-5p及引物的设计合成均委托上海吉玛公司完成。
1.2 方法
1.2.1 细胞培养:L02、SMMC-7721、HepG2、Huh7、Hep3B细胞使用含有10%胎牛血清的DMEM培养液在37℃恒温细胞培养箱中培养。培养箱中含有5%CO2、95%O2的饱和湿度气体环境中。每2 天更换1次培养液。
1.2.2 细胞转染与分组:将正常培养至对数生长的细胞设为L02组、SMMC-7721组、HepG2组、Huh7组、Hep3B组。将不做任何处理的HepG2细胞设为NC组;使用脂质体LipofectamineTM3000将anti-miR-con组(转染anti-miR-con)、anti-miR-452-5p组(转染anti-miR-452-5p)、pcDNA组(转染pcDNA)、pcDNA-YTHDF2组(转染pcDNA-YTHDF2)、anti-miR-452-5p+si-con组(共转染anti-miR-452-5p 和si-con)、anti-miR-452-5p+si-YTHDF2组(共转染anti-miR-452-5p 和si-YTHDF2)转染HepG2细胞12 h,继续培养48 h,RT-qPCR或WB实验检测转染是否成功。确认成功后用于后续研究,否则继续更换转染条件至成功。
1.2.3 RT-qPCR实验:收集需要检测的细胞,Trizol液提取总RNA,反转录试剂盒将其合成cDNA,-20℃保存,作为模板备用。用RT-qPCR试剂盒检测模板中miR-452-5p、YTHDF2的表达。以U6、GAPDH为内参,2-△△Ct法计算miR-452-5p、YTHDF2的表达水平。扩增程序设置为:94℃,2 min;94℃,30 s;59℃,30 s;72℃,40 s,进行45个循环,72℃,保存5 min。引物信息:miR-452-5p,上游引物5’-AAGAGGGCATGGAAACACTG-3’,下游引物5’-ACTCACCCCATTCTTCAAGG-3’;YTHDF2,上游引物 5’-GCTTGCCTGCTACATAGTGAGA-3’,下游引物5’-AACTGAACTGCTTAACCTTCTGG-3’。U6、GAPDH所用为通用引物。
1.2.4 ROS含量检测:收集细胞,PBS充分洗涤。按照活性氧检测试剂盒(DCFH-DA荧光探针法)的说明书要求逐步操作,加入DCFH-DA,避光孵育30 min,用酶标仪在480 nm激发波长/530 nm发射波长处检测荧光强度,荧光显微镜下拍照细胞的荧光图。
1.2.5 WB实验:细胞中加入足够量的RIPA裂解液冰上裂解30 min,提取总蛋白。然后对蛋白定量、变性,SDS-PAGE蛋白电泳。用转膜仪将蛋白转移到NC膜,再用含2.5%脱脂奶粉的封闭液对膜37℃封闭处理2 h。将膜浸泡再稀释过的一抗稀释液中,4℃孵育过夜,充分洗膜。再浸泡在稀释的二抗溶液中37℃孵育2 h,充分洗膜。最后,用ECL发光液显影曝光。
1.2.6 CCK8实验:收集待检细胞,用培养液调至5×104个/ml,取200 μl置于96孔板,再加入10 μl的CCK8反应液,避光孵育20 min。在490 nm波长下检测细胞的吸光度。细胞活性(%)=OD490实验组/OD490对照组×100。
1.2.7 Annexin V-FITC/PI凋亡检测实验:收集待检测的细胞,充分洗涤5次,再用500 μl结合缓冲液悬浮细胞。依次加入5 μl Annexin V/FITC和5 μl PI避光反应10 min,上流式细胞仪分析细胞的凋亡。总凋亡率(%)= 早期凋亡率+晚期凋亡率。
1.2.8 双荧光素酶报告基因检测实验:生物信息学靶点预测网站Starbase(https://starbase.sysu)预测miR-452-5p的靶位点,发现YTHDF2的3’UTR与miR-452-5p存在连续的结合位点。化学合成YTHDF2-WT(含YTHDF2 3’UTR)和YTHDF2-MUT(不含YTHDF2 3’UTR),并将其插入荧光载体,构建荧光报告基因载体。YTHDF2-WT和YTHDF2-MUT报告载体分别与miR-con、miR-452-5p、anti-miR-con、anti-miR-452-5p共转染基因检测试剂盒检测细胞的荧光活性。
2 结果
2.1 肝细胞癌细胞中miR-452-5p和YTHDF2的表达 与L02组比较,SMMC-7721、HepG2、Huh7、Hep3B组miR-452-5p表达升高(P<0.05),YTHDF2 mRNA和蛋白表达降低(P<0.05)。见图1,表1。

图1 YTHDF2蛋白电泳图
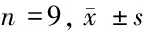
表1 miR-452-5p和YTHDF2在L02、SMMC-7721、HepG2、Huh7和Hep3B细胞中的表达
2.2 抑制miR-452-5p调节HepG2细胞增殖 与anti-miR-con组比较,anti-miR-452-5p组HepG2细胞miR-452-5p表达和细胞活性均显著降低(P<0.05)。见表2。
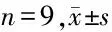
表2 抑制miR-452-5p的HepG2细胞增殖
2.3 抑制miR-452-5p对HepG2细胞的凋亡、铁死亡的调控 与anti-miR-con组比较,anti-miR-452-5p组HepG2细胞凋亡率、ROS含量、SLC7A11、GPX4和FTH1的蛋白表达均显著升高(P<0.05)。见图2,表3。

图2 抑制miR-452-5p的HepG2细胞的凋亡、铁死亡相关蛋白的表达;A HepG2细胞ROS含量;B HepG2细胞凋亡图;C HepG2细胞SLC7A11、GPX4和FTH1蛋白表达
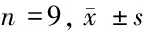
表3 抑制miR-452-5p诱导HepG2细胞凋亡、铁死亡
2.4 miR-452-5p靶向调控YTHDF2的表达 miR-452-5p组YTHDF2-WT细胞的荧光活性显著低于miR-con组;与miR-con组相比,miR-452-5p组YTHDF2蛋白表达显著降低,与anti-miR-con组相比,anti-miR-452-5p组YTHDF2蛋白表达显著升高(P<0.05)。见图3,表4。

图3 miR-452-5p靶向调控YTHDF2;A miR-452-5p与YTHDF2的靶向序列;B HepG2细胞中YTHDF2蛋白表达
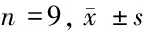
表4 双荧光素酶报告实验结果及miR-452-5p调控YTHDF2的表达
2.5 过表达YTHDF2调控HepG2细胞凋亡、铁死亡 与pcDNA组比较,pcDNA-YTHDF2组HepG2细胞中YTHDF2蛋白表达显著升高,细胞凋亡率显著升高,ROS含量、SLC7A11、GPX4和FTH1的蛋白表达均显著升高(P<0.05)。见图4,表5。

图4 过表达YTHDF2对HepG2细胞凋亡、铁死亡的影响;A HepG2细胞ROS的含量;B HepG2细胞的凋亡图;C HepG2细胞中YTHDF2、SLC7A11、GPX4和FTH1的蛋白表达
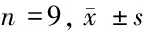
表5 过表达YTHDF2抑制HepG2细胞凋亡、铁死亡
2.6 敲减YTHDF2部分逆转anti-miR-452-5p对HepG2细胞凋亡、铁死亡的作用 与anti-miR-452-5p+si-con组比较,anti-miR-452-5p+si-YTHDF2组HepG2细胞YTHDF2蛋白表达显著降低,细胞凋亡率降低,ROS含量、SLC7A11、GPX4和FTH1的蛋白表达均显著降低(P<0.05)。见表6,图5。
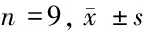
表6 敲减YTHDF2的anti-miR-452-5p处理HepG2细胞凋亡、铁死亡情况

图5 敲减YTHDF2对anti-miR-452-5p调控HepG2细胞凋亡、铁死亡的影响;A ROS含量的荧光图;B HepG2细胞凋亡图;C HepG2细胞YTHDF2、SLC7A11、GPX4和FTH1的蛋白表达
3 讨论
miR-452-3p/5p参与人类多种癌症的进展,如胃癌、结肠癌、前列腺癌、乳腺癌、宫颈癌、肝癌等[9,10]。虽有大量证据显示miRNA参与癌症的恶化进程的调控,但是其调控的机制十分复杂,至今仍在探索之中。Tang等[4]报道,miR-452-3p在肝癌样本中的表达异常升高,并且过度表达miR-452-3p促进癌细胞的增殖、迁移,抑制凋亡,这与miR-452-3p直接靶向抑制CPEB3/EGFR信号通路的活性存在联系。Yang等[11]在肝癌的研究中报道,circ-ABCB10在体内和体外均抑制肝癌的恶性进展,其机制与抑制miR-340-5p/miR-452-5p-NRP1/ABL2信号通路的活性相关,为肝癌的靶向治疗提供新靶点。Zheng等[12]最新研究报道,miR-452-5p在肝癌中的表达显著升高,并作为癌基因参与肝癌细胞的增殖、迁移和侵袭,其机制为靶向COLEC10。这些研究说明miR-452-5p参与肝癌的恶化过程且作用机制多种多样,但是其是否与肝癌细胞的铁死亡存在联系尚未可知。本研究检测了正常肝细胞和肝细胞癌细胞中miR-452-5p的表达,结果与前人的研究结果相一致,即miR-452-5p在肝细胞癌细胞中高表达。抑制miR-452-5p抑制肝细胞癌细胞增殖,促进凋亡和铁死亡以及铁死亡相关基因ROS、SLC7A11、GPX4和FTH1的表达,这与前人关于miR-452-5p的研究结果[11,12]相吻合。进一步研究通过双荧光素酶报告基因检测实验验证了miR-452-5p靶向YTHDF2,也许YTHDF2可能与miR-452-5p调控肝细胞癌细胞凋亡和铁死亡存在联系。
m6A作为真核生物中最普遍的mRNA修饰之一,其在许多生物学过程中发挥作用,如mRNA稳定性、蛋白质翻译、病毒感染和胚胎发育[13,14]。YTHDF2(YTH结构域家族成员2)是功能性m6A结合蛋白的明星基因,其主要调节mRNA的稳定性。YTDF2通过其C-末端YTH(YT521 B同源)结构域识别并结合mRNA 3’UTR位点,加速靶基因的降解[15]。据报道,YTHDF2在胰腺癌细胞中具有促进增殖和抑制迁移和侵入的双重作用[16]。Hou等[17]发现,YTHDF2在肝癌组织中的表达显著降低,这是由缺氧诱导因子-2α(HIF-2α)介导的,HIF-2α抑制剂或过表达YTHDF2可恢复YTHDF2的表达并抑制肝癌细胞的增殖和裸鼠体内肿瘤的生长,其机制与YTHDF2直接结合EGFR的 3’-UTR有关。但Shao等[18]报道,YTHDF2在肝细胞癌中高表达,与患者的不良预后、癌细胞浸润紧密相关。本研究发现,YTHDF2在肝癌细胞中的表达显著降低,与Hou等[17]的研究结果相一致,与Shao等[18]的研究结果相悖。过表达YTHDF2明显促进HepG2细胞凋亡、铁死亡,并且敲减YTHDF2还可部分逆转抑制miR-452-5p对HepG2细胞凋亡、铁死亡的促进作用。
综上所述,抑制miR-452-5p促进肝细胞癌细胞凋亡、铁死亡,产生这种作用的机制与直接靶向YTHDF2有关,为肝细胞癌的精准治疗提供新靶点。

