氯胺酮对脑胶质瘤大鼠细胞增殖和凋亡的影响机制
何元 王培 王君 段晓飞 张铁峰
脑胶质瘤具有治愈率低,发病率高的特点,其具有生长速度快,向周围组织浸润性生长的病理特点,手术后无法彻底根除肿瘤,仍有很大可能性复发,采用安全有效且不易复发的方式治疗胶质瘤极为重要[1,2]。氯胺酮作为苯环己哌啶的衍生物,是一种非竞争性的N-甲基-D-天门冬氨酸(NMDA)受体的拮抗剂,在周围神经组织中使用氯胺酮可提高麻醉效果,但是机体也可能因此出现幻觉[3]。近年也有研究表示,氯胺酮能有效抑制癌细胞的增殖,并且提升癌细胞化疗敏感性[4]。该药物也能诱导肝癌细胞、神经细胞、内皮细胞等凋亡。因此,本文分析脑胶质瘤使用氯胺酮是否对大鼠细胞增殖、凋亡的产生影响。
1 材料与方法
1.1 实验动物 选取雄性SD大鼠49只,体重(200±20)g,3~4个月龄,动物实验许可证号:SCXK(鲁)2012-0002,质量合格证号:0015264。购自鲁南制药集团股份有限公司。在标准环境下饲养大鼠1周,进行自由进水,饮食。7 d后开始实验,本试验严格按照动物实验的道德伦理要求进行,我院伦理委员会同意、审批。
1.2 主要试剂 RPMI 1640培养液(上海艾研生物科技有限公司)、CCK8溶液(研载生物科技(上海)有限公司)、BindingBuffer200(上海经科化学科技有限公司)、DMEM培养液(上海研生实业有限公司)。
1.3 方法
1.3.1 细胞培养:取指数生长期细胞,消化、分散均匀,浓度为1×1011/L,C6细胞使用RPMI 1640培养液(含10%胎牛血清)于7℃、5%的CO2培养箱中常规培养。胰蛋白酶消化5 min后,弃去消化液。用PBS液冲洗3次形成细胞悬液,调整细胞浓度为1×10/L的悬液用于接种,以培养大鼠C6脑胶质瘤细胞。
1.3.2 分组及建模:将49只进行建模,大鼠尾静脉注射1%戊巴比妥钠,将大鼠头顶部毛发去除,横向切开头皮,露出前囱颅骨,前囱颅骨前1 mm,矢状缝旁3 mm处钻骨孔,抽取10 μl C6瘤株,经骨孔进针6 mm,后退1 mm,注射完毕后退针前留针5 min,骨孔使用骨蜡封闭,缝合切口。建模过程中意外死亡10只,最后建模成功39只。将这39只大鼠随机分为对照组、低剂量组、高剂量组,每组13只。
1.3.3 用药方法:将建模成功的对照组、低剂量组、高剂量组,低剂量组大鼠腹腔注射浓度为5 mmol/L氯胺酮溶液进行处理,高剂量大鼠腹腔注射浓度为10 mmol/L氯胺酮溶液进行处理,对照组注射10 mmol/L的0.9%氯化纳溶液。
1.3.4 样本采集:用药1周后以大量的戊巴比妥钠处死大鼠,处死后取脑组织,全脑置于10%甲醛中放置1周,沿进针点作冠状切口,取肿瘤组织。
1.3.5 病理学观察:取胶质瘤组织,石蜡切片、染色,比较每组大鼠脑胶质瘤组织病理学变化并做好记录。
1.3.6 检测方法:①酶标仪检测细胞增殖:分别取4组肿瘤细胞,用细胞培养液悬浮后接种于细胞培养板中,密度为4×105/L,细胞培养板为96孔,在每个复孔中加入100 μl细胞悬液,分别设置5个复孔,置于5%CO2培养箱中,分别于培养24、48及72 h后,加入10 μl的CCK8溶液,在培养箱中孵育4 h后,450 nm波长处测定吸光度值。实验3次,取平均值。②流式细胞仪检测细胞凋亡:分别取4组肿瘤细胞,接种于细胞培养板中,密度为1×106/L,细胞培养板为96孔,取3 ml细胞悬液置于离心管中,4℃环境下1 000 r/min离心5 min,将上清液去除,经过洗涤2次,加入BindingBuffer 200 μl摇匀,37℃室内放置20 min,检测细胞凋亡率。实验3次,取平均值。③细胞迁移检测:分别取4组肿瘤细胞密度调整为 105/ml,加入500 μl培养基,其上层加入100 μl细胞悬液,培养2 d后,去除培养基,上层加入细胞样本,下层加入DMEM培养基,设置3个复孔,37℃环境的培养箱中培养2 d,进行HE染色,随机挑选5个视野,200倍下拍照计数。实验3次,取平均值。
1.3.7 JAK2/STAT3信号通路蛋白表达量检测:取适量裂解液裂解大约30 min,之后将细胞收集,在4℃环境下1 500 r/min离心20 min后,取上清。试剂盒采用BCA试剂盒,测定蛋白浓度。将蛋白样品与上样缓冲液融合,采用电泳分离。取出PVDF膜,用50 g/L脱脂奶封闭,添加一抗后4℃环境下过夜培养,TBST清洗后添加二抗,37℃培养2 h,TBST洗膜,采用ECL试剂盒,内参为GADPH。重复3次实验,取平均值。

2 结果
2.1 病理组织学观察 对照组大鼠脑胶质瘤组织出现椭圆形,比正常周围组织颜色深,边界部分较清晰,向周围脑组织浸润性生长。低剂量组大鼠脑胶质瘤组织瘤体较大,切面可见出血和坏死。HE染色发现细胞排列密集,且异型性明显,呈浸润性生长,高剂量组大鼠脑胶质瘤组织细胞核分裂易见,肿瘤中心可见细胞坏死及细胞出血。正常组织与肿瘤之间可见肿瘤细胞呈浸润性,出现明显的分界线。见图1。

对照组 低剂量组 高剂量组
2.2 细胞增殖活性比较 与对照组比较,12 h、24 h后,其他2组细胞增殖活性较低,差异有统计学意义(P<0.05);高剂量组细胞增殖活性低于低剂量组,差异有统计学意义(P<0.05)。见表1。
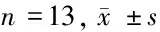
表1 细胞增殖活性比较
2.3 细胞凋亡指数比较 与对照组比较,12 h、24 h后,低剂量组、高剂量组细胞凋亡指数升高,差异有统计学意义(P<0.05);与低剂量组比较,高剂量组细胞凋亡指数升高,差异有统计学意义(P<0.05)。见表2。
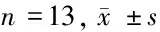
表2 细胞凋亡指数比较
2.4 细胞迁移指数比较 与对照组比较,12 h、24 h后,其他2组细胞迁移指数较低,差异有统计学意义(P<0.05);高剂量组细胞迁移指数低于低剂量组,差异有统计学意义(P<0.05)。见表3。
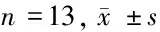
表3 细胞迁移指数比较
2.5 肿瘤组织JAK2/STAT3信号通路蛋白表达量比较 与对照组比较,低剂量组、高剂量组JAK2、p-STAT3、STAT3含量降低,差异有统计学意义(P<0.05);与低剂量组比较,高剂量组JAK2、p-STAT3、STAT3含量降低,差异有统计学意义(P<0.05)。见图2,表4。

图2 肿瘤组织JAK2/STAT3信号通路蛋白表达量比较
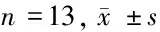
表4 肿瘤组织JAK2/STAT3信号通路蛋白表达量比较
3 讨论
脑胶质瘤多为恶性肿瘤,具有高发病、低治愈、易复发、高死亡率等特点,占在原发性脑肿瘤的一半以上,患者生存时间大多仅为13个月左右[5,6]。临床治疗上,常以手术辅以放射化疗。但放射治疗只能杀灭部分敏感细胞,而胶质瘤细胞中含有大量对放射治疗不敏感的细胞,所以残留的细胞复发的可能性巨大,不能根治。并且,血脑屏障会阻碍药物进入颅脑内,导致进入脑内药物浓度太低,使治疗效果受到限制,患者同时接受化疗药物和放射治疗还可能会损伤机体的免疫系统,导致的免疫功能下降[7,8]。
氯胺酮是一种短效麻醉药物,可缓解各类疼痛,如果长期应用会出现巨大的不良反应。研究发现氯胺酮具有阻断兴奋性氨基酸递质发挥的作用,并且还参与机体的抗氧化反应[9,10]。另有数据显示,氯胺酮还能干扰NMDA受体,导致机体神经功能出现障碍,并且NMDA受体被阻滞后,可能会导致细胞凋亡[11,12]。本研究结果发现,在细胞处理后的12 h与24 h,使用高剂量氯胺酮的大鼠肿瘤细胞增殖活性,迁移指数都明显降低,凋亡指数明显升高,氯胺酮能有效抑制细胞增殖,促进细胞凋亡。
细胞的主动死亡过程被称作为细胞凋亡,而导致细胞死亡的形式有很多种,其中caspase介导的细胞凋亡,主要是细胞通过死亡受体途径、线粒体途径、内质网途径激活caspase-3,最终导致细胞凋亡[13,14]。Bcl-2家族凋亡调控蛋白,参与细胞程序性坏死进程,是线粒体凋亡途径的主要调控者,具有控制线粒体内外膜的通透性的作用[15]。Bcl-2家族包括了促凋亡蛋白、抗凋亡蛋白及Bim、Bid等蛋白[16]。
STAT3信号转导与转录激活的主要途径为JAK2/STAT3信号通路。以往研究发现,多种恶性肿瘤中JAK、STAT都有异常表达,特别是STAT3激活后,可能是因为STAT3通过下调抗凋亡蛋白Bcl-2、Bax,从而导致细胞凋亡,使恶性肿瘤发生,因此,抑制JAK2/STAT3,有可能会使肿瘤细胞生长减慢[17,18]。Bcl-2/Bax比值是影响细胞凋亡的主要因素,当比值降低,细胞则会凋亡,而Bcl-2属于抗凋亡蛋白,Bax属于促凋亡蛋白[19,20]。Caspase3是caspase家族的代表,也是细胞凋亡的执行者。数据显示,Caspase3能与Bcl-2共同促进细胞凋亡[21]。本文研究结果显示,氯胺酮可降低JAK2/STAT3蛋白表达,从而抑制细胞增殖,促进肿瘤细胞凋亡。但目前并未准确分析其中的机制,因此还需进一步的研究,以明确其作用,为此病提供更好的诊疗价值。
综上所述,高剂量的氯胺酮可明显抑制脑胶质瘤细胞的细胞增殖及促进其细胞凋亡,可能作用于JAK2/STAT3信号通路。因此氯胺酮可能成为未来治疗脑胶质瘤的一个新的有潜力的药物,为治疗脑胶质瘤带来新思路。

