云南省荞麦茎枯病病原鉴定及其生物学特性研究
卢文洁,尹桂芳,王艳青,孙道旺,隆文杰,李程鹏,陈 佳,王莉花
(云南省农业科学院生物技术与种质资源研究所/农业农村部西南作物基因资源与种质创制重点实验室/云南省农业生物技术重点实验室,昆明 650205)
【研究意义】荞麦属蓼科(Polygonaceae)荞麦属(Fagopyrum)一年生或多年生双子叶植物。荞麦具有耐寒和耐贫瘠的优良特性,在云南的高寒、冷凉地区广泛种植。荞麦含丰富的氨基酸、蛋白质、膳食纤维等营养物质[1],尤其富含具有多种功效的生物黄酮类物质[2]。黄酮类活性物质不仅对葡萄糖苷酶、淀粉酶等多种酶的活性有抑制作用[3-6],并具有降血压、降糖、降脂、降胆固醇、抗氧化、抗癌、抗肿瘤、清除自由基、抑菌消炎等功效[7-10]。荞麦是一种药用和食用的同源作物,主要用于生产加工营养食品和功能食品,并且越来越受到人们的认可和青睐。【前人研究进展】国内研究报道的荞麦病害主要有草茎点霉(Phomaherbarum)引起的轮纹病[11],蓼白粉菌(Erysiphepolygoni)引起的白粉病[12],链格孢(Alternariaalternata)引起的叶枯病[13],异形柱隔孢(Ramulariaanomala)引起的白霉病[14],稻黑孢菌(Nigrosporaoryzae)引起的褐斑病[15]以及南方根结线虫(Meloidogyneincognita)、爪哇根结线虫(M.javanica)和花生根结线虫(M.arenaria)引起的根结线虫病[16]。国外研究报道的荞麦病害主要有菌核菌(Sclerotiniasclerotiorum)引起的根冠腐烂病[17],霜霉菌(Peronospora)引起的霜霉病[18],菌核菌(Sclerotinia)引起的幼苗根腐病[19],立枯丝核菌(Rhizoctoniasolani)引起的茎溃疡病[20]等。研究者对危害荞麦的链格孢[13]、异形柱隔孢[14]、稻黑孢菌[15]、草茎点霉[21]等病原菌的生物学特性进行了系统研究, 阐明了病原菌在不同培养基、pH、碳源、氮源、光照等培养条件下的生长特性,为有效防控病害提供了重要的理论依据。【本研究切入点】近年来,云南省农业科学院生物所荞麦课题组调查发现,在云南省澄江县荞麦种植基地发生了荞麦茎枯病。该病害为荞麦生产上危害最为严重的病害之一,随着澄江地区荞麦种植面积的不断扩大,该病害发生危害逐年加重。据调查发现,该病害一般在6月中下旬开始发病,发病较为轻微,在7—8月雨水多时发病加重,植株发病率可高达20%左右。荞麦植株一旦感染该病害,茎秆易折断倒伏,给荞麦生产造成了严重损失。【拟解决的关键问题】为明确荞麦茎枯病的病原种类,本研究开展了病原菌的分离和纯化、形态学观察、致病性测定和分子生物学分析,并测定病原菌的生物学特性,为荞麦茎枯病的综合防控技术研究提供一定的理论依据。
1 材料与方法
1.1 病原菌的分离与纯化
课题组于云南省澄江县荞麦种植基地调查并记录病害的发病部位、症状特征,采集荞麦茎枯病样品,并对样品进行分离培养。取荞麦茎秆发病部位,经消毒处理后置于PDA培养基平板上,于28 ℃恒温培养,纯化菌株后于4 ℃贮存备用。
1.2 致病性测定
按照柯赫氏法则对分离菌株进行致病性测定。将分离菌株在PDA 培养基上28 ℃恒温培养5 d,取培养的菌丝对健康荞麦植株茎部进行活体接种,以接种PDA琼脂块作为对照。接种48 h后取掉接种的菌丝饼和对照处理的PDA琼脂块,每天观察接种部位的发病情况。
1.3 孢子的形态观察
用PDA培养基活化培养菌株M38,28 ℃恒温条件下培养,每天观察菌落的形态特征;取少许菌丝制片,在显微镜下观察病原菌的分生孢子、厚垣孢子、产孢细胞的形态特征。
1.4 rDNA-ITS序列分析
于28 ℃恒温条件下,用PDA培养基活化培养菌株M38,刮取菌丝,用植物真菌DNA试剂盒提取菌株M38菌丝基因组DNA。PCR扩增采用真菌引物对ITS1/ITS4,引物合成由生工生物工程(上海)股份有限公司完成。PCR反应体系和PCR反应程序参照卢文洁等[13]的研究方法。利用回收试剂盒回收纯化菌株DNA片段,经华大基因生物公司测序,在NCBI 上进行DNA序列BLAST 同源性比对,DNA序列分析采用软件MEGA 6.0,构建菌株M38的系统发育树。
1.5 菌株M38生物学特性的测定
1.5.1 培养基对菌株M38生长的影响 取菌丝饼(直径6 mm),分别移植于PSA(马铃薯蔗糖琼脂)培养基、PDA(马铃薯葡萄糖琼脂)培养基、OMA(燕麦片琼脂)培养基、Czapek(查彼)培养基、CMA(玉米粉琼脂)培养基、CA(胡萝卜)培养基、SDA(沙氏葡萄糖琼脂)培养基的平板中央,对照为WA(水琼脂)培养基。每个处理重复5 次,28 ℃恒温培养5 d,测量菌落直径大小采用十字交叉法。菌丝饼的大小、不同处理的重复次数、培养温度(除不同温度处理)、培养天数及测量菌落直径的方法下同。
1.5.2 温度对菌株M38生长的影响 将菌丝饼放于PDA培养基的平板中央,分别在5、10、15、20、25、28、30、35 ℃共8个处理的不同温度下恒温培养,观察菌落,测量直径。
1.5.3 菌丝致死温度的测定 取菌丝饼于消毒试管中,加入2.5 mL ddH2O,分别在40、45、50、55、60、61、62、63、65 ℃的水浴中恒温处理10 min后取出,待菌丝饼冷却,移至PDA培养基的平板中央,恒温培养,观察不同温度处理的菌丝能否生长。
1.5.4 pH 对菌株M38生长的影响 分别用HCl溶液(1 mol/L)和NaOH 溶液(1 mol/L)将PDA培养基的pH调节为4.0~11.0,共8个处理,取直径大小为6 mm的菌丝饼,置于不同pH的PDA培养基平板中央恒温培养,菌落观察,测量直径。
1.5.5 光照对菌株M38生长的影响 取菌丝饼置于PDA培养基的平板中央,分别在连续黑暗(24 h)、光暗交替(12 h光照/12 h黑暗)、连续光照(24 h) 3种不同光照处理下恒温培养,观察菌落特征,测量菌落直径。
1.5.6 碳源、氮源对菌株M38生长的影响 用葡萄糖、乳糖、可溶性淀粉、木糖、甘露糖、果糖、蔗糖、麦芽糖8种碳源配置浓度为2%的不同碳源培养基;用硝酸钾、氯化铵、苯丙氨酸、硫酸铵、硝酸钠、胱氨酸、尿素、蛋白胨、牛肉浸膏9种氮源配置浓度为0.2%的不同氮源培养基。将菌丝饼放于不同碳源、氮源的培养基,恒温培养,菌落观察,测量直径。
1.6 数据分析
生物学特性的实验数据分析采用软件SPSS 23.0,显著性分析采用新复极差法。
2 结果与分析
2.1 病害症状
荞麦茎枯病主要是由病菌侵染危害植株茎部引起。发病初期,荞麦茎部出现小面积褐色不规则病斑,随着病情发展,病斑沿上、下茎部及侧枝扩展蔓延,受害部位呈深褐色至黑色(图1-A),高温高湿条件下发病严重,病斑快速蔓延扩散,茎秆、叶片萎蔫干枯或腐烂(图1-B),导致荞麦茎秆折断,植株倒伏,给荞麦生产造成严重损失。
2.2 致病性测定
菌株M38接种荞麦茎部5 d后,接种点可见褐色不规则小病斑,接种20 d后,病斑沿向上、下茎部扩展蔓延,病斑呈深褐色或黑色,接种荞麦茎秆的发病症状与荞麦茎枯病的田间症状相似(图2-A),接种PDA琼脂块(CK)的荞麦茎秆无发病症状(图2-B)。接种发病的荞麦茎秆用PDA培养基进行分离培养,获得的菌株与接种菌株M38的孢子形态特征完全一致,由此可见,接种菌株M38为荞麦茎枯病的致病病原菌。

A、B:田间症状A and B: Symptoms of stem blight of buckwheat in the field图1 荞麦茎枯病症状Fig.1 Symptoms of stem blight of buckwheat
2.3 培养性状及形态学特征
用PDA培养基活化培养菌株M38,5 d后菌落直径为85~90 mm。菌落呈圆形,菌丝初期为白色,生长至后期,绒毛状气生菌丝较浓密,菌落正面呈淡黄色(图3-A),背面为黄色(图3-B)。在Bilay培养基上菌丝呈白色,菌落稀薄(图3-C,3-D)。在米饭培养基上菌丝呈米白色,菌落紧贴培养基(图3-E,3-F)。分生孢子产生于细长不分枝的瓶梗,大型分生孢子不弯曲或稍弯曲,镰刀形,中部细胞显著膨大,顶端细胞渐细呈钩状或锥形,基胞有足跟,多为3~5个隔膜,大小为 (17~45.5)μm ×(1.6~5.5)μm(图4-A,4-B,4-C);小型分生孢子极少,单胞,透明,椭圆形或长矩圆形(图 4-C);厚垣孢子呈球形,在菌丝间单生或串生,大小为7~10 μm(图 4-D,4-E,4-F)。产孢细胞单瓶梗,分枝或不分枝(图4-G,4-H,4-I)。根据形态特征初步鉴定菌株M38为镰刀菌属(Fusarium)真菌[22]。

A:接种发病症状;B:对照A: The symptoms after inoculation; B: Control图2 接种M38菌株后荞麦茎枯病的症状Fig.2 Symptoms of stem blight of buckwheat after inoculating strain M38
2.4 荞麦茎枯病菌株M38分子鉴定
应用真菌引物对ITS1/ITS4扩增菌株M38的菌丝基因组DNA,测序获得长度为517 bp的rDNA-ITS序列(登录号:KP205542.1)。将该序列与GenBank上已发表的禾谷镰刀菌(Fusariumgraminearum)、茄镰刀菌(Fusariumsolani)、尖孢镰刀菌(Fusariumoxysporum)、木贼镰刀菌(Fusariumequiseti)等菌株序列进行比对,菌株M38与木贼镰刀菌的2个菌株(MG736112.1和 MG736187.1)序列的同源性均为100%。根据病原菌的形态特征以及rDNA-ITS序列系统发育树分析(图5),鉴定该病原菌为镰刀菌属(Fusarium)木贼镰刀菌(F.equiseti)。

A~B:PDA培养基正、反面菌落形态;C~D:Bilay培养基正、反面菌落形态; E~F:米饭培养基正、反面菌落形态A-B: Colony morphology of the front side on the PDA plate and of the reverse side on the PDA plate; C-D: Colony morphology of the front side on the Bilay plate and of the reverse side on the Bilay plate; E-F: Colony morphology of the front side on the rice plate and of the reverse side on the rice plate图3 荞麦茎枯病病原菌的菌落形态Fig.3 Colony morphology of the pathogen causing stem blight of buckwheat

A~B:大型分生孢子;C:大型分生孢子和小型分生孢子;D~F:厚垣孢子;G~I: 产孢细胞A-B: Macroconidia; C: Macroconidia and Microconidia; D-F: Chlamydospores; G-I: Conidiogenous cells图4 荞麦茎枯病病原菌的孢子形态Fig.4 The spore morphology of the pathogen of buckwheat stem blight
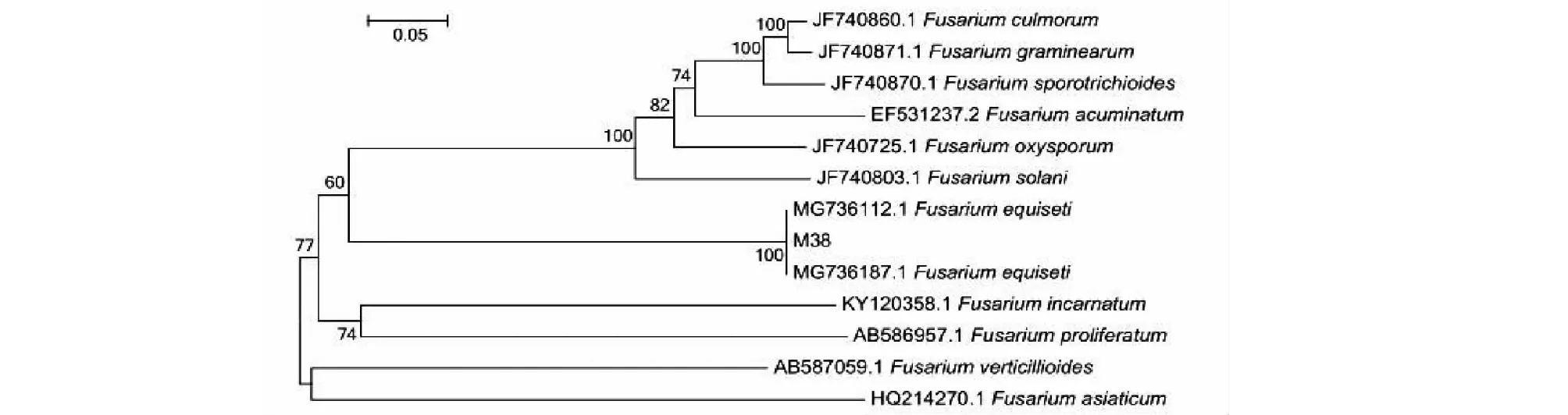
图5 荞麦茎枯病木贼镰刀菌的系统发育树Fig.5 Phylogenetic of Fusarium equiseti of buckwheat stem blight
2.5 菌株M38的生物学特性
2.5.1 培养基对菌株M38生长的影响 在OMA培养基上菌丝生长最快,平均菌落直径大小为65.51 mm,但在该培养基上菌落稀薄,菌丝紧贴培养基。菌丝在培养基PDA和PSA生长较快,平均菌落直径大小分别为61.69、57.93 mm,且2种培养基上菌落紧致,菌丝疏松茂密,因此培养基PDA和PSA最适菌丝生长。菌丝在CA、Czapek培养基上生长较慢,平均菌落直径大小分别为56.20、54.45 mm。菌丝在CMA培养基上生长最慢,平均菌落直径大小为50.78 mm(表1)。
2.5.2 温度对菌株M38生长的影响 菌丝在28 ℃下生长最快,菌落致密,平均菌落直径大小为61.23 mm,与其他温度处理存在显著差异,因此最适菌丝生长的温度为28 ℃。菌丝在25、30 ℃温度下生长较快,平均菌落直径大小分别为59.91、57.94 mm。菌丝在5 ℃下生长最慢,平均菌落直径大小为16.86 mm(表1)。
将分别在40、45、50、55、60、61、62、63、64 ℃水浴恒温处理10 min的菌丝饼接种于PDA培养基平板,于28 ℃恒温培养5 d后9种温度水浴处理的菌丝饼均长出菌丝,在65 ℃水浴恒温处理10 min的菌丝饼接种于PDA培养基平板,于28 ℃恒温条件下培养10 d,菌丝未能长出,由此可见,菌丝的致死温度为65 ℃(时长10 min)。
2.5.3 pH对菌株M38生长的影响 pH 4.0~11.0内菌丝均能生长,其中在pH 8.0时菌丝生长最快,平均菌落直径大小为68.60 mm,生长速度明显快于其他处理,且菌落致密,表明pH 8.0最适菌丝生长。其次,菌丝在pH 9.0~11.0时生长较快,平均菌落直径大小依次为66.42、66.39、66.34 mm。在pH 4.0时,菌丝生长最慢,平均菌落直径大小为38.76 mm(表2)。
2.5.4 光照对菌株M38生长的影响 菌丝在连续黑暗条件下生长最快,平均菌落直径大小为59.55 mm,其次为光暗交替(12 h光照/12 h黑暗),平均菌落直径大小为57.19 mm,连续光照条件下的平均菌落直径最小,为53.51 mm(表2),由此可见,连续黑暗最适菌丝生长。
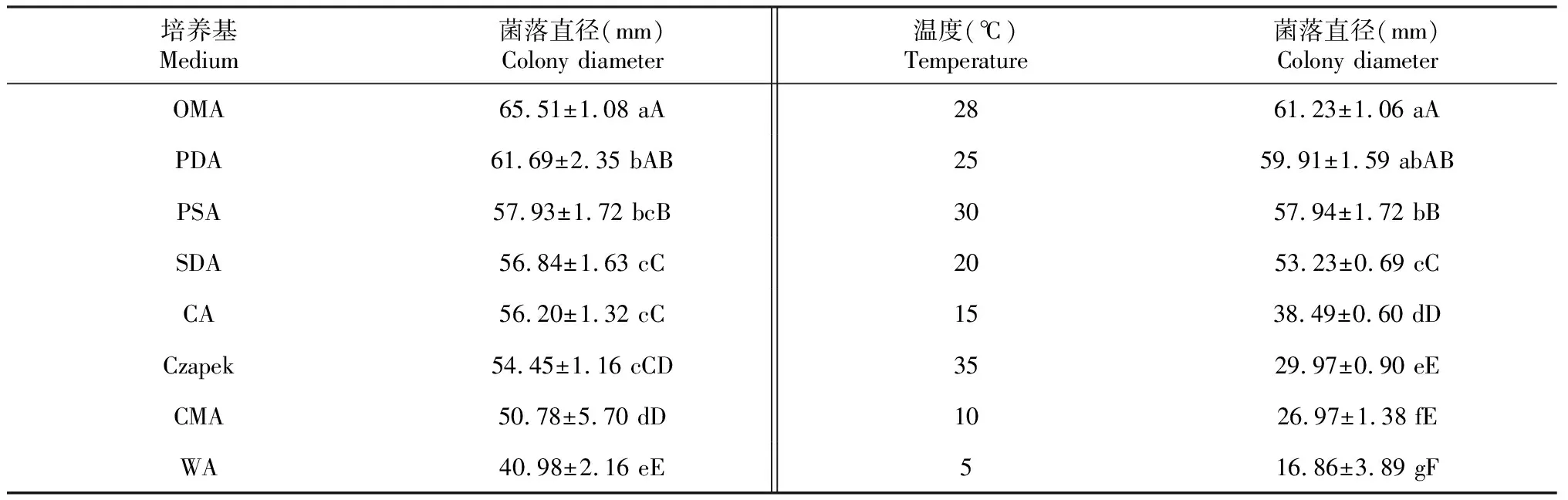
表1 培养基、温度对菌株M38生长的影响

表2 pH、光照对菌株M38生长的影响

表3 碳源、氮源对菌株M38生长的影响
2.5.5 碳源对菌株M38生长的影响 菌丝在以可溶性淀粉为碳源的培养基上生长最快,平均菌落直径大小为66.55 mm,生长速度快于其他碳源处理。其次,菌丝在以果糖、麦芽糖、甘露糖、葡萄糖为碳源的培养基上生长较快,平均菌落直径依次为65.76、63.14、62.06、61.69 mm。乳糖碳源培养基的平均菌落直径为19.98 mm(表3),最不适宜菌丝生长。
2.5.6 氮源对菌株M38生长的影响 在硝酸钠氮源培养基中菌丝生长最快,平均菌落直径为71.16 mm。其次,菌丝在牛肉浸膏、尿素、硝酸钾、蛋白胨4种氮源培养基中生长较快,其平均菌落直径依次为66.60、65.66、62.55、61.39 mm。以硫酸铵为氮源的培养基最不适宜菌丝生长,平均菌落直径为52.95 mm(表3)。
3 讨 论
本研究通过观察菌株M38分别在PDA培养基、Bilay培养基和米饭培养基上的菌落形态特征,并利用显微镜观察病原菌的分生孢子、厚垣孢子及产孢细胞的形态特征,结合分析菌株M38的rDNA-ITS序列的系统发育树,将该病原菌鉴定为木贼镰刀菌(F.equiseti)。木贼镰刀菌为镰刀菌属真菌,寄主范围广,可侵染危害多种植物引起病害发生。国内研究报道主要病害有大白菜枯萎病[23]、刚竹秆褐腐病[24]、辣木枝枯病[25]、头花蓼梢腐病[26]、烟草根腐病[27]、北苍术枝枯病[28]等,国外研究报道的主要病害有豇豆根腐病[29]、苏柏叶枯病[30]、鱼尾葵叶茎枯病[31]等,该病原菌引起的作物病害给农业生产造成严重的经济损失。
康迅等[25]对辣木枝枯病菌株MO157的生物学特性研究发现,PDA和PSA培养基最适菌丝生长,28 ℃为最适温度,这与本研究的结论一致;蔗糖和牛肉浸膏分别为最适菌丝生长的碳源和氮源,光照条件对菌丝生长无明显影响,这与本研究得到的菌株M38菌丝生长最适的碳源为可溶性淀粉,氮源为硝酸钠,连续黑暗最有利于菌丝生长的研究结论不同。任静等[26]对头花蓼茎枯病病原菌研究发现,硝酸钠为最适病原菌菌丝生长的氮源,28 ℃最适菌丝生长,65 ℃(时长10 min)为菌丝的致死温度,这与本研究的结果一致;头花蓼茎枯病病原菌生长的最适碳源为果糖,与本研究结果存在差异。温晓蕾等[28]对北苍术枝枯病病原菌的生物学特性研究结果表明,病原菌菌丝生长的最适温度为25~30 ℃,最适pH为8~11,这与本研究的菌株M38菌丝生长的最适温度为28 ℃,pH为8.0,适宜在偏碱性的环境下生长结论相似;北苍术枝枯病病原菌菌丝生长最适的培养基为燕麦和玉米面培养基,最适碳源和氮源分别为葡萄糖和酵母浸出粉,与本研究的结果不同。
4 结 论
本研究通过观察菌株M38的孢子形态特征,结合菌株M38 rDNA-ITS的序列分析,对云南荞麦茎枯病的病原菌进行系统鉴定,明确了引起为该病害的病原菌为木贼镰刀菌(F.equiseti)。通过测定病原菌的生物学特性,明确菌株M38的菌丝最适宜生长的培养基为PDA和PSA,最适宜生长的温度为28 ℃;菌丝的致死温度为65 ℃(时长10 min);菌丝最适宜生长的pH为8.0,最适宜生长的光照条件为连续黑暗,最适宜生长的碳源和氮源分别为可溶性淀粉和硝酸钠。

