飞蝗雌成虫脂肪体G蛋白偶联受体鉴定及其在卵发育中的功能
贠佳琦,杨洁冰,许慧晶,郑洪远,周树堂
(河南大学生命科学学院,棉花生物学国家重点实验室,河南开封 475004)
G蛋白偶联受体(G protein-coupled receptor,GPCR)为含有7次跨膜(transmembrane,TM)结构域的受体蛋白家族,通过偶联的异源三聚体G蛋白(αβγ亚基)激活第二信使及其级联通路,将细胞外配体信号转导入胞内,从而调控特定生理进程(Caersetal.,2012;Pietrantonioetal.,2018)。昆虫中,GPCR介导激素、生物胺、神经肽等内分泌因子的信号传递,在行为、生长、发育和生殖等多种过程中发挥关键作用(Baietal.,2011;Van Wielendaeleetal.,2013a;Audsley and Down,2015)。根据氨基酸序列构成和功能,昆虫GPCR分为4个亚家族:A类视紫红质样受体(rhodopsin-like receptor)、B类分泌素样受体(secretin-like receptor)、C类代谢型谷氨酸受体(metabotropic glutamate receptor)和D类非典型7次跨膜蛋白(atypical 7TM protein)。利用基因组学分析,多种模式昆虫的GPCR已得到鉴定,包括黑腹果蝇Drosophilamelanogaster、冈比亚按蚊Anophelesgambiae、家蚕Bombyxmori、赤拟谷盗Triboliumcastaneum和豌豆蚜Acyrthosiphonpisum等(Brody and Cravchik,2000;Hilletal.,2002;Fanetal.,2010;Baietal.,2011;Lietal.,2013)。此外,西方蜜蜂Apismellifera、长红猎蝽Rhodniusprolixus、褐飞虱Nilaparvatalugens、飞蝗Locustamigratoria和沙漠蝗Schistocercagregaria中的神经激素和神经肽受体也已报道(Hauseretal.,2006;Badiscoetal.,2011;Van Wielendaeleetal.,2013b;Tanakaetal.,2014;Onsetal.,2016;Lenaertsetal.,2019)。虽然许多昆虫种类的GPCR已得到鉴定,但其在昆虫生殖中的功能还有待进一步研究。
脂肪体是昆虫体内营养物质储存的关键组织,为变态、生殖、飞行和免疫等耗能事件提供基本的能量供应(Law and Wells,1989;Smykal and Raikhel,2015)。昆虫的大部分中间代谢过程都发生在脂肪体中(Arrese and Soulages,2010)。为了满足不同生理进程中不断变化的物质需求,脂肪体需要整合来自多个器官的信号以发挥多种代谢功能,其中许多功能受到内分泌激素的调控(Gäde,2004)。卵黄发生是昆虫产卵繁殖的前提。此过程中脂肪体整合多重内分泌调控信号大量合成卵黄原蛋白(vitellogenin,Vg),从而促进发育中的卵母细胞成熟,为后期的胚胎发育提供营养储备。生物胺、神经肽等小分子是昆虫生殖调控的重要内分泌因子(Simonetetal.,2004;Gruntenko and Rauschenbach,2008;Van Wielendaeleetal.,2013a;Smykal and Raikhel,2015)。这些小分子配体的信号由GPCR介导,或直接作用于生殖组织而调控卵的发育,或通过调控其他激素的分泌而间接影响卵的发育和卵巢生长。然而,参与调控昆虫卵发育调控的具体GPCR还有待鉴定。
飞蝗是昆虫神经生理和内分泌研究的重要模式生物,并且生殖力强大,单次产卵60~80粒,单次卵量总重可达500 mg,一生产卵5~6次。飞蝗的卵黄发生主要由保幼激素(juvenile hormone,JH)调控(Lietal.,2019;Song and Zhou,2020)。JH通过其核受体复合体Met/Tai(Methoprene-tolerant/Taiman)、早期响应因子Kr-h1以及细胞周期相关基因Mcm4,Mcm7,Cdc6,Cdk6和E2f1诱导脂肪体大量合成Vg,从而促进卵母细胞快速成熟(Guoetal.,2014;Songetal.,2014;Wuetal.,2016;Wangetal.,2017)。JH还通过PKCα介导的膜信号诱导Kr-h1磷酸化进而募集CREB结合蛋白(CREB-binding protein)最终增强核糖体蛋白L36(ribosomal protein L36)和Vg的合成(Wuetal.,2021)。此外,JH诱激亮氨酸羧基甲基转移酶1(leucine carboxyl methyltransferase 1)-PP2A信号通路进而诱导FoxO去磷酸化最终促进Vg大量合成。本研究通过转录组学分析,从飞蝗雌成虫脂肪体中共鉴定43个GPCR基因,其中29个为首次报道;qRT-PCR分析显示,29个基因在脑、胸腹神经节、脂肪体、卵巢和中肠中具有多样的表达模式;通过RNAi筛选,发现5个GPCR基因在飞蝗卵发育和卵巢生长过程中发挥关键作用。本研究为深入探究GPCR在JH依赖的卵黄发生和卵发育中的分子调控网络提供了新的依据。
1 材料与方法
1.1 供试昆虫
本研究所用飞蝗为实验室连续多代稳定繁殖种群。每日新鲜麦苗和麦麸混匀饲喂。飞蝗饲养于长×宽×高=35 cm×35 cm×35 cm的金属笼内,饲养密度为200头/笼左右,饲养笼定期清理保持整洁。环境温度为30±2℃,光周期为14L∶10D。
1.2 序列比对与聚类分析
前期研究已经获得第1个促性腺周期内飞蝗雌成虫脂肪体转录组测序数据,共获得72 643个unigenes (Zhengetal.,2021)。根据黑腹果蝇、冈比亚按蚊、家蚕、赤拟谷盗等昆虫中已鉴定的GPCR蛋白序列,在飞蝗雌成虫脂肪体转录组中进行TBLASTN比对筛选GPCR基因。利用ClustalW对同源序列进行成对比对和多重序列比对,并使用MEGA 6基于邻接法进行聚类分析。自NCBI GenBank数据库(https:∥www.ncbi.nlm.nih.gov)获得昆虫同源GPCR蛋白序列。
1.3 qRT-PCR检测基因表达量
分别取羽化后6 d(卵黄发生期)飞蝗雌成虫的脑、胸腹神经节、脂肪体、卵巢以及中肠,使用TRNzol法提取各个组织总RNA。使用FastKing cDNA第1链合成试剂盒(天根)进行反转录获得cDNA,按SuperReal Premix Plus试剂盒(天根)步骤,配制PCR反应体系,以Light Cycler 96 (Roche)进行qRT-PCR检测。PCR反应程序:95℃预变性15 min;95℃变性15 s,60℃退火15 s,72℃延伸20 s,40个循环。根据溶解曲线分析引物扩增的特异性。利用2-ΔΔCt法,以核糖体蛋白基因rp49为内参基因,计算目的基因的相对表达水平;每个组织包括8~10个生物学重复,每生物学重复取自1~2头试虫。qRT-PCR所用引物见表1。
1.4 RNAi实验
为了研究GPCR在飞蝗卵发育和卵巢生长中的功能,利用RNAi技术对本研究新鉴定的29个GPCR基因分别进行表达干扰,并在卵黄发生末期观察卵母细胞发育和卵巢生长表型。以1.3节所得cDNA为模板,利用PCR扩增新鉴定的29个GPCR基因和GFP片段,并将其重组入pGEM-T载体,通过测序验证扩增片段的正确性。以测序验证正确的pGEM-T重组载体为模板,PCR扩增获得含有T7位点的DNA模板。dsRNA的合成采用T7 RiboMAX Express System试剂盒(Promega)。根据此前报道的方法(Wuetal.,2018),在雌成虫羽化当天注射dsRNA,并在羽化后第5天加强注射。注射剂量为每头雌成虫每次15 μg。以注射等量dsGFP的雌成虫作为对照。于羽化后第8天取样,使用佳能EOS550D相机拍摄卵巢。初级卵母细胞解剖后置于载玻片上,以M205A体式显微镜(Leica)拍照并测量,观察测定飞蝗初级卵母细胞以及卵巢发育状况,并通过qRT-PCR检测目的基因在脂肪体和卵巢中的表达水平(方法同1.3节)。RNAi所用引物见表1。

表1 引物信息Table 1 Primer information
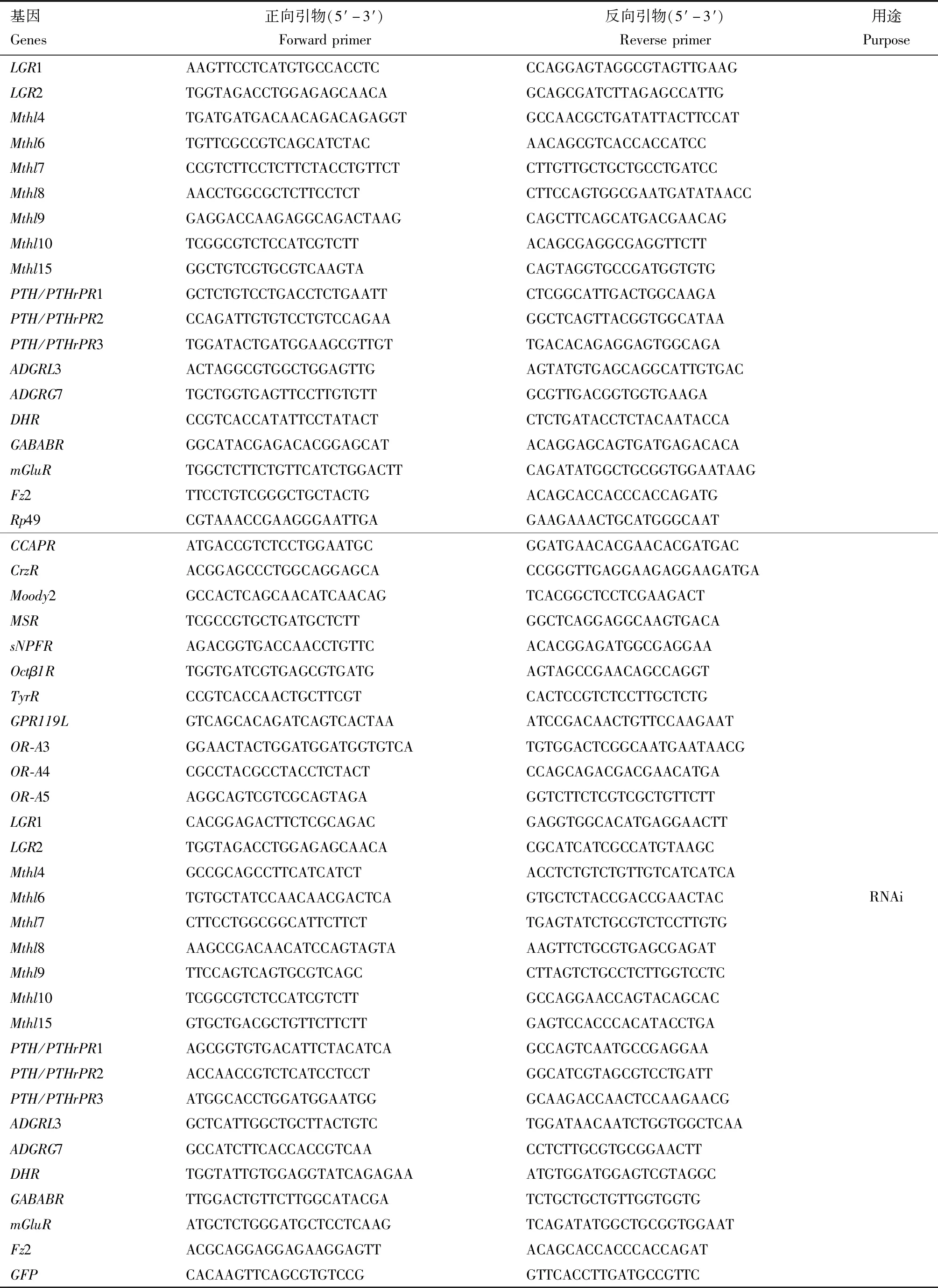
续表1 Table 1 continued
1.5 数据分析
利用STATISTICA 12.0软件对所得数据进行T检验或方差分析。利用GraphPad Prism 8.0计算平均值和标准误,并制作图片。
2 结果
2.1 飞蝗雌成虫脂肪体转录组GPCR基因鉴定
利用BLAST比对和聚类分析在飞蝗雌成虫脂肪体转录组中共鉴定得到43个GPCR基因,其中14个GPCR基因(GenBank登录号:ON807135-ON807148)在前期研究中已有报道(Zhengetal.,2021),29个GPCR基因为本研究首次鉴定,分别编码13个A类受体(视紫红质样受体)、13个B类受体(分泌素样受体)、2个C类受体(代谢型谷氨酸受体)和1个D类受体(非典型7次跨膜蛋白)。其中,A类受体包括5个神经肽受体,分别为心动加速肽受体(cardioacceleratory peptide receptor,CCAPR)、黑化诱导肽受体(corazonin receptor,CrzR)、Moody2、抑肌肽受体(myosuppressin receptor,MSR)和短神经肽F受体(short neuropeptide F receptor,sNPFR) (图1:A);2个生物胺类受体,分别为章鱼胺受体β1R受体(octopamine receptor beta 1R,Octβ1R)和酪胺受体(tyramine receptor,TyrR)(图1:B);6个孤儿受体,分别为GPR119L(GPCR119L),LGR1(leucine-rich repeats-containing GPCR 1),LGR2,OR-A3(orphan receptor-A3),OR-A4和OR-A5 (图1:C)。13个B类受体包括7个Mth/Mthl(Mthl4,Mthl6,Mthl7,Mthl8,Mthl9,Mthll0和Mthl15)(图2:A)、3个甲状旁腺激素/甲状旁腺相关多肽受体(parathyroid hormone/parathyroid hormone-related peptide receptor,PTH/PTHrPR)、2个ADGR (adhesion GPCR)和1个利尿激素受体(diuretic hormone receptor,DHR) (图2:B)。C类GPCR为代谢型GABA-B受体(metabotropic γ-aminobutyric acid receptor,GABABR)和代谢型谷氨酸受体(metabotropic glutamate receptor,mGluR) (图2:C)。1个D类GPCR为Fz2 (图2:D)。
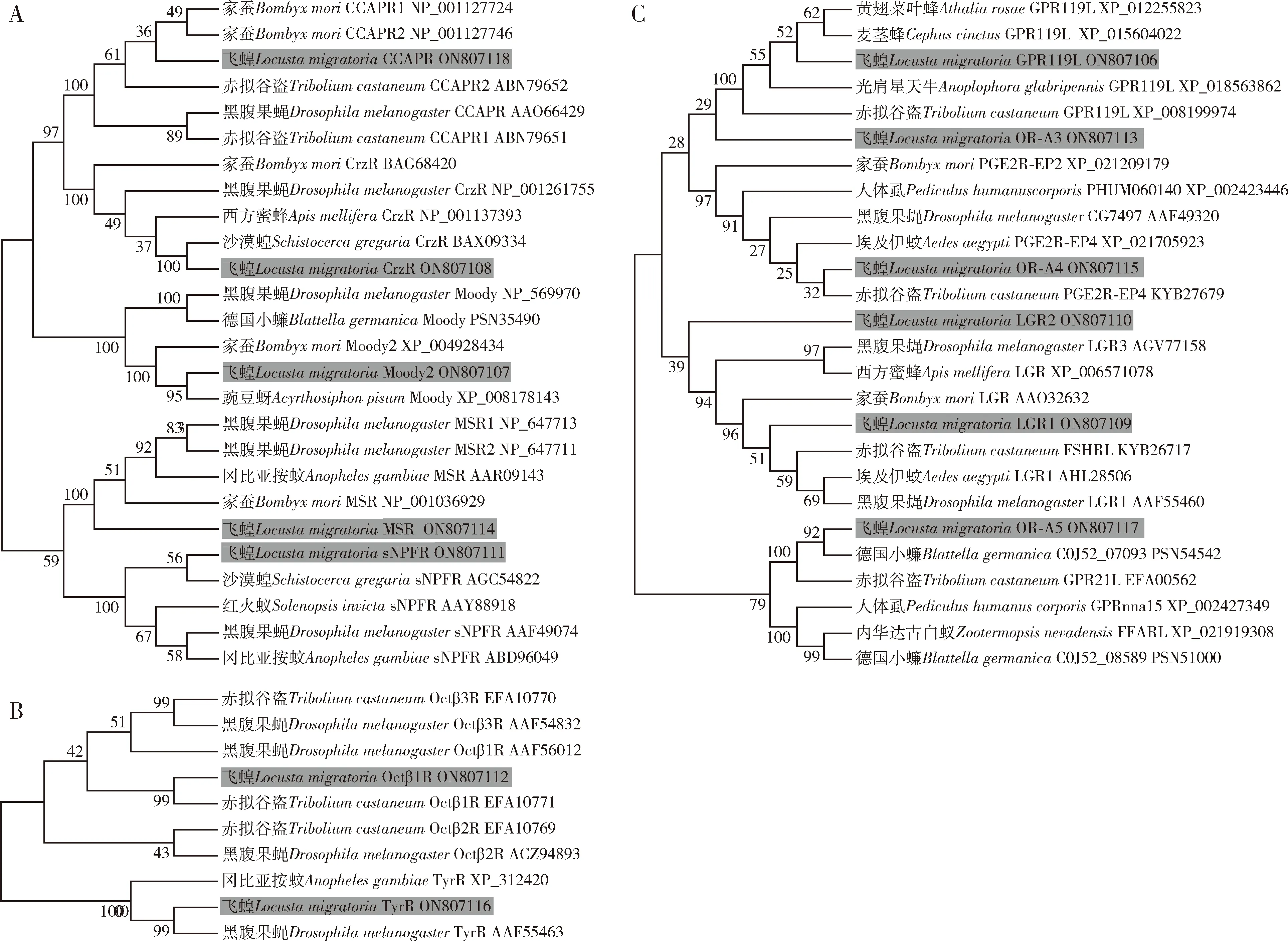
图1 基于氨基酸序列的飞蝗雌成虫脂肪体和其他昆虫中A类GPCRs聚类分析Fig.1 Cluater analysis of class A GPCRs identified in the fat body of female adults of Locusta migratoria and other insects based on amino acid sequenceA:神经肽受体Neuropeptide receptor;B:生物胺受体Bioammine receptor;C:孤儿受体Orphan receptor.本研究中新鉴定GPCR以灰色背景标记。GPCRs newly identified in the current study are marked by gray background.
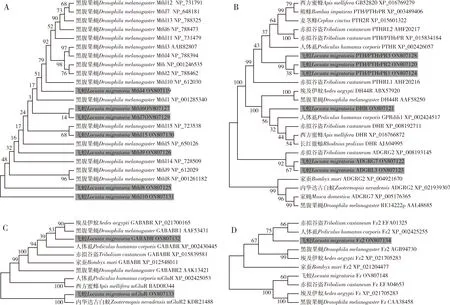
图2 基于氨基酸序列的飞蝗雌成虫脂肪体和其他昆虫中B (A,B),C (C)和D (D)类GPCRs聚类分析Fig.2 Cluster analysis of Class B (A,B),C (C) and D (D) GPCRs identified in the fat body of female adults of Locusta migratoria and other insects based on amino acid sequenceA:Mth/Mthl蛋白Mth/Mthl protein;B:PTH/PTHrPR,DHR和ADGR蛋白PTH/PTHrPR,DHR and ADGR proteins;C:代谢型GABA-B受体和谷氨酸受体Metabotropic GABA-B receptor and glutamate receptor;D:Fz蛋白Fz protein.本研究中新鉴定GPCR以灰色背景标记。GPCRs newly identified in the current study are marked by gray background.
2.2 飞蝗雌成虫GPCR基因的组织表达模式
利用qRT-PCR检测GPCR基因的组织表达模式,结果如图3所示,羽化后6 d(卵黄发生期)飞蝗雌成虫除脂肪体外,29个GPCR基因在胸腹神经节中也均有表达,其中PTH/PTHrPR1和MSR分别在脂肪体和胸腹神经节中显著高表达。脑中Octβ1R,CrzR,CCAPR,LGR2,mGluR和GABABR的表达水平显著高于其他组织中的(P<0.05);GPR119L,Mthl6和Mthl4在中肠中的表达水平最高。此外,脑中未检测到Mthl4表达,卵巢中未检测到Octβ1R表达,中肠中未检测到PTH/PTHrPR1表达(图3)。

图3 本研究新鉴定的29个GPCR基因在飞蝗卵黄发生期雌成虫不同组织中的表达模式Fig.3 Tissue expression patterns of 29 GPCR genes newly identified in this study in the vitellogenic female adults of Locusta migratoriaBr:脑Brain;Ov:卵巢Ovary;FB:脂肪体Fat body;Mg:中肠Midgut;Ga:胸腹神经节Thoracic and abdominal ganglia.×:未检测到目的基因的表达 Expression of target genes was undetectable.颜色深度表示基因相对表达水平的标准化值;星号表示基因在该组织中的表达量显著高于其他组织中的(P<0.05,单因素方差分析)。Shades of color indicate the normalized values of relative gene expression level.The asterisk means significantly higher expression level in this tissue than in the other tissues (P<0.05,ANOVA).n=8-10.
2.3 GPCR对卵发育和卵巢生长的影响
结果表明,RNA干扰CCAPR,PTH/PTHrPR1,ADGRL3,Mthl15和DHR5个GPCR基因的表达会抑制初级卵母细胞发育和卵巢生长。CCAPR属于神经肽受体,其心动加速多肽配体的主要功能为介导CAPA信号调控心率以及马氏管水分和离子稳态(Leeetal.,2013;Nagata,2016)。注射 dsCCAPR的雌成虫脂肪体和卵巢中,CCAPR表达水平相对于注射dsGFP的对照组分别显著降低55.5%和71.4%(P<0.05)(图4:A)。dsCCAPR处理后的雌成虫卵巢和初级卵母细胞明显小于对照组(图4:B);对照组雌成虫初级卵母细胞的平均长×宽为8.0 mm×8.0 mm,而注射dsCCAPR处理组的为6.8 mm×6.8 mm,二者差异显著(P<0.05)(图4:C)。

图4 CCAPR被RNAi后CCAPR的相对表达水平(A)及飞蝗卵巢生长(B)和初级卵母细胞发育(C)Fig.4 Relative expression level of CCAPR (A) and the ovarian growth (B) and primary oocyte development (C) in Locusta migratoria after RNAi of CCAPRdsRNA注射后8 d(成虫羽化后8 d)检测脂肪体和卵巢中目的基因的相对表达水平以及卵巢生长和初级卵母细胞发育。图中数据为平均值±标准误(n=8-29);柱上星号表示两组间差异显著 (*P<0.05;**P<0.01)(T检验)。The relative expression levels of target genes in the fat body and ovary and the ovarian growth and primary oocyte development were determined at 8 d post dsRNA injection (8 d post adult eclosion).Data in the figure are mean±SE (n=8-29).Asterisks above bars represent significant difference between two groups (*P<0.05;**P<0.01)(T-test).The same for the following figures.Ov:卵巢Ovary;Ol:卵小管Ovariole;Po:初级卵母细胞Primary oocyte.图5-8同。The same for Figs.5-8.
脊椎动物中PTH/PTHR通路已经有大量研究,其主要功能为调控骨骼重塑和钙离子代谢(Lanskeetal.,1996;Whiteetal.,2019),但昆虫中PTH/PTHR的研究报道较少。注射dsPTH/PTHrPR1的飞蝗雌成虫脂肪体和卵巢中PTH/PTHrPR1表达水平相比注射dsGFP的对照组分别显著下降92.4%和88.9%(P<0.01)(图5:A)。卵巢生长和初级卵母细胞发育受到明显抑制(图5:B),初级卵母细胞平均长×宽为5.6 mm×5.6 mm,显著小于对照组的(P<0.01)(图5:C)。

图5 PTH/PTHrPR1被RNAi后PTH/PTHrPR1的相对表达水平(A)及飞蝗卵巢生长(B)和初级卵母细胞发育(C)Fig.5 Relative expression level of PTH/PTHrPR1 (A) and the ovarian growth (B) and primary oocyte development (C) in Locusta migratoria after RNAi of PTH/PTHrPR1
注射dsADGRL3的雌成虫脂肪体中和卵巢中ADGRL3表达水平相比注射dsGFP的对照组分别显著降低69.3%(P<0.01)和64.5%(P<0.05) (图6:A)。卵巢和初级卵母细胞明显小于对照组的(图6:B),初级卵母细胞长×宽为1.8 mm×1.8 mm,较对照组的显著降低了78.1%(P<0.01)(图6:C)。

图6 ADGRL3被RNAi后ADGRL3的相对表达水平(A)及飞蝗卵巢生长(B)和初级卵母细胞发育(C)Fig.6 Relative expression level of ADGRL3 (A) and the ovarian growth (B) and primary oocyte development (C) in Locusta migratoria after RNAi of ADGRL3
与注射dsGFP的对照组相比,Mthl15的RNAi在雌成虫脂肪体和卵巢中分别引起78.1%(P<0.01)和72.4%(P<0.05)的表达水平下调(图7:A),明显阻碍了卵巢生长和初级卵母细胞发育(图7:B),初级卵母细胞长×宽为4.2 mm×4.2 mm,与对照组的相比显著降低了47.5%(P<0.01)(图7:C)。
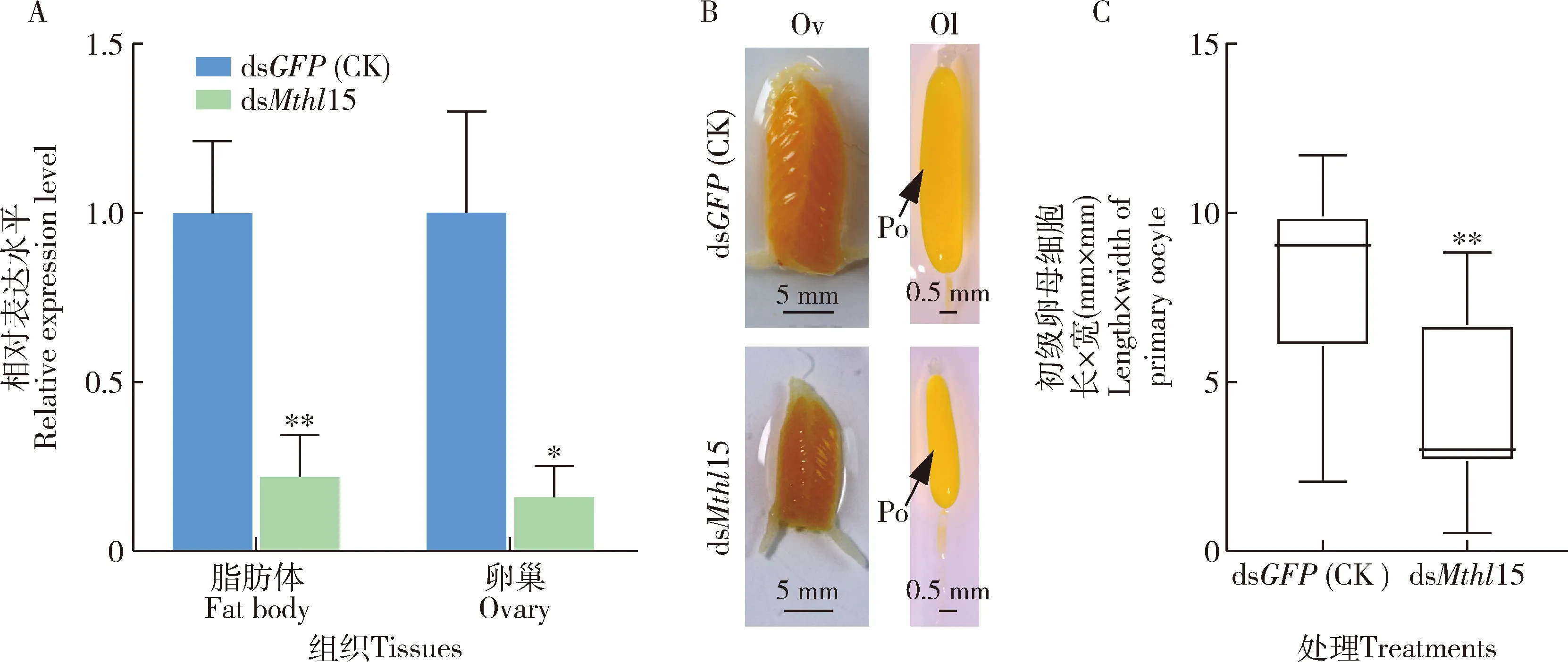
图7 Mthl15被RNAi后Mthl15的相对表达水平(A)及飞蝗卵巢生长(B)和初级卵母细胞发育(C)Fig.7 Relative expression level of Mthl5 (A) and the ovarian growth (B) and primary oocyte development (C) of Locusta migratoria after RNAi of Mthl5
与注射dsGFP的对照组相比,注射dsDHR的雌成虫脂肪体和卵巢中DHR表达水平分别显著降低了75.7%和68.4%(P<0.01) (图8:A),dsDHR处理组卵巢生长和初级卵母细胞发育受到明显抑制(图8:B),初级卵母细胞长×宽=4.6 mm×4.6 mm,较对照组的显著下降了43.3%(P<0.01)(图8:C),说明DHR可能通过参与调控机体的渗透稳态而在飞蝗卵黄发生中发挥重要作用。
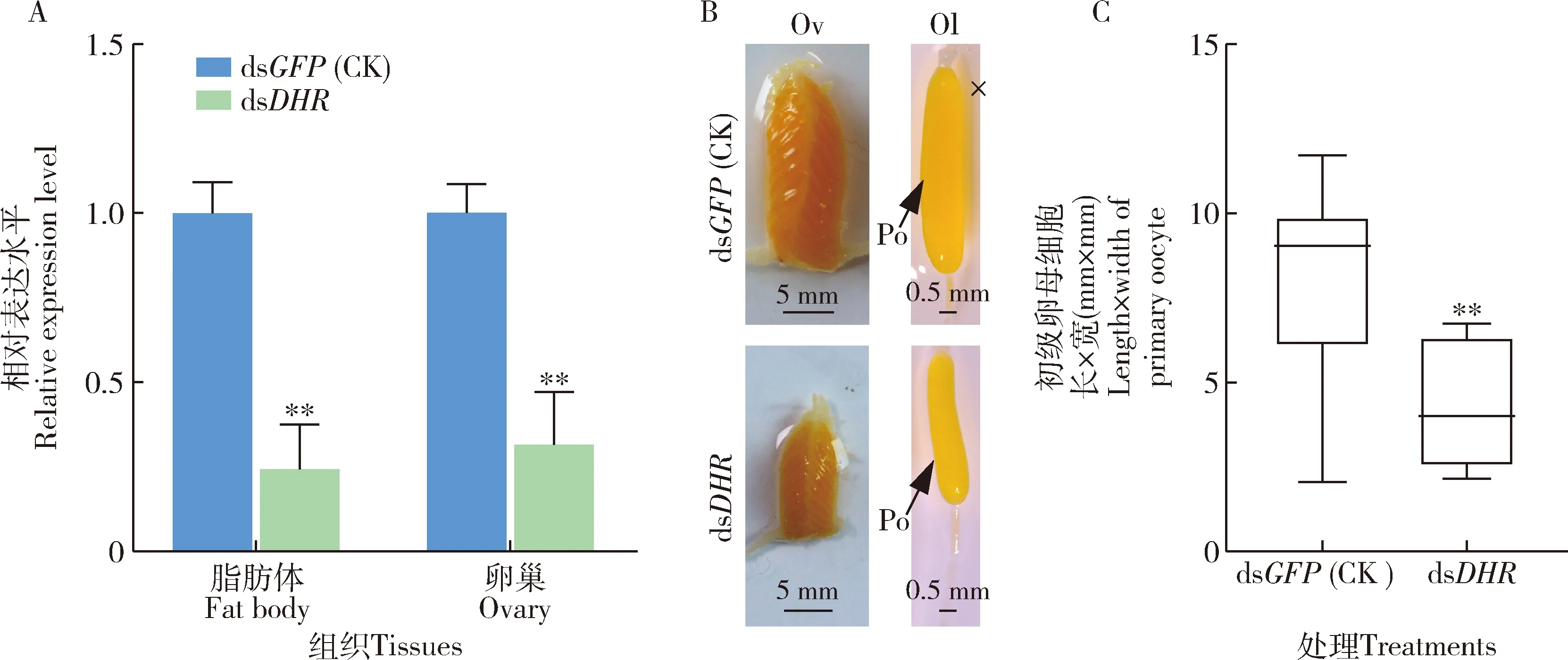
图8 DHR被RNAi后DHR的相对表达水平(A)及对飞蝗卵巢生长(B)和初级卵母细胞发育(C)Fig.8 Relative expression level of DHR (A) and the ovarian growth (B) and primary oocyte development (C) in Locusta migratoria after RNAi of DHR
3 讨论
本研究利用序列比对和聚类分析,在飞蝗雌成虫脂肪体中新鉴定得到29个编码GPCR的基因。在此基础上,对新鉴定基因进行组织表达分析和RNA干扰,明确在卵母细胞成熟和卵巢生长中具有重要功能的GPCR基因。RNAi筛选显示CCAPR,PTH/PTHrPR1,ADGRL3,Mthl15和DHR在飞蝗卵黄发生期卵巢生长和卵母细胞成熟中具有关键作用。吸血蝽Rhodniusprolixus中,CCAPR在雌性生殖系统中高表达,CCAPR表达受干扰后心跳速率下降31%(Leeetal.,2013)。果蝇中,CCAPR参与调控马氏管内的液体分泌,从而促进体内的水分平衡和离子稳态(Daviesetal.,2013)。本研究中,CCAPR的RNAi显著抑制卵巢和初级卵母细胞生长(图4:B,C),可能由血淋巴循环减弱和内稳态紊乱导致。最新研究表明,赤拟谷盗中的PTHR表达被RNA干扰后产卵量显著减少,后代卵孵化率也显著降低(Xieetal.,2020)。本研究中PTH/PTHrPR1的RNAi引起的卵巢生长和初级卵母细胞生长受阻(图5:B,C)与赤拟谷盗的研究结果相符,然而该基因在生殖过程中的作用机制尚不清楚。ADGR蛋白具有多个功能性结构域,如激素结合结构域、表皮生长因子-钙离子结合结构域等,哺乳动物ADGR在胰岛素分泌、脂肪生成、能量稳态等内分泌和代谢调控过程中具有核心作用,但昆虫中该类蛋白的功能和调控机制研究较少(Paavola and Hall,2012;Olaniru and Persaud,2019)。ADGRL3表达被RNA干扰的飞蝗雌成虫卵巢和初级卵母细胞生长受到严重抑制(图6:B,C),说明该受体对于飞蝗卵黄发生期的生理调控至关重要,然而其作用机理还有待进一步研究。Mth/Mthl蛋白为后生动物中古老的受体亚家族(Pateletal.,2012)。Mth突变的果蝇个体寿命延长35%,并且抵御饥饿、高温和氧化自由基等胁迫的能力也显著增强(Linetal.,1998)。赤拟谷盗中,Mthl1和Mthl2表达被RNA干扰的雌成虫产卵量显著降低,而Mthl1和Mthl4的RNAi严重抑制胚胎发育(Lietal.,2014)。本研究中Mthl15表达被RNA干扰的雌成虫初级卵母细胞生长受到显著抑制(图7:B,C)。因此Mth/Mthl蛋白表达降低引起的寿命延长和抗胁迫能力增强可能与生殖发育产生拮抗。昆虫利尿激素(diuretic hormone,DH)调控马氏管内的盐分和水分运输,并具有促进前肠、中肠以及背血管收缩的功能从而在取食相关的生理事件中发挥作用(Zandawala,2012;Nässel and Zandawala,2019)。本研究中DHR的RNAi显著阻碍雌成虫初级卵母细胞的发育(图8:B,C),说明DHR可能通过调节机体渗透平衡和个体取食进而参与飞蝗卵黄发生过程中的生理机能调控。
综上所述,尽管利用基因组学和转录组学的方法在许多昆虫物种中鉴定到大量GPCR,但对于昆虫生殖生理调控相关GPCR的功能和作用机制研究仍然有限。飞蝗为不完全变态昆虫的典型代表,也是研究昆虫卵黄发生过程中JH调控机理的理想模型。本研究通过转录组分析和RNAi,鉴定了5个候选GPCR基因,其在飞蝗卵黄发生期的卵发育和卵巢生长中发挥重要作用,为更深入地厘清JH依赖的卵黄发生基因调控网络提供进一步参考。对候选GPCR信号转导通路的研究也将有助于揭示其参与调节昆虫生殖发育的分子机制。

