红参酒总皂苷的超声提取工艺研究
都昊贤,王步江,2
(1.天津农学院食品科学与生物工程学院,天津 300384;2.天津市农副产品深加工技术工程中心,天津 300384)
人参作为一类重要的农业文化遗产,其种植最早可以追溯到我国的东汉时期[1-2]。在土壤、气候、种植模式等条件的影响下,我国的人参种植形成了以吉林省长白县为主要产区的可持续发展模式[3]。现代研究表明,人参中含有多种活性成分,如人参皂苷、多糖、氨基酸、挥发油、生物碱、酚酸、脂肪酸、多肽等[4-8]。许多专家学者研究发现,人参提取物具有多种药理作用,如抗氧化、抗衰老、抗抑郁、增强免疫等[9-10]。
我国酒文化有着深厚的历史底蕴,当前,大健康产业成为时代发展的潮流,因此具有健康属性的酒将会迎来高质量发展的新趋势[11]。目前,参酒的研究主要是以发酵型人参酒为主,通过发酵工艺提高人参皂苷和人参多糖的得率[12-13]。红参酒相关研究内容较少,红参是人参经蒸制后干燥的根和根茎,在蒸制过程中,人参中的还原糖与氨基酸发生了美拉德反应而产生褐色物质[14]。以红参为原料,在单因素试验基础上,开展响应面试验进行优化,旨在为红参酒的产品开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
红参(五年根),产地为吉林;50%Vol、55%Vol、60%Vol白酒,天津市直沽酿酒厂提供;人参皂苷Re标准品(纯度98%),北京索莱宝科技有限公司提供;香草醛(分析纯),上海阿拉丁生化科技股份有限公司提供;冰乙酸(分析纯),天津市汇杭化工科技有限公司提供;高氯酸(分析纯),天津市科密欧化学试剂有限公司提供;甲醇(分析纯),天津市大茂化学试剂厂提供。
1.2 试验仪器
分析天平(OHAUS),奥豪斯仪器上海有限公司产品;T6型紫外分光光度计,北京普析通用仪器有限责任公司产品;HWS28型电热恒温水浴锅,上海一恒科学仪器有限公司产品;Elmasonic P型超声清洗机,德国艾尔玛公司产品;Starter-3100型pH计,奥豪斯仪器有限公司产品。
1.3 试验方法
1.3.1 红参的前处理
取整颗红参,参茎部分切成厚度为0.5 cm的薄片,根须部位切成1 cm小段,将切好的参茎放入保鲜袋中混匀,取样时按参茎和根须质量比3∶1进行称量。
1.3.2 人参总皂苷含量的测定
(1)标准曲线的制作。参考赵亚等人[15]的方法配制人参皂苷Re标液并制作标准曲线,于波长560 nm处测定吸光度,得到标准曲线方程为:Y=3.062 5X+0.016 4,R2=0.999 2,具有良好的线性关系。
(2)红参酒人参总皂苷含量测定。吸取红参酒1 mL于10 mL具塞比色管中,置于60℃水浴挥干,加入质量分数为5%的香草醛-冰乙酸溶液0.2 mL,再加入高氯酸溶液0.8 mL,混合均匀,使残渣全部溶解,重新置于60℃水浴加热10 min,取出后用冰水冷却,加入冰乙酸溶液5.0 mL,立即用分光光度计于波长560 nm处,以试剂空白为参比,测定吸光度。
1.3.3 红参酒色度的测定方法
红参酒的色度测定参考郑新华[16]应用于浸泡青梅酒的色度测量方法。用蒸馏水调零,分别测定红参酒于波长420,520,620 nm处的吸光度。
具体计算公式如下:

式中:D——红参酒的色度;
OD420——红参酒于波长420 nm处的吸光度;
OD520——红参酒于波长520 nm处的吸光度;
OD620——红参酒于波长620 nm处的吸光度。
1.3.4 红参酒透光率的测定方法
红参酒的透光率测定参考王英[17]应用于灵芝首乌酒的透光率测量方法。用蒸馏水调零,测定人参酒于波长635 nm处的吸光度,吸光度的大小与酒的透光率呈正相关。
1.3.5 红参酒的pH值测定方法
红参酒的pH值使用电子pH计进行测定。
1.3.6 单因素试验
(1)超声时间的考查。称量4.000 0 g(精确至0.000 1 g)的红参于食品级塑料瓶,按照基酒倍数12倍,加入50%Vol的基酒,室温浸泡18 d后,在超声频率37 kHz,超声温度40℃条件下,分别以超声时间5,10,15,20,25 min,连续超声处理7 d,然后将酒样分别收集,供测定。
(2)超声间隔的考查。称量4.000 0 g(精确至0.000 1)的红参于食品级塑料瓶,按照基酒倍数12倍,加入50%Vol的基酒,室温浸泡18 d后,在超声频率37 kHz,超声温度40℃条件下,确保超声总时长不变的基础下,分别按超声时间10 min,每隔2 d超声处理20 min,每隔3 d超声处理30 min进行,将超声12 d后的酒样分别收集,供测定。
1.3.7 响应面试验设计
在单因素试验基础之上,选择基酒酒精度、超声时间和超声间隔3个因素,采用Design Expert 10.0软件进行响应面设计,称量4.000 0 g(精确至0.000 1 g)于食品级塑料瓶,按照基酒倍数12倍加入基酒,在室温下浸泡18 d后,按响应面试验所设计的条件超声12 d,以人参总皂苷含量为响应值,对红参酒的超声工艺进行优化。
响应面试验因素与水平设计见表1。
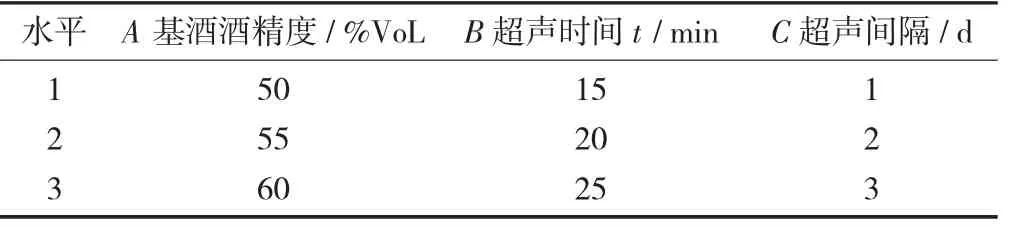
表1 响应面试验因素与水平设计
1.4 数据处理
所有数据均进行3次平行试验,结果取算术平均值。运用SPSS Statistics 17.0和Design Expert 10.0进行数据的处理和分析。
2 结果与分析
2.1 基酒基本性质的考查
基酒的基本性质见表2。
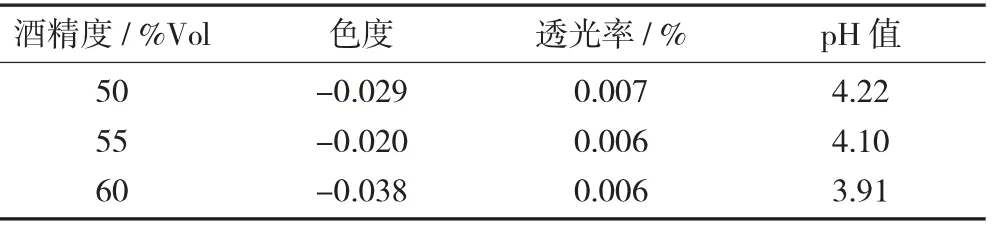
表2 基酒的基本性质
由表2可以看出,基酒酒精度升高,透光率下降,pH值下降。
2.2 单因素试验
2.2.1 超声时间的考查
超声时间对红参酒品质的影响见表3。

表3 超声时间对红参酒品质的影响
由表3可以看出,红参酒的色度和透光率值随超声时间的增加而增大,pH值呈上升趋势。与对照组相比,进行超声的红参酒在色度、透光率和pH值方面均上升。超声处理的试验组与对照组相比,人参总皂苷含量显著提高(p<0.05)。红参酒中人参总皂苷含量随着超声时间的增长而增加,超声25 min时人参总皂苷含量达到最大值。综上所述,选择超声时间15,20,25 min作为后续响应面试验的3个水平条件。
2.2.2 超声间隔的考查
超声间隔对红参酒品质的影响见表4。
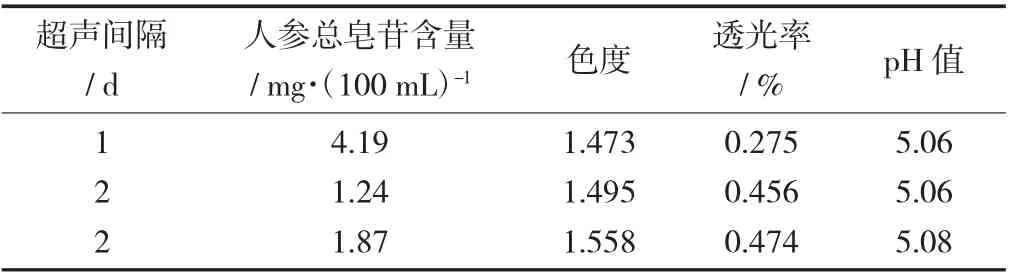
表4 超声间隔对红参酒品质的影响
由表4可以看出,每3 d超声30 min的红参酒总皂苷含量为4.87 mg/100 mL,优于每天超声10 min和每2 d超声20 min的红参酒,可能是由于长时间超声使红参组织结构受到反复的压缩和拉抻[18],更利于人参皂苷溶出。
2.3 响应面试验
2.3.1 响应面试验结果及显著性分析
在单因素试验基础上,设计响应面试验以优化超声辅助工艺的条件。
响应面试验结果见表5,人参总皂苷含量指标方差分析见表6。

表5 响应面试验结果
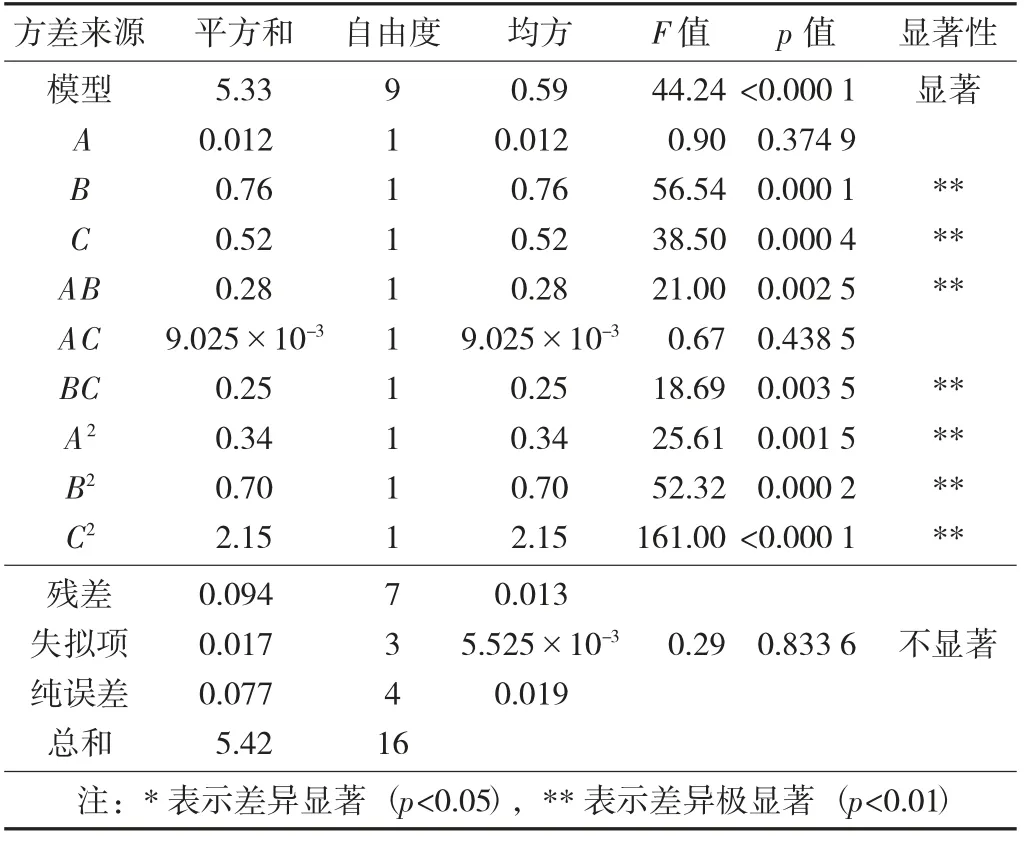
表6 人参总皂苷含量指标方差分析
运用软件对人参总皂苷含量(R1)与基酒酒精度(A)、超声时间(B)和超声间隔(C)进行三元二次方程拟合,则拟合方程为:
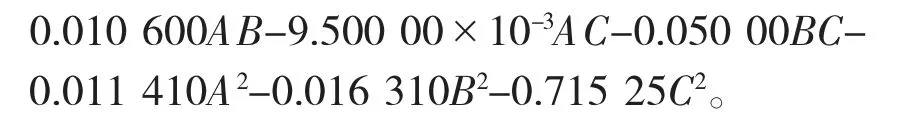
经过响应面拟合,模型方程具有显著性,且相关系数R2=0.960 5,表明模型拟合方程良好。由表6分析发现,超声时间和超声间隔对人参总皂苷含量影响显著,3个因素对人参总皂苷含量影响程度大小为超声时间>超声间隔>基酒酒精度。模型中B、C、AB、BC、A2、B2、C2对红参酒中人参总皂苷含量影响极显著,其余项影响不显著。
2.3.2 响应面各因素相互作用分析
超声时间和超声间隔的相互作用对人参总皂苷含量影响的响应面和等高线图见图1,超声时间和基酒酒精度的相互作用对人参总皂苷含量影响的响应面和等高线图见图2,超声间隔和基酒酒精度的相互作用对人参总皂苷含量影响的响应面和等高线图见图3。
由图1~图3可以看出,响应面等高线图可展现各因素间交互作用的强弱,三维响应面图的曲面坡度陡峭表明影响显著,反之则不显著[19]。等高线图越趋向椭圆,表明两因素相互作用影响显著。
由图1可以看出,当基酒酒精度不变时,人参总皂苷含量随超声时间的增加而增加,随超声间隔的增加呈先增后减的趋势。超声时间与超声间隔相互作用的等高线图呈椭圆形,曲面较陡,表明两因素间相互作用影响显著。
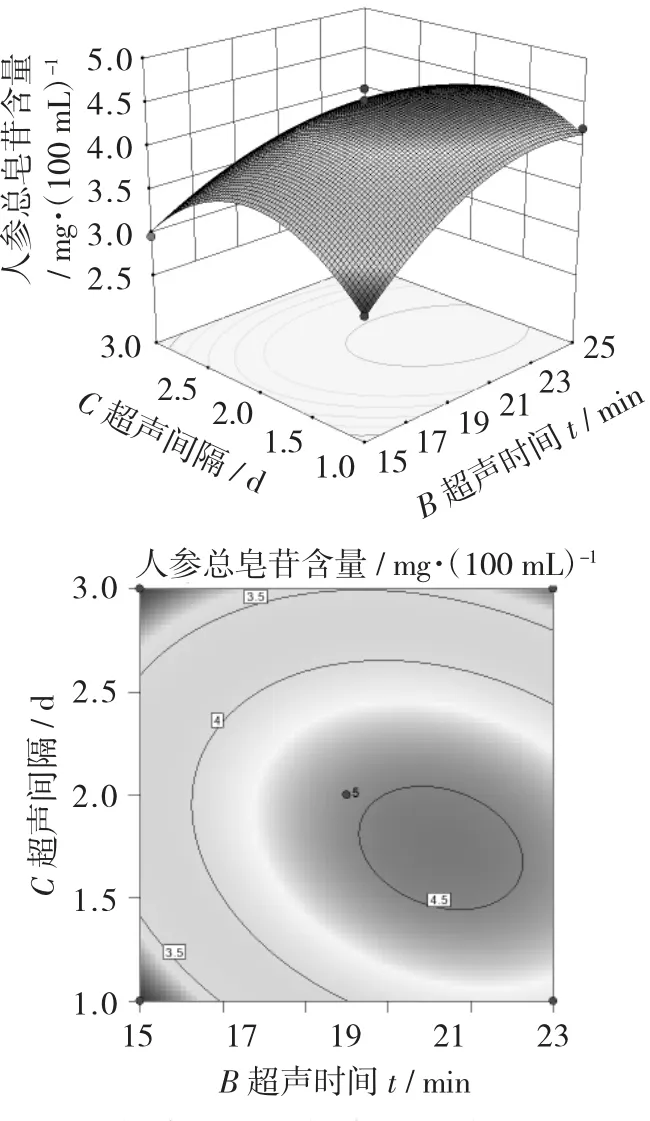
图1 超声时间和超声间隔的相互作用对人参总皂苷含量影响的响应面和等高线图
由图2可以看出,基酒酒精度和超声时间接近最优水平时等高线间距变大,等高线呈椭圆形,表明基酒酒精度和超声时间的交互作用对人参总皂苷含量影响显著,与方差分析结果一致。
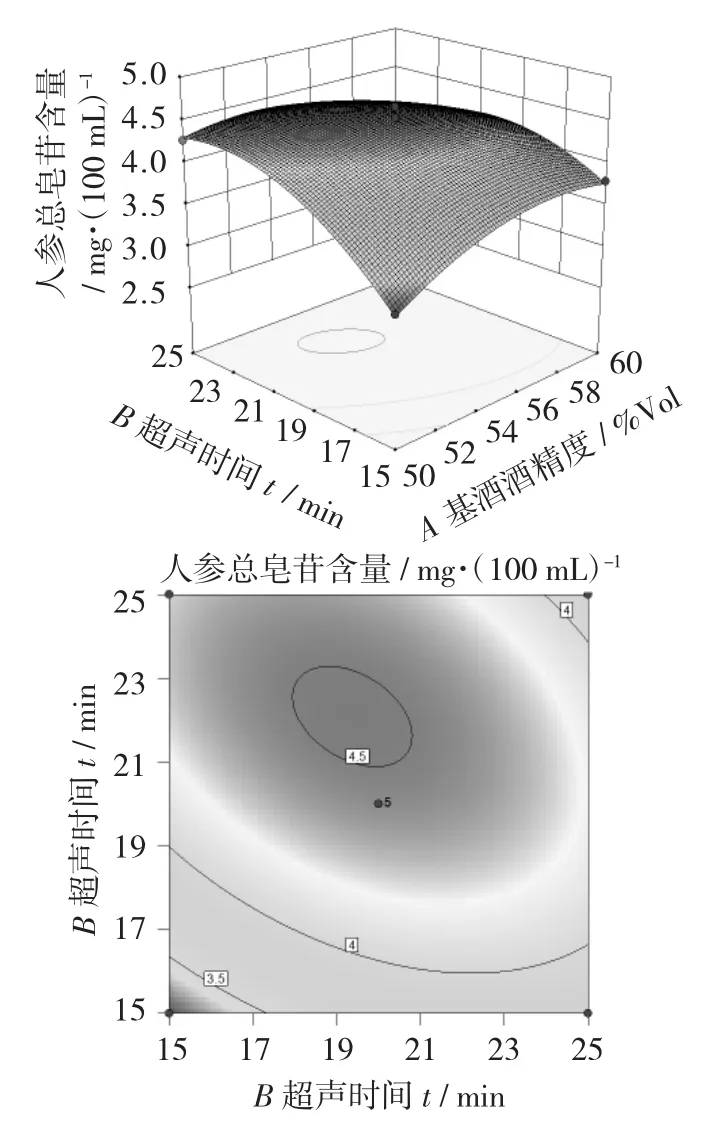
图2 超声时间和基酒酒精度的相互作用对人参总皂苷含量影响的响应面和等高线图
由图3可以看出,以超声时间为定量,人参总皂苷含量随着超声间隔或基酒酒精度的增大呈现出先增后减的趋势,变化幅度较小且曲面较平缓,说明超声间隔与基酒酒精度的相互作用对人参总皂苷的含量影响不显著。
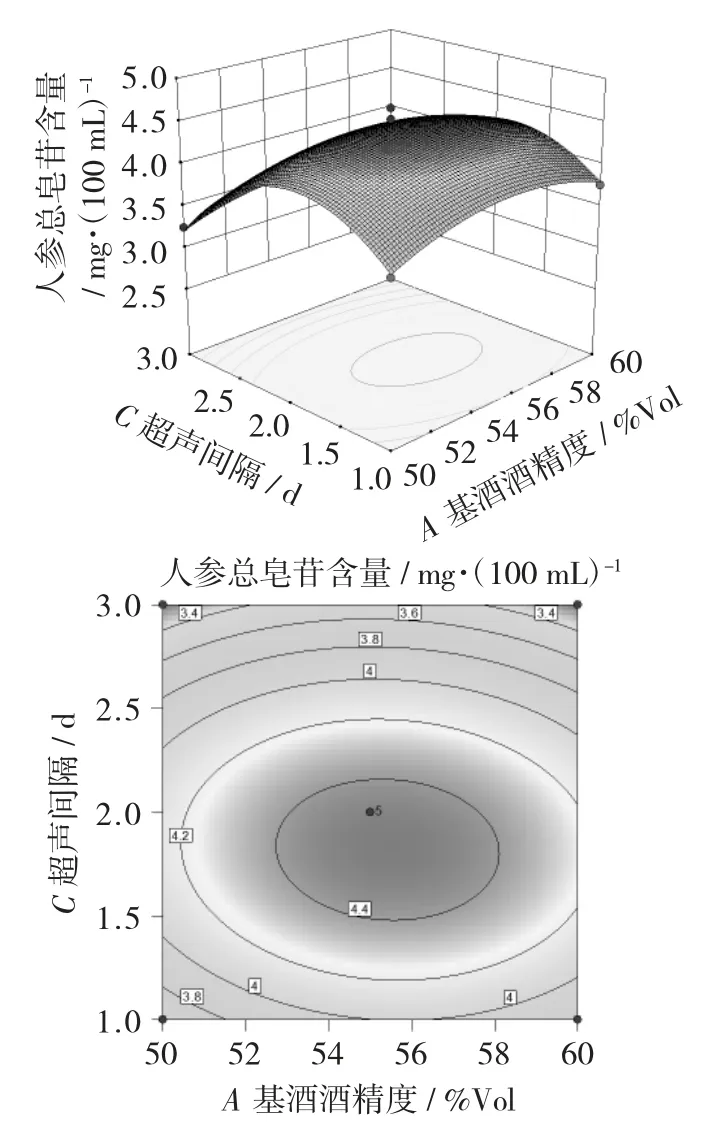
图3 超声间隔和基酒酒精度的相互作用对人参总皂苷含量影响的响应面和等高线图
2.3.3 验证试验
应用Design Eexpert 10.0得到红参酒的最佳超声提取工艺为基酒酒精度60.00%Vol,超声处理时间20.62 min,超声间隔1.77 d,此时人参总皂苷含量为4.25 mg/100 mL。考虑到可行性,将最佳工艺参数调整为基酒酒精度60%Vol,超声时间21 min,超声间隔2 d,进行3次平行试验,测得人参总皂苷含量为4.02 mg/100 mL,与预测值接近,说明该模型可行。
3 结论
通过单因素试验,发现超声时间对红参酒的色度、透光率等指标产生影响,超声提取工艺可以显著提高浸泡型红参酒的人参总皂苷含量。在单因素试验基础上进行了响应面试验,得到红参酒的最佳超声提取工艺为基酒酒精度60%Vol,超声时间21 min,超声间隔2 d。

