谷朊粉基共混黏合体系的构建及在素肉饼中的应用
曲 敏,王 宇,朱秀清,朱 颖,刘琳琳,黄雨洋,吕铭守,孙冰玉
谷朊粉基共混黏合体系的构建及在素肉饼中的应用
曲 敏,王 宇,朱秀清※,朱 颖,刘琳琳,黄雨洋,吕铭守,孙冰玉
(哈尔滨商业大学食品工程学院/黑龙江省普通高校食品科学与工程重点实验室/黑龙江省谷物食品与谷物资源综合加工重点实验室,哈尔滨 150028)
谷朊粉经水合作用形成面筋蛋白(Wheat Gluten Protein,WGP)网络结构,具有良好的黏弹性和延展性,但加热后其网络结构易破裂,稳定性较低。该研究利用谷朊粉、大豆分离蛋白(Soy Isolated Protein,SPI)、甲基纤维素(Methylcellulose,MC)、谷氨酰胺转氨酶(Glutamine Transaminage,TG酶)的原料特性,建立植物蛋白、亲水胶体、促凝胶酶的共混黏合体系,研究各组分对其理化性质、凝胶特性及结构的贡献和影响。结果表明,随着三种原料依次递进加入WGP,混合体系中二硫键含量分别较前一组降低81.03%、升高248.50%和0.70%,游离巯基含量升高68.79%、降低28.90%和20.44%,表面疏水性升高5.07%、降低6.85%、再升高17.17%,高分子量麦谷蛋白组分分子量则逐渐增加;持水性升高5.25%、2.91%、2.79%,凝胶强度升高104.14%、24.66%、3.52%;共混凝胶的储能模量和损耗模量均逐渐升高;TG酶加入后,阻止了螺旋逐渐向转角、无规则卷曲的转化,螺旋和折叠含量上升。可见共混黏合体系凝胶的分子间缠结点增多、凝胶性变强。虽然SPI的添加部分破坏了WGP网络结构,但SPI、MC、TG酶增加了蛋白的聚集程度和凝胶强度。扫描电镜观察显示,SPI镶嵌在WGP网络骨架中,形成半网络半填充的新架构形式;随着MC和TG酶的依次加入,在形成大量交联丝状结构的基础上,局部形成连续膜状结构将大豆拉丝蛋白(Soy Drawing Protein,SDP)粒子覆盖。说明SDP粒子被完整、紧密地包裹于谷朊粉-SPI-MC-TG酶共混黏合体系中。利用此黏合体系制成SDP基素肉饼,依次向复水SDP中添加四种原料,显示素肉饼的硬度、内聚性、咀嚼性和弹性等均得以提升。因此,该研究建立谷朊粉基共混黏合体系是改善SDP为主要原料的素肉制品品质的有效方法。
凝胶;质构;谷朊粉;大豆分离蛋白;甲基纤维素;谷氨酰胺转氨酶;共混黏合体系
0 引 言
谷朊粉又称为活性面筋粉,主要由麦醇溶蛋白和麦谷蛋白组成,二种蛋白经水合作用,通过共价和非共价键形成精细而紧密的的网络结构,即面筋蛋白(Wheat Gluten Protein,WGP)[1]。在WGP中,蛋白质基质相对均匀,呈高度分枝状,使其具有良好的黏弹性、延展性和薄膜成型性,其网络结构为面制品的主要骨架,赋予面制品一定的形状,并作为一种优质原料在食品加工中被广泛应用[2]。
由于WGP含有大量的疏水性氨基酸、分子间疏水作用区域较大,导致WGP溶解性、持水性较低,其网络结构易破裂、稳定性低[3]。大豆分离蛋白(Soy Isolated Protein,SPI)含有大量亲水性羧基,吸水能力强,经过热诱导后形成胶束结构的凝胶,将SPI与WGP混合,SPI凝胶填充在WGP网络中,形成的蛋白交联网络中存在较大的间隙和更多的不规则性,提高了WGP的持水性和韧性等[4]。因此,可利用SPI的凝胶性,将其与WGP复配,形成稳定的交联网络骨架体系,同时,该骨架体系可捕获产品体系中的脂肪和其他组分,提升了产品的咀嚼性、弹性等品质特性[5]。卡拉胶、魔芋胶、黄原胶等不同结构的亲水胶体经常作为天然增稠剂被广泛应用于增塑蛋白网络的研究中。Maria等[6]将黄原胶、瓜尔豆胶、卡拉胶分别添加到小麦面团中,发现这些亲水胶体提升了小麦面团的延展性、黏弹性,使WGP网络更加紧密、没有中断。Azeem等[7]将黄原胶、SPI分别添加到小麦面团中,发现黄原胶和SPI增强了WGP的水结合能力、硬度,面筋交联网络结构增多。甲基纤维素(Methylcellulose,MC),是一种非离子性纤维素醚,MC链上含有具有疏水性的甲氧基和亲水羟基,常温下,MC通过羟基与水分子结合,形成围绕甲氧基的“笼状”结构,加热后,这些结构会扭曲和断裂,疏水区域暴露,形成由疏水相互作用驱动的聚集体[8]。MC通过氢键和疏水相互作用与蛋白质相结合形成凝胶,同时,由于亲水胶体的水分竞争机制导致蛋白发生失水性聚集从而促进凝胶形成[8]。MC的特性及在食品中的应用正日益受到关注。近年来,应用亲水胶体和促凝胶酶等形成的混合体系促进了植物蛋白形成稳定的凝胶结构,提高了食品的质构特性和保水性。其中,谷氨酰胺转氨酶(Glutamine Transaminase,TG酶)含有-羧酰胺基团可与植物蛋白的氨基相结合,催化蛋白质多肽发生分子内和分子间发生共价交联,提高植物蛋白的交联和凝胶强度[9]。以上研究集中关注了植物蛋白、亲水胶体和TG酶分别应用对食品品质特性的改善,但对于它们联合应用形成共混体系的黏合作用机制鲜见报道。本研究以谷朊粉、SPI、MC、TG酶为研究对象,依次建立植物蛋白、亲水胶体、促凝胶酶的共混体系,探究各组分对共混体系黏合特性的贡献;以大豆拉丝蛋白(Soy Drawing Protein,SDP)为原料,与共混黏合体系混合,考察体系中各组分与SDP粒子的相互作用。此共混黏合体系可应用到以植物拉丝蛋白为原料的素肉产品中,改善素肉制品的品质特性,旨在为规模化工业生产提供理论参考。
1 材料与方法
1.1 材料与仪器
谷朊粉、大豆分离蛋白、甲基纤维素、谷氨酰胺转氨酶,河南万邦实业有限公司。磷酸氢二钠,天津市天力化学试剂有限公司;考马斯亮蓝,上海迈坤化工有限公司;十二烷基硫酸钠,北京生东科技有限公司;冰醋酸,上海豪申化学试剂有限公司;溴酚蓝,沈阳先创化工有限公司;丙烯酰胺、双丙烯酰胺、甘氨酸、过硫酸铵,天津市旭泰化学试剂有限公司;5,5ʹ-二硫代双(2-硝基苯甲酸)(5,5ʹ-Dithiobis-(2-Nitrobenzoic Acid),DTNB),上海阿拉丁有限公司;1-苯胺基-8-萘磺酸(1-Anilino-8-Naphthalene Sulfonic Acid,ANS)。
搅拌器,奥克斯责任有限公司;DK-8D型恒温水浴锅,上海一恒科学仪器有限公司;L2-4K型低速台式离心机,湖南可成仪器设备有限公司;ESJ180-4型电子天平,上海恒平科学仪器有限公司;TA-XT2i型质构分析仪,英国StableMicroSystem公司;S-3400N型扫描电镜,日本Hitachi公司;722G型可见分光光度计,上海精科有限公司;F97Pro型荧光光谱仪,上海凌光技术有限公司;FTIR-650型傅里叶红外光谱仪,杭州格图科技有限公司;DYCZ-24DN型电泳仪,北京六一仪器厂;MCR-102流变仪,奥地利安东帕公司;LGJ-12真空冷冻干燥机,宁波市双嘉仪器有限公司。
1.2 试验方法
1.2.1 共混黏合体系凝胶的制备
参考Tian等[10]和林晗等[11]的方法并加以改进。将SPI、MC、TG酶依次加入到谷朊粉中,探究各组分在共混黏合体系中的黏合作用机制与贡献。5种样品,如表1所示,将谷朊粉与水以20∶100(g/mL)的比例混合,记为1号样品;将SPI与水以20∶100(g/mL)的比例混合,记为2号样品;将谷朊粉与SPI以9∶10的质量比例混合后,再与水以20∶100(g/mL)的比例混合,记为3号样品;向3号样品中加入0.6%MC(以混合蛋白干基为准),记为4号样品;向4号样品中加入1%TG酶(以混合蛋白干基为准),记为5号样品。

表1 共混黏合体系凝胶样品
以上5组样品在4 000 r/min条件下搅拌5 min,放入55 ℃的条件下水浴30 min,90 ℃水浴30 min,制得共混黏合体系凝胶。经冷冻干燥后粉碎过100目(孔径0.15 mm)筛备用。
1.2.2 共混黏合体系理化性质的测定
1)二硫键的测定
参考荣荟等[12]的方法并进行改进。将1.2.1中制备的冻干粉配制成质量浓度为10 mg/mL的溶液,取400L溶液于10 mL离心管中,加入20L巯基乙醇和1.6 mL尿素-盐酸胍溶液,于25 ℃恒温水浴1 h后,于5 000 r/min条件下离心10 min,取出沉淀,清洗两次,再离心。向离心后的沉淀中加入4 mL 0.01 mol/L、pH值8.0磷酸缓冲溶液和32L的DTNB,于25 ℃恒温水浴1 h,于10 000 r/min下离心30 min,取上清液在412 nm处测定吸光度,即为总巯基含量。
将1.2.1中制备的冻干粉配制成浓度为10 mg/mL的溶液,取2 mL溶液加入等量的0.01 mol/L、pH值8.0磷酸缓冲溶液和67L的DTNB,于25 ℃恒温水浴1 h,在10 000 r/min下离心30 min,取上清液在412 nm处测定吸光度,即为游离巯基含量。

式中412为吸光度值;为蛋白质溶液的浓度,mg/mL;为稀释倍数。

2)表面疏水性的测定
参考石佳卉等[13]的方法并加以改进。将1.2.1中制备的冻干粉溶于0.01 mol/L pH值7.0的磷酸缓冲溶液中,并将蛋白浓度分别稀释为0.5、0.25、0.125、0.062 5 mg/mL。每个浓度样品取4 mL,分别与20L ANS溶液(0.01 mol/L pH值7.2磷酸缓冲溶液,8 mmol/L ANS)旋涡振荡5 s,充分混匀后黑暗处理10 min 后进行测定。具体参数设置如下:激发波长390 nm;发射波长470 nm;狭缝宽5 nm。
3)SDS-PAGE凝胶电泳
参考江连州等[14]的方法并稍作修改。采用10%的分离胶,4%的浓缩胶来测量。将1.2.1中制备的冻干粉以2 mg/mL的质量浓度溶于8 mol/L尿素溶液中保持1 h,在5 000 r/min离心10 min;取10L上清液与10L还原型上样缓冲液混合(含-巯基乙醇),在95 ℃下加热5 min后,每个胶道上15L样品。
1.2.3 共混黏合体系凝胶特性的测定
1)流变学性质的测定
取1.2.1中制备的适量凝胶于流变仪平板上,所选夹具为40 mm平板,温度25 ℃,扫描频率范围为0.01~10 Hz,应变振幅为1%,记录每个样品的储能模量()和损耗模量()。
2)凝胶强度的测定
采用质构仪对1.2.1中制备的凝胶进行凝胶强度检测。选用P/0.5型号圆柱探针,测前速度1.0 mm/s、测试速率0.5 mm/s、返回速率10.0 mm/s;触发力5.0 g、测试循环次数1次、测试距离10 mm。
3)持水性的测定
参考杜洪振等[15]的方法,测定1.2.1中制备的凝胶的持水性。将2 g凝胶样品装入离心管中,于4 ℃,10 000×的条件下离心15 min,称取离心前后的质量。

式中1为离心前质量,g;2为离心后质量,g。
1.2.4 共混黏合体系凝胶二级结构的测定
将凝胶样品与溴化钾混合压片,放入傅里叶红外检测器测样口。扫描次数为32,分辨率为4 cm-1,扫描波数范围为400~4 000 cm-1,所得数据采用Peakfit软件进行分析。
1.2.5 共混黏合体系对拉丝蛋白粒子的作用观察
将20 gSDP浸泡在45 ℃水中,复水30 min至无硬心后取出,沥干水分后为干基的2.5倍。将复水的SDP放入斩拌机,斩拌3 min。向斩拌机中,分别加入3~5号样品各13 g,慢慢搅拌至形成均匀、具有黏性的团状物,记为样品A、B、C。各组样品转入55 ℃水浴处理30 min后,90 ℃水浴30 min。参照朱秀清等[16]的方法,并加以改进。将样品A、B、C分别切成约0.8 cm×0.6 cm×0.1 cm薄片,然后用pH值6.8戊二醛溶液进行固定,用pH值6.8磷酸缓冲溶液冲洗样品,后进行脱水、干燥。将处理后的样品均匀固定在贴胶的电镜进样台上,进行喷金处理,在扫描电镜(Scanning Electron Microscope,SEM)下观察试验结果。
1.2.6 共混黏合体系的应用
1)素肉饼的制备
参考李翠芳等[17]的研究方法并加以改进。将20 g SDP浸泡在含有0.05 g红曲色素的45 ℃水中,复水30 min至无硬心后取出,沥干水分后为干基的2.5倍。将复水的SDP放入斩拌机,斩拌3 min。向斩拌机中,分别加入15 g谷朊粉记为样品1;加入15 gSPI记为样品2;加入15 g谷朊粉与SPI的混合粉(混合比例9:10),记为样品3;向样品3中加入0.09 gMC记为样品4;向样品4中加入0.15 gTG酶记为样品5,在所有样品中加入20 g冰水、5 g植物油、0.05 g牛肉香精、1 g盐,慢慢搅拌至形成均匀、具有黏性的团状物,转入55 ℃水浴处理30 min。混合原料用直径8.5 cm、厚度10 mm的模具压制成型,于100 ℃下蒸煮20 min,取出,室温冷却。
2)素肉饼蒸煮损失测定
将素肉饼切成3.0 cm×3.0 cm×2.0 cm的小块,称重。蒸煮后,取出在室温下冷却,再称量。计算蒸煮前后样品质量的变化。蒸煮损失按下式计算:

3)素肉饼质构测定
将素肉饼切成2.0 cm×2.0 cm×1.0 cm的小块,利用质构分析仪对其进行分析。使用P50探针将样品压缩变形,触发力5.0 g,预测速度5.0 mm/s,测试速度1.0 mm/s,测试后速度2.0 mm/s。
1.3 数据分析
每组试验重复3次,试验数据经SPSS17.0软件分析,在0.05水平上对试验结果进行差异显著性分析,用Origin 2018软件作图。
2 结果与分析
2.1 共混黏合体系理化性质的测定结果
2.1.1 游离巯基和二硫键分析
WGP网络主要是由麦谷蛋白和麦醇溶蛋白之间以二硫键相连形成的大分子纤维状聚合体,当外界环境改变时,二硫键断裂引起WGP网络发生展开,进而解聚,巯基含量增加[18]。如图1可知,1组二硫键含量最多,2组游离巯基含量较多,与1、2组相比,3组游离巯基含量显著升高(<0.05),分别升高了68.79%、32.48%,二硫键含量显著降低(<0.05),分别降低了81.03%、38.29%。

注:上标不同字母表示同一指标在0.05水平差异显著;样品编号1、2、3、4、5分别表示谷朊粉、SPI、SPI+谷朊粉、SPI+谷朊粉+MC、SPI+谷朊粉+MC+TG酶,下同。
可见,在双蛋白凝胶形成的过程中,SPI的加入抑制了WGP分子间的二硫键连接,阻止WGP网络结构的形成,同时,由于SPI分子内部游离巯基含量较高,SPI的添加引起WGP游离巯基含量升高,这与Tian等[19]的研究结果一致,此外Tian等认为,SPI和WGP间通过二硫键连接形成凝胶聚合物。4组较3组,游离巯基含量下降28.90%,二硫键含量升高248.50%。MC加入后使二硫键明显增多,可能是因为MC通过羟基、疏水相互作用与双蛋白发生作用,且MC的吸水作用可促进双蛋白聚集,导致游离巯基的部分包埋、向二硫键转化,使双蛋白凝胶网络结构稳定性进一步加强。这个结果印证了Li等[20]的研究,Li等在将黄原胶、卡拉胶、阿拉伯胶分别添加到大豆蛋白中发现,亲水胶体与蛋白之间存在强烈的水分竞争关系,亲水胶体吸附蛋白侧链上的水形成凝胶,促进蛋白发生失水性交联,导致二硫键含量上升。5组较4组,游离巯基含量下降20.44%,二硫键变化不大,升高了0.70%(>0.05)。TG酶的加入引发了蛋白交联,导致游离巯基降低、二硫键少量增加,对WGP-SPI-MC凝胶网络起到进一步加固作用。因此,SPI与WGP结合导致WGP中的二硫键部分断裂、减少,MC和TG酶的添加促进了WGP和SPI之间的交联,相较于3组共混黏合体系中二硫键含量增加、游离巯基含量减少。
2.1.2 表面疏水性分析
蛋白质的大部分疏水残基处于分子内部,其结构的稳定很大程度依赖于分子内的疏水作用,蛋白质结构的重要特征是疏水与亲水作用之间的平衡,这涉及二硫键、氢键等作用力以及蛋白质的折叠方式,当外界环境改变时,蛋白构象发生改变,疏水基团暴露,导致蛋白的表面疏水性增加[21-22]。由图2可得,SPI的表面疏水性低于WGP,随着SPI、MC、TG酶依次加入WGP,表面疏水性呈现先上升再下降再上升的趋势,混合体系中表面疏水性的含量分别较前一组升高5.07%、降低6.85%、升高17.17%。可见,SPI的加入导致二硫键断裂、疏水键暴露,表面疏水性显著提高(<0.05);MC与双蛋白暴露出的疏水基团结合,导致蛋白质-多糖聚集体的形成,使得表面疏水性降低,此结论与Yuan等[23]提出的亲水胶体含有大量的亲水基团可加强与WGP的相互作用的研究一致。TG酶对WGP和SPI的促交联作用,引起二硫键含量升高、疏水基团暴露,表面疏水性升高。因此,MC的加入使WGP-SPI体系中的表面疏水性下降,TG酶使WGP-SPI-MC体系中的表面疏水性上升。
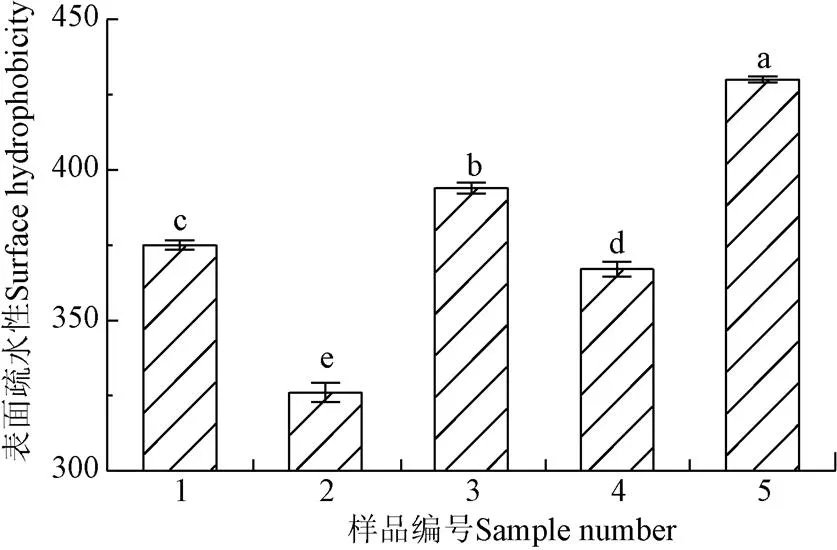
图2 表面疏水性检测结果
2.1.3 SDS-PAGE凝胶电泳分析
WGP主要由麦谷蛋白和麦醇溶蛋白组成:麦谷蛋白亚基组成为高分子量麦谷蛋白(High Molecular Weight Glutenin,HMW-GS)与低分子量麦谷蛋白(Low Molecular Weight Glutenin Subunit,LMW-GS),分子量范围分别为80~130 kDa和10~70 kDa;麦醇溶蛋白亚基组成为四类,其中亚基的分子质量范围接近,约为30~50 kDa,亚基的分子质量范围在45~75 kDa之间[4]。SPI主要由大豆球蛋白(Glycinin,11S)和-伴球蛋白(-conglycinin,7S)组成,其分子量范围分别为14.4~43.0 kDa和43.0~97.4 kDa。其中11S的亚基组成主要分为酸性亚基(AS)、分子量约为38 kDa和碱性亚基(BS)、分子量约为17 kDa,二者通过二硫键连接;7S主要是由(分子量约为67 kDa)、ʹ(分子量约为71 kDa)和(分子量约为50 kDa)三种亚基所组成[24]。
利用QUANTITY-ONE软件对电泳图进行分析。从图3可以看出,与1、2组相比,3、4、5组中HMW-GS组的分子量组分明显增大,亚基组分和LMW-G的较高分子量组分增大,并伴有40 kDa左右的组分出现,其余组分分子量减少或消失,说明SPI与WGP发生交联互作,新组分的分子量大于WGP。而5组的相应变化略小。此结论与Zhang等[25]研究一致。Zhang等将SPI、TG酶依次添加到WGP中发现,SPI的加入使WGP分子量增大,TG酶处理后可使蛋白分子量变小。可见,SPI的加入可扰乱WGP网络结构,并且SPI与WGP相交联的可溶性部分较少,导致部分亚基消失。MC的加入,强化了蛋白之间的交联,使蛋白产生聚集体,部分组分的分子量升高,TG酶则使大聚集体分散成均匀的小聚集体。

注:1-5泳道分别为:SPI、谷朊粉、SPI+谷朊粉、SPI+谷朊粉+MC、SPI+谷朊粉+MC+TG酶;HMW-GS为高分子量麦谷蛋白、LMW-GS为低分子量麦谷蛋白、α、β、γ、ω为麦醇溶蛋白的组成成分;AS为11S中的酸性亚基、BS为11S中的碱性亚基、α、αʹ、β为7S蛋白的组成成分。
2.2 共混黏合体系凝胶特性的测定
2.2.1 流变学特性检测
图4为凝胶样品的频率扫描结果,其中表示储能模量,表述为凝胶的弹性,其值越大,凝胶受力后的复原力越强,同时,越大,凝胶中分子链的缠结点越多,表示损耗模量,通常与凝胶的黏性相关,其值越大,凝胶间越不易流动[26]。如图所示,五组凝胶样品的均大于,说明样品是以弹性为主的凝胶体。其中,1、2组的和值最低,随着SPI、MC、TG酶的依次加入,WGP的和逐渐升高,且5组较4组升高的最为明显,其曲线的趋势呈迅速上升后趋于平缓,即形成更牢固的凝胶网络结构。说明,SPI、MC、TG酶的依次加入增加了凝胶体系中分子链的缠结点,增大凝胶化程度。MC、TG酶的存在增加了和的值,但双蛋白曲线形态并未改变,因此,当凝胶形成时,蛋白仍然在共混体系中占主导地位。SPI的强吸水性和凝胶性增加了双蛋白分子间的缠结点,提高蛋白凝胶的黏性、弹性。MC的增稠作用进一步提高双蛋白凝胶的黏度,且MC与蛋白之间以氢键相连,也可能提高黏度,从而和的值得以提高。此结论与Zhang等[27]提出的亲水胶体对WGP的流变学特性起协同作用的结论一致。TG酶的加入大幅度了提升双蛋白分子间的交联程度。孙乐常等[28]的研究表明TG酶能有效促进蛋白结构中二硫键形成,促进蛋白相互作用,因此和提高,形成凝胶性与稳定性较好的凝胶。与本文的结论一致。

注:样品编号1、2、3、4、5分别表示谷朊粉、SPI、SPI+谷朊粉、SPI+谷朊粉+MC、SPI+谷朊粉+MC+TG酶。
2.2.2 凝胶强度分析
凝胶强度通常用于客观评估蛋白在形成凝胶时聚集和固定水的能力[29]。如图5所示,SPI的凝胶强度高于WGP,且随着SPI、MC、TG酶的依次加入,凝胶强度呈现逐渐升高的趋势,其中,5组达到最大值,混合体系的凝胶强度分别较前一组升高104.14%、24.66%、3.52%。结果表明,SPI、MC、TG酶均可提高WGP的凝胶强度。WGP网络虽然表现为良好的黏度、延展性,弹性,但凝胶性和凝胶强度较低,SPI的热凝胶性、吸水性较强,水合后快速形成胶束填充在面筋网络中,从而提高WGP的凝胶强度。
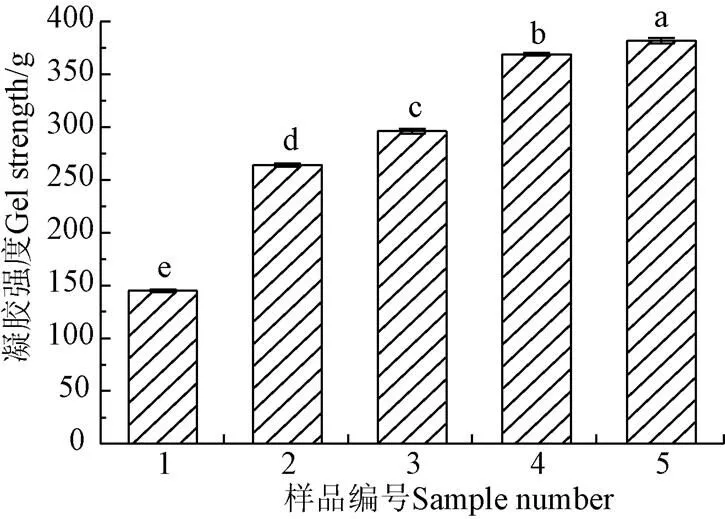
图5 凝胶强度检测结果
MC不仅可通过羟基与蛋白发生相互作用,还可在热凝胶过程中吸收自由水,增大凝胶面,从而形成稳定有序的三维凝胶结构,改善双蛋白凝胶强度。Xin等[30]也得到过类似结论,发现亲水胶体促进蛋白基质之间的连接,从而协同WGP形成更为连续的网络结构,提高WGP的凝胶强度。TG酶的交联作用使共混黏合体系凝胶强度提升,其持水能力增强,王逢秋节等[26]的研究表明在豆腐凝胶中加入TG酶可显著提升豆腐凝胶的保水性及凝胶强度。
2.2.3 持水性分析
持水性可表示凝胶对水的保持能力,它通常用于评估凝胶的质量[31]。如图6所示,SPI的持水性高于WGP,且随着SPI、MC、TG酶的依次加入,持水性呈现逐渐升高的趋势,5组达到最大值,混合体系的持水性分别较前一组升高5.25%、2.91%、2.79%。结合前文结果可知,SPI、MC、TG酶的加入,使WGP凝胶体系中分子链的缠结点增多,凝胶强度增强,从而提高其持水能力。WGP溶于水后形成纤维状凝胶网络,SPI通过共价和非共价作用填充在连续相凝胶网络上形成双蛋白凝胶[7],因SPI吸水性更高,故增强了双蛋白凝胶体系的亲水性,使WGP持水性上升[4]。蛋白凝胶的持水能力受到许多因素的影响,包括水合、疏水相互作用等[32]。MC的吸水性是影响双蛋白凝胶体系持水性的因素。MC的加入可能会在凝胶的过程中吸收凝胶网络中的自由水,从而促进蛋白-蛋白之间的相互作用以形成更为紧密的三维网络。同时,MC的强吸水性可提高共混黏合体系凝胶的水结合能力,这与Wu等[32]探究亲水胶体对鱼糜凝胶作用的研究结果一致。

图6 持水性检测结果
2.3 共混黏合体系凝胶二级结构的测定
蛋白的二级结构是由主链上酰胺基和羰基之间形成的氢键维持的,主要由4种构象组成:螺旋和折叠所代表的有序结构,转角和无规卷曲所代表的无序结构[33]。螺旋结构向折叠结构的转变是蛋白凝胶化的基础,无序结构是蛋白聚集的标志,转角大部分存在分子表面,稳定其邻近的肽段,从而提升凝胶的韧性,蛋白的凝胶特性由蛋白二级结构的相对含量决定[34]。图7a,分析酰胺I带1 600~1 700 cm-1,经过去卷积和拟合,得到二级结构的含量变化见7b。由图7b可知,随着SPI、MC的依次加入,折叠、转角、无规则卷曲比例呈上升趋势,螺旋呈下降趋势,TG酶加入后,螺旋和折叠所代表的有序结构上升,转角、无规则卷曲所代表的无序结构下降。可见,SPI、MC与WGP作用使蛋白二级结构的折叠和无序结构增加,形成蛋白聚集体,促进蛋白凝胶化。TG酶的添加使蛋白二级结构的无序结构向有序结构发生转变,WGP和SPI形成的双蛋白体系稳定性得以提高,其凝胶性进一步增强。这与Tian和Chen等的研究结果一致[35-36]。Tian等将SPI添加到面筋蛋白中发现,SPI通过二硫键和疏水键与面筋蛋白形成大分子凝胶聚合物,导致螺旋含量下降,折叠和无规则卷曲含量增加。Chen等将凝乳聚糖加入到鱼糜蛋白中发现,亲水胶体通过游离羟基与蛋白质结合,促进蛋白凝胶化,使二级结构螺旋向折叠转变。因此,将SPI、MC添加到谷朊粉中,均引起共混体系中折叠含量的增加,即引起蛋白质聚集和凝胶行为。而MC和TG酶介导下的WGP和SPI体系中螺旋和折叠的有序结构上升,使双蛋白体系的稳定性获得提高。

注:样品编号1、2、3、4、5分别表示谷朊粉、SPI、SPI+谷朊粉、SPI+谷朊粉+MC、SPI+谷朊粉+MC+TG酶。
2.4 共混黏合体系对拉丝蛋白粒子的作用
利用SEM进行结构表征可以反映蛋白质交联的程度[31]。如图8所示,当仅含有谷朊粉、SPI、SDP时,图8a可观察到,在三蛋白体系中,WGP是主要网络骨架,SPI交联其上、对WGP网络起支撑作用,形成半网络半填充的新架构形式共同包裹SDP粒子。但蛋白交联网络分布不均、部分间隙过大,对SDP粒子的包裹不完全;加入MC后(图8b),体系中出现丝状结构,使蛋白交联网络密度增大,并变得均匀、孔隙减小,WGP-SPI交联网络呈现出了强有力牵引的丝状立体网络结构,将SDP粒子更紧密的包裹,但仍有部分SDP粒子暴露在表面;再加入TG酶后(图8c),体系表面出现了连续的蛋白膜,蛋白膜与丝状结构相互交织成网状薄膜,使SDP粒子完全包裹在其中。Jun等[37]将大豆蛋白、TG酶依次加入到大麦面团中进行SEM观察时发现,添加TG酶后,WGP与大豆蛋白的双蛋白网络结构变得光滑、致密和连续。这与本文的研究结果一致。因此,SPI、谷朊粉、MC和TG酶相互作用,提高了共混黏合体系的凝胶强度、保水能力,形成更致密、更均匀的凝胶网络,将SDP粒子均匀包裹。
如图9所示,谷朊粉水合后,在二硫键、疏水作用、氢键等作用下形成WGP多聚体网络结构,作为共混黏合体系的骨架[3]。SPI含有大量的亲水基团,经水合加热后,蛋白质分子受热变性,蛋白链展开,同时高温加快蛋白质分子热运动,有助于蛋白质间活性基团的相互交联,冷却后,热动能的降低有助于重新聚集、缔合,形成蛋白凝胶[38]。添加SPI后,SPI形成的胶束结构凝胶,通过二硫键、疏水作用等共价、非共价的形式与WGP结合,镶嵌在WGP网络中,形成半网络半填充的新架构形式;尽管SPI的添加导致面筋网络结构部分解聚,面筋网络孔径增大、二硫键含量下降、表面疏水性升高,但却使其持水性和凝胶强度得以提高。依次添加MC后,MC溶于水后迅速膨胀形成凝胶网络,由于MC的水分竞争导致双蛋白发生失水性聚集促进凝胶,同时,MC可通过氢键和疏水相互作用与蛋白质相结合形成交联网络,MC与蛋白强烈的交互作用阻碍了SPI对WGP网络造成的解聚现象。再添加TG酶后,进一步诱导促进了SPI和WGP氨基酸之间的交联,使骨架网络结构紧密,并局部形成连续膜结构,提高蛋白交联网络的强度、保水能力,形成更致密、更均匀的凝胶网络将SDP粒子完整、紧密包裹。

注:箭头指向SDP粒子。

图9 共混体系的黏合及对SDP粒子的作用机制图
2.5 共混黏合体系对素肉饼品质的影响
从图10和表2可知,随着SPI、MC和TG的依次加入,素肉饼的弹性、硬度、咀嚼性均明显升高,蒸煮损失呈现先上升后下降的趋势。其中,1组素肉饼表面粗糙、孔隙较大;2组素肉饼过于细腻、缺乏肉感;3组素肉饼结构更加紧实,但SDP颗粒分布不均、表面孔洞粗大;4组素肉饼SDP颗粒分布较为均匀,但外观仍有缺口;5组素肉饼外观完整、紧实,表面细腻。因此,谷朊粉、SPI、MC和TG的依次添加,使素肉饼逐渐增加了紧实感,硬度、咀嚼性和弹性等得以提升,而在MC和TG协同作用下,进一步促进了谷朊粉和SPI的交联及与拉丝蛋白颗粒的连接,并提高素肉饼的这些品质特性,而回复性和内聚性没有因这些成分的添加受到影响。此结论部分与陈林等[39]提出的适量添加SPI可提高素肉香肠硬度的结论一致。

注:样品编号1、2、3、4、5分别表示谷朊粉、SPI、SPI+谷朊粉、SPI+谷朊粉+MC、SPI+谷朊粉+MC+TG酶。

表2 质构特性和蒸煮损失检测结果
注:同一列中不同小写字母表示显著性差异(<0.05)。
Note: different lowercase letters in the same column showed significant differences (<0.05).
3 结 论
本研究利用谷朊粉、大豆分离蛋白(Soy Isolated Protein,SPI)、甲基纤维素(Methylcellulose,MC)、谷氨酰胺转氨酶(Glutamine Transaminase,TG酶)的原料特性,依次建立植物蛋白、亲水胶体、促凝胶酶的共混黏合体系,研究发现:
1)随着SPI、MC和TG酶依次递进加入谷朊粉,混合体系中的二硫键呈现先下降后升高的趋势,高分子量麦谷蛋白组分分子量和游离巯基呈现先上升后下降的趋势,表面疏水性呈现先上升再下降再上升的趋势;持水性、凝胶强度、储能模量、损耗模量以及-折叠数值均逐渐上。说明在面筋蛋白(Wheat Gluten Protein,WGP)、SPI、MC和TG酶的贡献下,共混黏合体系凝胶的分子间缠结点增多,蛋白的聚集程度和凝胶强度增加。
2)在WGP和大豆拉丝蛋白(Soy Drawing Protein,SDP)粒子中依次递进加入SPI、MC和TG酶,扫描电镜观察结果显示,在SPI镶嵌WGP形成的半网络半填充新架构基础上,形成大量交联丝状结构,直至局部形成连续膜状结构,将SDP粒子完整、紧密地包裹于谷朊粉、SPI、MC、TG酶共混黏合体系中。
3)将此共混黏合体系应用于素肉饼的制作,谷朊粉、SPI、MC和TG的依次递进添加,使素肉饼的外观及内在品质逐渐改善,硬度、咀嚼性和弹性等得以提升。因此,建立谷朊粉基共混黏合体系是改善SDP为主要原料的素肉制品组织粗糙、肉质感差、易散不成型问题的有效方法。但在实际应用中可根据开发产品的特点,依据共混黏合体系的机理适当调整水的添加比例。
[1] Anqi L, Yining Z, Xiaohui Z, et al. The role of feruloylation of wheat bran arabinoxylan in regulating the heat-evoked polymerization behavior of gluten[J]. Food Hydrocolloids, 2023, 134(1): 108046.
[2] Herbert W, Peter K, Katharina A S. Chemistry of wheat gluten proteins: Qualitative composition[J/OL] Cereal Chemistry. [2022-05-25]. https://doi.org/10.1002/cche.10572.
[3] Sonoo I, Katsuyuki H, Bin X F, et al. Changes in hydrophobic interactions among gluten proteins during dough formation[J]. Processes, 2021, 9(7): 2-16.
[4] Jian H, Ren W, Wei F, et al. Design of novel edible hydrocolloids by structural interplays between wheat gluten proteins and soy protein isolates[J]. Food Hydrocolloids, 2020, 100(5), 214122.
[5] Chen Y, Zhang M, Bhandari B. 3D printing of steak like foods based on textured soybean protein[J]. Foods, 2021, 10(9): 107855.
[6] Maria G F, Costantino F, Salvatore M, et al. Improving the quality of dough obtained with old durum wheat using hydrocolloids[J]. Food Hydrocolloids, 2020, 101(4): 105467.
[7] Azeem M, Mu T H, Zhang M. Effects of hydrocolloids and proteins on dough rheology and in vitro starch digestibility of sweet potato-wheat bread[J]. LWT-Food Science and Technology, 2021, 142: 110970.
[8] Jing H, Zheng L P, Jin X Y, et al. How does soy 7S globulin influence the thermo-responsive fibration process of methylcellulose chains in aqueous solutions[J/OL]. Colloids and Surfaces A Physicochemical and Engineering Aspects. [2022-08-26]. https://doi.org/10.1016/j.colsurfa.2022.130064.
[9] Yuan Y O, Jing J X, Fu Y J, et al. Properties of transglutaminase-induced myofibrillar/wheat gluten gels[J]. Journal of Food Science, 2021, 86(4): 2387-2397.
[10] Tian T, Xiao H T, Kun Y R, et al. Influence of protein ratios on the structure and gel properties of soybean-wheat co-precipitated proteins[J]. LWT - Food Science and Technology, 2022, 170(1): 114045.
[11] 林晗,董诗琴,张贞炜,等. 亲水胶体对大豆、花生双蛋白凝胶持水性的影响及机制探究[J]. 食品科技,2021,46(10):142-148.
Lin Han, Dong Shiqin, Zhang Zhenwei, et al. Effects and mechanism of hydrocolloids in soybean and peanut[J]. Food Science and Technology, 2021, 46(10): 142-148. (in Chinese with English abstract)
[12] 荣荟,汤辉煌,赵娅柔,等. 冷冻诱导对大豆分离蛋白结构和聚集行为的影响[J]. 食品研究与开发,2021,42(3): 8-14.
Rong Hui, Tang Huihuang, Zhao Yarou, et al. Effects of freezing induction on the structure and aggregation behavior of soybean protein isolate[J]. Food Research and Development, 2021, 42(3): 8-14. (in Chinese with English abstract)
[13] 石佳卉,张安琪,陈爽,等. 大豆分离蛋白-维生素D3复合物的结构及性质[J]. 中国食品学报,2022,22(7):49-55.
Shi Jiahui, Zhang Anqi, Chen Shuang, et al. Structure and properties of the soybean isolated protein-vitamin D3complex[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(7): 49-55. (in Chinese with English abstract)
[14] 江连洲,杨宗瑞,任双鹤,等. 空化射流对大豆分离蛋白结构及乳化特性的影响[J]. 农业工程学报,2021,37(3):302-311.
Jiang Lianzhou, Yang Zongrui, Ren Shuanghe, et al. Effect of cavitation jet on the structure and emulsification characteristics of soybean isolated proteins[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(3): 302-311. (in Chinese with English abstract)
[15] 杜洪振,陈倩,杨振,等. 预热处理大豆蛋白对鲤鱼肌原纤维蛋白凝胶和流变学特性的影响[J]. 食品科学,2019,40(12):55-61.
Du Hongzhen, Chen Qian, Yang Zhen, et al. Effect of preheated soy proteins on gelling and rheological properties of common carp myofibrillar protein[J]. Food Science, 2019, 40(12): 55-61. (in Chinese with English abstract)
[16] 朱秀清,杨鑫鑫,万兆祥,等. 响应曲面法氯化钙豆腐冻融工艺优化及其品质评价[J]. 食品工业科技,2021,42(5):159-165.
Zhu Xiuqing, Yang Xinxin, Wan Zhaoxiang, et al. Optimization of freeze-thaw process of calcium chloride tofu by response surface methodology and its quality evaluation[J]. Science and Technology of Food Industry, 2021, 42(5): 159-165. (in Chinese with English abstract)
[17] 李翠芳,张钊,张兆兴,等. 大豆蛋白源配料特性对素肉饼品质的影响[J]. 食品科技,2021,46(1):93-97.
Li Cuifang, Zhang Zhao, Zhang Zhaoxing, et al. Effect of soybean protein source ingredient properties on the quality of vegetarian meat cake[J]. Food Science and Technology, 2021, 46(1): 93-97. (in Chinese with English abstract)
[18] Zhang T, Guan E, Yang Y, et al. Underlying mechanism governing the influence of peanut oil addition on wheat dough viscoelasticity and Chinese steamed bread quality[J]. LWT-Food Science and Technology, 2021, 156(15): 113007.
[19] Tian T, Kunyu R, Xiao H T, et al. Co-precipitates proteins prepared by soy and wheat: Structural characterisation and functional properties[J]. International Journal of Biological Macromolecules, 2022, 212(1): 536-546.
[20] Li J, Wu Y, Ma Y, et al. Effects of addition of hydrocolloids on the textural and structural properties of high-protein intermediate moisture food model systems containing sodium caseinate[J]. Food and Function, 2017, 8(8): 1-8.
[21] Tang S, Li J, Huang G, et al. Predicting protein surface property with its surface hydrophobicity[J]. Protein and Peptide Letters, 2021, 8(28): 938 - 944.
[22] 郑环宇,孔洋,郑丽,等. 大豆蛋白多糖复合物结构与性能及其稳定性研究[J]. 农业机械学报,2022,53(6):406-415.
Zheng Huanyu, Kong Yang, Zheng Li, et al. Study on structure and stability of soybean proteoglycan complex[J]. Transactions of the Chinese Society for Agricultural Machinery, 2022, 53(6): 406-415. (in Chinese with English abstract)
[23] Yuan Y C, Yu T, Qi M W, et al. Carboxymethylcellulose- induced changes in rheological properties and microstructure of wheat gluten proteins under different pH conditions[J]. Journal of Food Science, 86(3): 677-686.
[24] Zhao L M, Li J L, Chang L W, et al. Effects of combined enzymatic and ultrasonic treatments on the structure and gel properties of soybean protein isolate[J]. LWT - Food Science and Technology, 2022, 158(15): 113123.
[25] Zhang Y, Guo X, Shi C, et al. Effect of soy proteins on characteristics of dough and gluten[J]. Food Chemistry, 2020, 318: 126494.
[26] 王逢秋节,杨鑫鑫,谷雪莲,等. 转谷氨酰胺酶-氯化镁协同诱导对冷榨豆粉凝胶的影响[J/OL]. 食品科学.[2022-08-31]. http://hfffg5fce84748f1d4cc2hco5kcqobw6n066xf.fgfy.hlju.cwkeji.cn/kcms/detail/11.2206.ts.20210927.2302.022.html.
Wang Fengqiujie, Yang Xinxin, Gu Xuelian, et al. Effect of synergistic induction of transglutaminase-magnesium chlorine on cold-pressed bean powder gels[J/OL]Food Science. [2022-08-31]. http://hfffg5fce84748f1d4cc2hco5kcqobw6n066xf.fgfy.hlju.cwkeji.cn/kcms/detail/11.2206.ts.20210927.2302.022.html. (in Chinese with English abstract)
[27] Zhang L F,Chen J, Xu F, et al. Effect of tremella fuciformis and different hydrocolloids on the quality characteristics of wheat noodles[J]. Foods, 2022, 11(17): 2617.
[28] 孙乐常,王瑜,翁凌,等. 谷氨酰胺转氨酶对荞麦分离蛋白凝胶特性的影响[J/OL]. 食品工业科技. [2022-06-14]. http://hfffg5fce84748f1d4cc2sco5kcqobw6n066xf.fgfy.hlju.cwkeji.cn/kcms/detail/detail.aspx?FileName=SPKJ20220610003&DbName=CAPJ2022.
Sun Lechang, Wang Yu, Weng Ling, et al. Effect of glutamine aminotransferase on the gel properties of buckwheat separating proteins[J/OL]. Science and Technology of Food Industry. [2022-06-14]. http://hfffg5fce84748f1d4cc2sco5kcqobw6n066xf.fgfy.hlju.cwkeji.cn/kcms/detail/detail.aspx?FileName=SPKJ20220610003 and DbName=CAPJ2022. (in Chinese with English abstract)
[29] Xu C, Molino B Z, Wang X, et al. 3D printing of nanocellulose hydrogel scaffolds with tunable mechanical strength towards wound healing application[J]. Journal of Materials Chemistry B, 2018, 6(43): 7066-7075.
[30] Xin Y S, Fei P, Yong F. The effects of hydrocolloids on the thermomechanical, viscoelastic and microstructural properties of whole wheat flour dough[J]. Food Chemistry, 2022, 370(15): 130976.
[31] Zhong L Z, Zhou Y X, Noman W, et al. Influence of the mixture of carrageenan oligosaccharides and egg white protein on the gelation properties of culter alburnus myofibrillar protein under repeated freezing thawing cycles[J]. 2022, 11(1): 32-32.
[32] Wu C H, Yuan C H, Chen S G, et al. The effect of curdlan on the rheological properties of restructured ribbonfish (spp.) meat gel[J]. Food Chemistry, 2015, 179: 222-231.
[33] Waga J. FT-Raman spectroscopy as a tool to study the secondary structures of wheat gliadin proteins[J]. Molecules, 2021, 26(17): 5388.
[34] Roccia P, Ribotta P D, Pérez GT, et al. Influence of soy protein on rheological properties and water retention capacity of wheat gluten sciencedirect[J]. LWT-Food Science and Technology, 2009, 42(1): 358-362.
[35] Tian T, Kun Y R, Xiao H T. Co-precipitates proteins prepared by soy and wheat: Structural characterisation and functional properties[J]. International Journal of Biological Macromolecules, 2022, 212(1): 536-546.
[36] Chen J, Deng T, Wang C, et al. Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J]. Journal of the Science of Food and Agriculture, 2020, 100(5): 1-9.
[37] Jun C, Zhu Z P, Liu L C, et al. Impact of protein network restructured with soy protein and transglutaminase on the structural and functional characteristics of whole-grain highland barley noodle[J]. Food Hydrocolloids, 2022, 133(12): 107909.
[38] 胡坦,张珮珮,郑婷,等. 高场强超声-加热联用增强大豆分离蛋白冷凝胶凝胶特性[J]. 农业工程学报,2016,32(20):306-314.
Hu Tan, Zhang Peipei, Zheng Ting, et al. High field strength ultrasound-heating combination enhanced soybean separation protein cold gel properties[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(20): 306-314. (in Chinese with English abstract)
[39] 陈林,陈维,Rammile E,等. 油脂预乳化提高大豆拉丝蛋白素食香肠品质[J]. 农业工程学报,2021,37(13):291-298.
Chen Lin, Chen Wei, Rammile E, et al. Pre-emulsification of oil improves the quality of soy brushed protein vegetarian sausage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(13): 291-298. (in Chinese with English abstract)
Construction of gluten based blend adhesive system and its application in vegetable meat pie
Qu Min, Wang Yu, Zhu Xiuqing※, Zhu Ying, Liu Linlin, Huang Yuyang, Lyu Mingshou, Sun Bingyu
(/150028)
Wheat Gluten Protein (WGP) prepared by gluten through hydration build a great and compact network structure, which has great viscoelasticity, extensibility and film formability. However, the structure is easy to break after heating due to low stability and water-holding capacity. In this research, a blended system was established to contain the vegetable protein, hydrophilic colloid, and coagulating gelatinase using the wheat gluten, Soy Isolated Protein (SPI), Methylcellulose (MC), and Glutamine Transaminase (TG). It is vital to investigate the effects and relationship between above components of the physicochemical properties, gel properties and structure in the blended adhesion system. The results showed that the SPI, MC and TG were added step by step to WGP and the disulfide bond content in the mixed system decreased by 81.03%, increased by 248.50% and 0.70%, the free sulfhydryl group content increased by 68.79%, 28.90% and 20.44%. Meanwhile, the surface hydrophobicity increased by 5.07%, decreased by 6.85%, and increased by 17.17%, decreased by molecule weight of glutenin component increased gradually with the gradual addition of WGP into the mixed system. The water holding capacity increased by 5.25%, 2.91%, and 2.79%, and the gel strength increased by 104.14%, 24.66%, and 3.52%. When it comes to the molecular weight, SPI could perturb the WGP network structure, and the less soluble parts of SPI intersect with WGP leading to the disappearance of some subunits.The MC was added to strengthen the cross-linking between proteins, further producing increasing aggregates for the molecular weight, but the TG enzymes dispersed the large aggregates into the uniform small aggregates. During the progressive addition of the three fractions, the tangles of molecular chains in the gel system increased with the degree of gelation, and the storage modulus and loss modulus rise gradually.The TG enzyme was added to prevent the transforming of-helix structure into-turn and irregular coil structure, leading to the increase in the-helix and-sheet content. The intermolecular entanglement points of the gel in the blend bonding system promoted stronger gel property. This showed that the addition of SPI partially destructed the network structure of WGP, but the MC and TG enzymes would promote the aggregation degree and strength of proteingel. The gelstructure wasformed by SPI bind to the WGP covalent, disulfide bonds, and hydrophobic interactions. The MC was added to cause the double protein water loss aggregation through hydrogen bonding. The TG enzyme was further induced to promote the crosslinking between SPI and WGP to make the skeleton network structure closely. The SEM observation indicated that the SPI was embedded in the WGP network skeleton, forming a new architecture as half network and half filling. With the addition of MC and TG enzymes in turn, on the basis of a large number of cross-linked filamentous structures, local continuous membrane structures were formed to cover the particles by Soybean Drawing Protein (SDP).It showed that the SDP particles were completely and tightly wrapped in the gluten SPI-MC-TG enzyme blend adhesive system. The SDPbased meatloaf was made using this bonding system, and four raw materials were added to the rehydrated SDP in turn, which showed that the hardness, cohesion, chewiness, and elasticity of the meatloafwere improved. Therefore, it is an effective way to establish the glutenbased blending adhesive system for better quality meat products, particularly with the SDP as the main raw material.
gels; texture; gluten; soy isolated protein; methylcellulose; glutamine transaminage; mixed adhesive system
10.11975/j.issn.1002-6819.2022.19.031
TS251.93
A
1002-6819(2022)-19-0285-10
曲敏,王宇,朱秀清,等. 谷朊粉基共混黏合体系的构建及在素肉饼中的应用[J]. 农业工程学报,2022,38(19):285-294.doi:10.11975/j.issn.1002-6819.2022.19.031 http://www.tcsae.org
Qu Min, Wang Yu, Zhu Xiuqing, et al. Construction of gluten based blend adhesive system and its application in vegetable meat pie[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(19): 285-294. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.19.031 http://www.tcsae.org
2022-09-01
2022-09-30
黑龙江省“百千万”工程科技重大专项(2021ZX12B04-01)
曲敏,博士,教授,研究方向为粮食化学与农产品加工技术。Email:qumin777@126.com
朱秀清,硕士,教授,研究方向为蛋白质分子化学及大豆深加工。Email:xqzhuwang@163.com

