三种水质调控方式对春秋季刺参池塘水细菌菌群结构的影响
张东升,周 玮
三种水质调控方式对春秋季刺参池塘水细菌菌群结构的影响
张东升1,2,周 玮1※
(1. 大连海洋大学水产与生命学院,大连 116023;2. 大连海洋大学农业农村部北方海水增养殖重点实验室,大连 116023)
通过16SrRNA高通量测序技术,以自然纳潮和微孔曝气两种水质调控方式池塘为对照,研究了养水机水质调控方式对春秋季刺参养殖池塘水细菌菌群结构的影响。结果表明:各池塘水前10优势门和前3优势纲组成基本一致,但优势属组成差异较大;试验后期(11月份),养水机池塘水与自然纳潮池塘水和微孔曝气池塘水中某些种群丰度具有明显的差异,养水机显著提高了池塘水乳酸菌目的丰度(lefse分析LDA Score>4),分别提高了251和343倍,显著降低了交替假单胞菌科和属的丰度(-test检验),各池塘水优势功能菌为化能异养菌12.78%~19.65%和好氧化能异养菌0.96%~4.97%,各功能菌丰度均值差异不显著,但试验后期养水机池塘水发酵菌和植物致病菌丰度增加明显,比自然纳潮池塘和微孔曝气池塘分别提高了32、50和159、216倍;硝酸盐还原菌丰度降低明显,养水机池塘水-多样性最高,养水机显著提高了池塘水乳酸菌和植物致病菌丰度,提高了细菌种群的-多样性,前者抑制池塘大型藻生长,后者有益于水质稳定。
水产养殖;群落组成;水质调控;养水机;功能菌;FAPRTAX;刺参池塘
0 引 言
细菌菌群组成和功能特点与环境息息相关,不同环境其细菌菌群组成和功能特点不同[1],因此测定环境中细菌菌群组成和功能特点,不仅能指示环境好坏及环境物质组成,也能为矫正环境提供理论和技术指导[2],因此人们在改善池塘、湖泊、河流生态时,往往测定水质或沉积物中的细菌菌群组成和功能特点以及他们与环境中物理化学及生物参数的关系[3-9],以期了解不同水质改良技术对细菌菌群、物理化学参数的影响,探讨细菌菌群与环境因子的关系,为以后的水质调控提供技术指导。
近30年辽宁、山东地区刺参养殖发展迅速,而随着养殖时间的延长,刺参疾病频发,主要原因在于池塘环境不佳,池塘底部沉积大量有机物,且在2、6月份池塘形成的温盐跃层[10-11],加据了池塘环境恶化,导致刺参疾病甚至死亡,降低了渔民收入,因此,刺参池塘水质调控势在必行[10]。
为了解引起刺参疾病的主要细菌种群,不少科研工作者对刺参养殖池塘细菌菌群进行了研究[12-14],为预防刺参疾病提供技术支撑,然而水质调控对刺参池塘微生物菌群和功能的影响报道较少。目前刺参养殖池塘的主要水质物理调控方式为自然纳潮和微孔曝气,前者为刺参养殖池塘普遍采用的一种方式,后者是部分池塘采用的方式,后者在改良水质方面比前者有优势,但其设备通气孔易堵塞,难以清理,费用较高,同时2种水质调控方式池塘均存在水体分层和大型藻生长旺盛现象,尤其夏、秋季,池塘生长的大型藻缠绕刺参,致其死亡;大型藻在秋季死亡后,严重污染池塘,为更好地解决上述问题,本课题组研制了一种新型水质改良机-养水机,为探讨养水机对池塘水质改良效果,王祖峰[10]报道了养水机对池塘水体分层及水质的影响,孙广伟等[11]报道了养水机对池塘生产力的影响,均表明养水机对池塘2、6月份的池塘水分层具有明显的消除作用;林青、张东升等[15-16]报道了养水机对池塘浮游植物和水化指标及异养菌丰度的影响。本文报道了养水机对刺参池塘水细菌菌群、功能和水质的影响,不仅为养水机对刺参池塘水质调控机理提供技术支撑,同时探讨了细菌种群变化与水质的关系,为不同细菌种群的主要功能提供基础数据,也为是否可用细菌菌群变化预示调控效果奠定技术基础。
1 材料与方法
1.1 养水机结构和使用原理
养水机是一种针对刺参生长特点、能打破池塘水体温、盐跃层的新型水质调控设备(图1),该设备主要分为进水组件、生物包、水循环动力装置和水输出喷头4部分,其中生物包直径1 m、高度0.3 m,内含生物滤料(活性炭),进水组件和微生物添加管随池水的高度变化而变化。该设备结合物理和生物水质调控技术,在实际应用中表现出肥水、抑草、活水、节能等多方面优点[7-10]。养水机在工作时通过位于生物包内的动力装置和进水组件抽取表层溶氧丰富的水,进入生物包进行过滤,然后由位于生物包外面的出水喷头将水朝向与养水机位置相对的池塘方向喷射出去,实现池塘水在垂直方向快速交换,打破温、盐跃层造成池塘底部缺氧问题。

图1 养水机结构示意图
1.2 试验池塘及刺参养殖管理
本试验在大连庄河宝发海珍品有限公司刺参养殖池塘进行,所选池塘长约600 m,宽85 m,水深1.2~2.0 m,选择9口大小、形状一致的相邻池塘进行试验,3口安装了养水机的池塘作为试验组,其余6口池塘均为对照组,其中3口为微孔曝气对照组,3口为自然纳潮对照组,上述各池塘已运转了2 a。
养水机试验组,在池塘最深处放置一台功率为750 W的养水机,3-11月份每日21:00-次日9:00工作,连续工作12 h(共消耗9 kW·h),冬季(12、1、2月)工作1 h;微孔曝气对照组,在池塘底部铺设1套微孔曝气系统,由空压机(1.5 kW·h/m2,每天用电量至少15.2 kW·h)、总供气管和微孔曝气盘组成,池塘缺氧时,开始工作)这是微孔曝气装置标准使用方法);自然纳潮对照组,除了与养水机试验组和微孔曝气对照组在每月大潮期间同时更换池塘水外,无其他调水装置。试验期间,各池塘放养的刺参规格(2.5 g/个)、密度(15个/m2)相同,不投饵、不投药,统一管理(包括所有池塘均使用微生态制剂的时间和剂量等)。
试验周期为9个月,试验开始时间是从每年的3月开始,至当年的11月结束,投苗时间分别为春季和秋季。
1.3 试验方法
1.3.1 水样采集
2017年,每月于大潮前3~5d的上午采集水样1次,采用5L颠倒式采水器采集各池塘进水口、出水口、中心位点的表层(距水面约5cm)、中层、底层水(距池底约5cm),然后各点各层水样在现场等量混合后带回实验室。
1.3.2 池塘水理化指标测定
各个采样点,使用YSI多参数水质分析仪(Pro Plus,美国)即时测定水的各层水温、盐度、溶解氧。将采回的混合水样,立即采用GB/T 12763.4−2007中的次溴酸盐氧化法、萘乙二胺分光光度法、锌隔还原法、磷钼蓝分光光度法、过硫酸钾氧化法测定总铵氮(Total Ammonia Nitrogen,TAN)、亚硝酸态氮(NO2--N)、硝酸态氮(NO3--N)、活性磷酸盐(PO43--P)、总磷(Total Phosphorus,TP)和总氮(Total Nitrogen,TN)含量[17]。
悬浮物的测定采用GB/T 11901-1989标准中[18]的重量法,叶绿素的测定采用HJ-897-2017标准[19]中的分光光度法。
1.3.3 水样中细菌菌群及功能菌的测定
除前言中表明的目的以外,为了解养水机对刺参生长期菌群的影响,本次试验仅测定了刺参生长期3、5、11月份的细菌菌群结构,将1.3.1中采集的水样,用0.22m无菌醋酸纤维滤膜过滤,滤膜装入无菌自封袋中,养水机、自然纳潮、微孔曝气3个刺参池塘水样分别标记为Wn、Wt、Ws,采样的月份用罗马数字表示,然后立即放入−80 ℃液氮中冷冻1 h后,用干冰冷冻运送至北京诺禾致源科技股份有限公司,该公司采用Illumina NovaSeq 16SrRNA高通量测序技术,测定细菌的V3-V4区,根据所扩增的16S区域特点,构建小片段文库,基于Illumina NovaSeq 测序平台对该文库进行双末端测序(Paired_End)。经过Reads拼接过滤,OTUs(Operational Taxonomic Units)聚类,进行物种注释及丰度分析;通过-和-多样性分析,揭示出样本中物种组成和样本间群落结构的差异;采用PAPROTAK和PICRUSt软件对细菌功能进行预测,通过wilcox和-test对不同池塘同一功能菌进行显著性检验。
2 结 果
2.1 水质调控方式对池塘水质的影响
池塘水理化参数见表1,水温变化在−3.0~27.9 ℃之间,8月份最高,12月份最低;溶氧变化在0.3~13.9 mg/L之间,12、1-3月最高,7月最低;盐度变化在29.9‰~36.3‰之间,1-3月份最高,8月份最低;铵态氮、亚硝酸、硝酸盐含量分别变化在0.1~0.56、0.005~0.023、0.19~0.65 mg/L之间,最高均出现在9月份,最低分别出现在2、4、6月份;PO43--P含量变化在0.018~0.048 mg/L之间,最高出现在9月份,最低出现在1月份,TN变化在0.540~1.878 mg/L之间,最高值出现在8-10月份,最低值出现在1月份;TP变化在0.022~0.330 mg/L之间,最高值出现在7-9月份;悬浮物变化在4.318~20.938 mg/L间,最高值出现在2-4月和10月份;叶绿素变化在0.019~2.009 mg/L之间,最高值出现在10或11月,上述理化因子中无机氮均是养水机池塘年均值较低,而溶氧、磷酸盐、TN、TP、叶绿素、悬浮物年均值均是养水机池塘较高,其中养水机池塘溶氧年均值显著高于自然纳潮池塘(<0.05),与微孔曝气池塘无显著差异,叶绿素年均值显著高于自然纳潮和微孔曝气池塘(<0.05)。
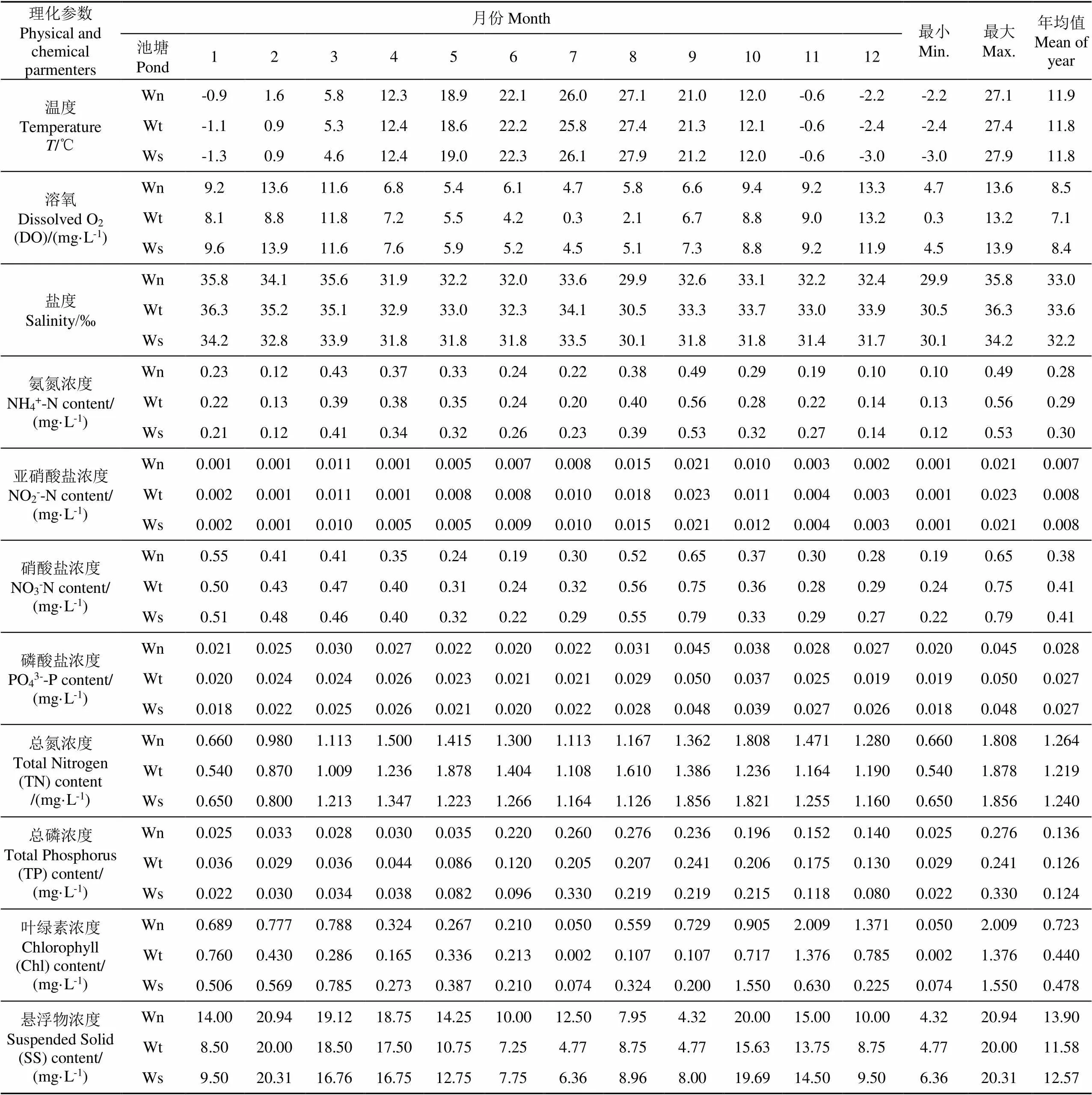
表1 池塘水物理化学参数
注:Wn、Wt、Ws分别表示养水机、自然纳潮、微孔曝气池塘水样。下同。
Note: Wn, Wt and Ws respectively represent the water samples of the pond with Jet Water Mixer (JWM), water exchange by spring tides (WEST), submerged aerator (SA). The same below.
2.2 养水机对池塘水细菌菌群α、β多样性及结构的影响
本研究对所获序列片段,经拼接、质控和去除嵌合体后共得到681 429条有效克隆序列,样品文库覆盖率均大于0.98,说明本试验数据准确且有说服力,所获序列以97%的相似度聚类后共获得19 334个操作分类单元(OTUs)。池塘水细菌菌群-多样性指数见(图2a、b、c、d),可见,养水机池塘水在各时段菌群丰富度(Observed species, Shao1, ACE)、多样性指数和均匀度(Shannon, simpson)均最高,而微孔曝气池塘水菌群丰富度均最低,但经过Tukey和wilcox检验,3组之间-多样性差异不显著。-多样性的PCoA分析和基于Amova unweighted unifrac检验分析,养水机池塘与对照池塘水细菌菌群结构总体差异不显著(图2e),但相似度(Similarity)也不高,仅在8.77%~9.37%之间,这种菌群结构相似度不高、区别性又不显著(>0.05)的现象是月份不同和水质处理方式不同协同作用的结果,既水质调控方式对试验前期(3, 5月份)同一月份各池塘水菌群结构影响较小,对试验后期(11月份)菌群结构影响较大的结果。经spearman分析,影响养水机池塘水与对照池塘水-多样性差异的主要环境因子为NH4+-N、NO2--N、NO3--N含量,它们均与-多样性指数呈负相关(表2),即水质越差,-多样性指数越低。

注:Wn3、Wn5、Wn11分别代表3、5、11月份的养水机池塘,Wt3、Wt5、Wt11分别代表3、5、11月份的自然纳潮池塘,Ws3、Ws5、Ws11分别代表3、5、11月份的微孔曝气池塘,下同。

表2 菌群α-多样性与环境因子的相关性
2.3 养水机对池塘水优势菌群组成的影响
养水机池塘水前10优势门和前3优势纲组成基本与对照池塘水一致,前10优势门(图3a),分别为变形菌门、拟杆菌门、疣微菌门、放线菌门、厚壁菌门、浮霉菌门、酸杆菌门a、绿弯菌门、蓝细菌门、芽单胞菌门,除11月份养水机池塘水以变形菌门和厚壁菌门为前2优势门外,其余时间各池塘水前2优势门均为变形菌门和拟杆菌门,丰度极显著高于其它门(<0.05),除11月份养水机池塘水前3优势纲为-变形杆菌纲、-变形菌纲和杆菌纲外,其余各时间各池塘水前3优势纲均为-变形杆菌纲、-变形菌纲和黄杆菌纲,但各纲排序不同(图3b),可见,11月份养水机池塘水与对照池塘水在门和纲水平上出现了差异。
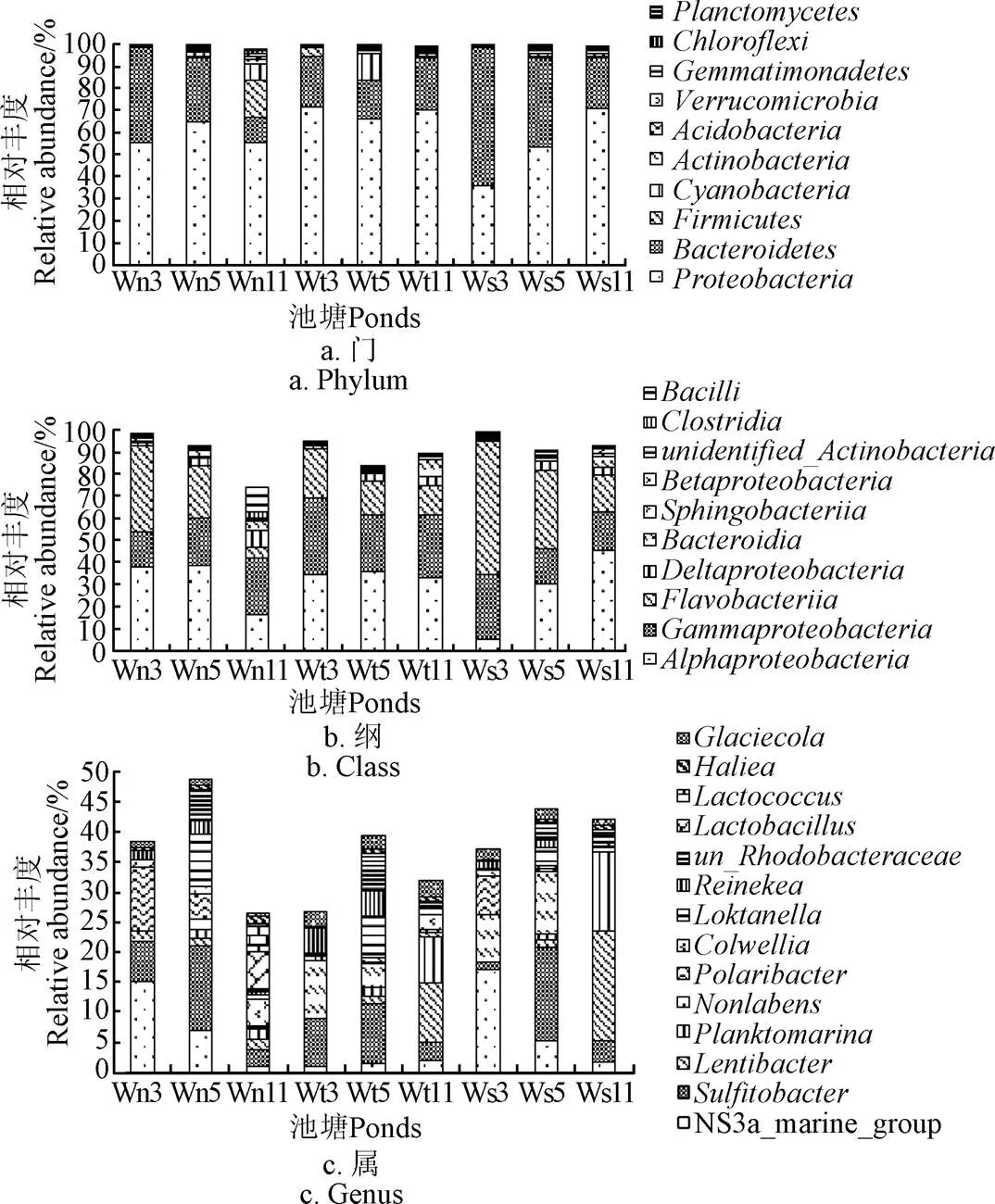
图3 在门、纲、属水平上的优势菌群组成
养水机池塘水与对照池塘水丰度超过1%的优势属组成差异较大(图3c),丰度超过3%的优势属养水机池塘有亚硫酸杆菌属、NS3a_marine_group、极地杆菌属、4属,自然纳潮池塘有亚硫酸杆菌属、、、4属,微孔曝气池塘有、NS3a_marine_group、亚硫酸杆菌属、、5属,可见对照微孔曝气池塘和自然纳潮池塘优势属组成相近,而与养水机池塘有一定的差异,值得关注的是各池塘均含有亚硫酸杆菌属。在测定期间,自然纳潮池塘水除了蓝藻在5月份增量较多以外,变形菌门和拟杆菌门的丰度变化不大,而养水机池塘和微孔曝气池塘水拟杆菌门均呈下降趋势,养水机池塘水除了变形菌门变化不大以外,其他菌门均呈明显升高,尤其是厚壁菌门和蓝藻门,而微孔曝气池塘变形菌门呈增加趋势,其它门变化不明显,说明养水机和微孔曝气对池塘水的菌群影响既有相同之处,也有不同之处。
总体来说,水质调控方式对池塘水分类层级越高的优势菌群组成影响越小,对分类层级越低的菌群组成影响越大,试验后期(11月份)影响较试验前期(3、5月份)大。
2.4 各池塘水丰度差异显著的种群
通过T-test检验,养水机池塘水与对照池塘水细菌菌群在门、纲、目分类层次上无显著差异,但在某些科和属的丰度上有显著差异,养水机池塘水交替假单胞菌科见图4a)和属(见图4b)的丰度显著低于对照自然纳潮池塘水的丰度,与对照微孔曝气池塘水无显著差异,的丰度均值分别为1.2%、2.8%、1.53%,属的丰度均值分别为0.87%、2.47%、1.42%。再通过lefse(LDA Effect Size)差异性检验可知(图4c),养水机池塘水与对照池塘水只有厚壁菌门-杆菌纲-乳酸菌目丰度具有生物统计学Biomarker意义,其中养水机池塘水和自然纳潮池塘水及微孔曝气池塘水中的丰度均值分别为5.98%、1.48%、0.52%,丰度均值分别为4.01%、0.26%、0.17%,均值分别是3.720%、0.048%、0.039%,其LDA值超过4.0,这主要得益于养水机不断促进生长的结果,运转到后期(11月份),仨池塘该目丰度分别达到11.02%、0.04%、0.03%,说明养水机显著促进了该种群细菌的生长。
2.5 引起各池塘水菌群结构差异的主要种群
通过Simper(Similarity percentage)分析(见图5),引起各池塘水菌群结构差异的门,按照从大到小排序分别是拟杆菌门、变形菌门、蓝细菌门和厚壁菌门,可见拟杆菌门对水质反应比变形菌门敏感,引起各池塘水菌群结构差异的属是各池塘前优势属(除亚硫酸杆菌属外),再加上科尔韦尔氏菌属和属,可见引起各池塘水菌群结构差异的主要类群为各池塘优势种群。

图4 水中细菌菌群显著差异科和属及目

图5 引起池塘之间菌群结构差异的细菌门和细菌属
2.6 影响各池塘水菌群结构差异的环境因子
通过spearman和CCA_envifie中的OUT分析可见,引起池塘水多数门丰度和菌群结构差异的水质指标是水中的总磷TP(=0.003)、NH4+-N(=0.005)、NO2--N(=0.008)(见表3),如影响拟杆菌门丰度的环境因子是NH4+-N、NO2--N和总磷TP,与NH4+-N、NO2--N浓度成正相关,与总磷TP浓度成负相关,影响厚壁菌门丰度的环境因子是PO43--P和O2,该门丰度与2环境因子呈正相关,值得注意的是影响池塘水丰度最高的变形菌门的环境因子却是盐度,两者呈正相关,而与营养盐无关。影响池塘菌群结构差异的环境因子也是总磷TP(=0.003)、NH4+-N(=0.005)、NO2--N(=0.008)浓度(见图6)。
2.7 养水机对池塘水功能菌的影响
采用FAPROTAX、PICRUS软件预测了池塘各功能菌丰度,经FAPROTAX预测菌群功能的t-test和wilcox检验分析,养水机与对照池塘相比,各功能菌丰度均无显著差异,池塘水FAPROTAX检验的优势功能菌依次为:化能异养、好氧化能异养、硫氧化、硫呼吸、硝酸盐还原、发酵和植物病原菌(图7a),各功能菌丰度分别变化在12.78%~19.65%、0.96%~4.97%、0.37%~2.74%、0.05%~11.40%、0.18%~8.07%之间,其他功能菌丰度低于1%;与细菌菌群结构变化类似,试验前期(3,5月),各池塘同一优势功能菌丰度差异较小,试验后期(11月),有些功能菌丰度差异较大(图7b),其中养水机池塘水较对照自然纳潮和微孔曝气池塘水发酵菌丰度(分别为9.658%、0.300%、0.190%)、植物致病菌丰度(分别为3.676%、0.023%、0.017%)有较大的提高(图7a),硝酸盐还原菌丰度(分别为1.563%、7.378%、12.104%)有较大的降低。

表3 影响细菌门丰度与水质的相关性
注:*为显著(<0.05),**为极显著(<0.01)。
Note: * is significant (<0.05), ** is extremely significant (<0.01).

图6 菌群结构与水质指标的关系
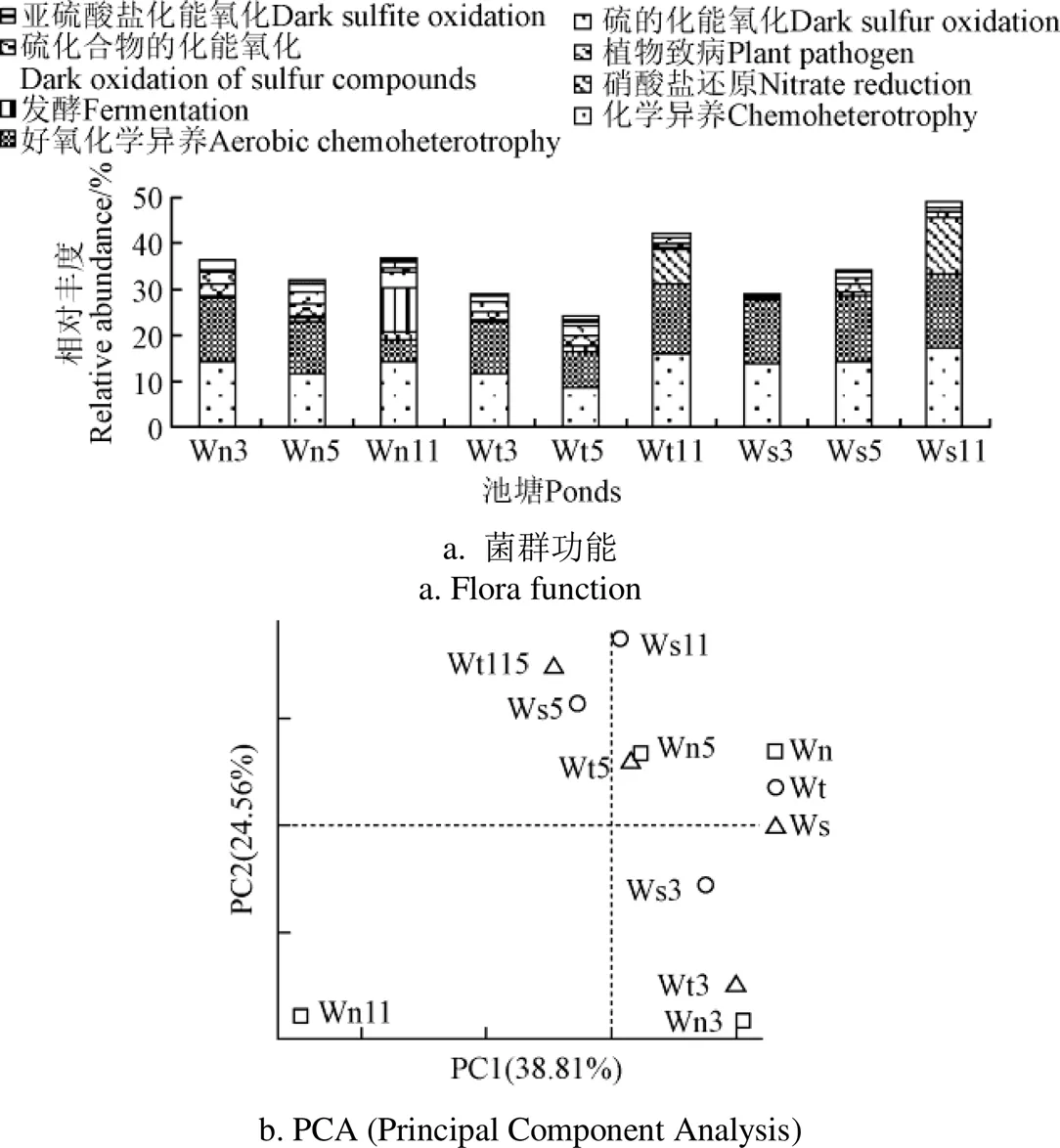
图7 FAPROTAX检验的池塘优势功能菌的相对丰度及PCA分析
经过PICRUS软件分析(图8),各池塘主要功能菌依次为代谢、遗传信息处理、环境信息处理、细胞过程,其丰度依次变化在50.97%~52.48%、14.43%~17.24%、10.51%~14.24%、3.31%~3.75%之间,其中在Level 1水平上2对照池塘中的代谢和细胞过程存在显著差异(<0.05),而养水机与对照池塘菌群功能并无显著差异。在代谢Level 2水平上,养水机池塘和对照微孔曝气池塘除了外源物质生物降解和代谢丰度低于自然纳潮池塘以外,其他代谢功能均高于自然纳潮池塘,而养水机池塘以碳水化合物、能量代谢、外源性物质生物降解和代谢为主要代谢类型,对照微孔曝气池塘以氨基酸代谢、辅助因子和维生素代谢、脂质代谢、核苷酸代谢为主,其中氨基酸代谢在2池塘中(<0.05)值显著,而(>0.05)值不显著,可见不同水质调控方式池塘水主要代谢类型是不同的。

各池塘植物致病菌丰度与优势属关系不同(表4),养水机池塘植物致病菌丰度与科尔韦尔氏菌属、乳球菌属、乳杆菌属三属丰度呈显著正相关,微孔曝气池塘与NS3a-marine- group呈显著正相关,但三种水质调控方式池塘植物致病菌均与NO3--N含量呈正相关,说明驱动池塘植物致病菌丰度的主要因素是水中的NO3--N含量。

表4 植物致病菌与水中优势属和水质的相关性
3 讨 论
3.1 养水机对刺参池塘水质的影响
养水机对刺参池塘水质的影响与前一年测定结果类似[12],说明养水机对池塘水质的影响是比较稳定的。
3.2 刺参养殖池塘水细菌优势类群特点
刺参养殖池塘细菌前10优势门的组成与文献报道基本一致,这可能与养殖对象均为刺参有关[4,12-14,20-21],自然纳潮刺参养殖池塘水第1优势门和优势纲分别为变形菌门和-变形杆菌纲,均与文献报道一致[4,12-14,20-21],这可能与变形菌门为自然界中第1大菌门有关,变形菌门包括各种生态位细菌,因此不同环境条件的改变,可能对其排位影响不大,而第2优势门和优势纲与文献报道存在差异,本试验池塘中的第2优势门与长海、乳山刺参池塘一致[4,12]均为拟杆菌门(均为黄海水域池塘),而渤海海域刺参池塘均为放线菌门[4],本文刺参池塘第2优势纲为-变形菌纲,与长海池塘一致,但与营口和乳山刺参池塘分别为黄杆菌纲和放线菌纲不同,可见相同海域距离较近池塘第2优势门和第2优势纲相同,不同海域或相同海域距离较远,第2优势门和优势纲差异较大,说明刺参池塘水第2优势门和优势纲类别既受不同海域影响,也受相同海域距离远近的影响;而不同海域或距离相近的同一海域对池塘水的第3优势菌门和优势纲影响更大,这可能与第3优势门及优势纲菌群包含的细菌种类少,受环境条件影响更大有关。而不同海域对优势属组成影响更大[4],属级位于分类层级较低的位置,包含菌种数量少、生态位较窄,受环境影响其丰度变化差异更大,但不同海域刺参池塘中均出现了极地杆菌属、亚硫酸杆菌属、、4属[4],其丰度均超过了1%,而该四属中的某些种是某些藻类的伴随者,某些种却是柴油降解菌[22-23],这可能与刺参池塘里某些藻较多和柴油较多有关。
3.3 水质调控方式对池塘水优势细菌类群丰度的影响
养水机对池塘水优势细菌类群组成的影响显示对分类层级越高影响越小,对分类层级越低影响越大的特点,这与王飞鹏等[7]的结果一致,其原因与分类层级越高生态位越多,分类层级越低生态位越小有关。
尽管在门、纲水平上,各池塘各优势门、纲丰度差异不显著,但与自然纳潮对照池塘相比,养水机池塘水和微孔曝气池塘水变形菌门丰度降低了,拟杆菌门丰度升高了,说明养水机和微孔曝气装置对池塘水细菌菌群的调节有一定的相似性,这可能与养水机和微孔曝气装置都能提供池塘氧气有关,但养水机对池塘细菌菌群的作用也有其特殊性,养水机对厚壁菌门丰度影响比对变形菌门和拟杆菌门丰度影响更大,养水机池塘厚壁菌门丰度分别是自然纳潮和微孔曝气对照池塘的4和11.5倍,分别是对照池塘的15.4和23.4倍,乳杆菌目丰度分别是对照池塘的77.6、95.6倍,且该目丰度在养水机池塘与对照池塘之间具有显著差异,而该目在养水机池塘主要以乳杆菌属和乳球菌属为主,说明养水机的转运具有富集乳酸杆菌和乳酸球菌的作用,该属细菌兼性厌氧,通常被用作益生菌使用,理论上,该属的增多对改善水质、加快池塘有机物的降解有益,但养水机池塘该属大量繁殖其机理需进一步研究。
与自然纳潮对照池塘相比,养水机显著降低了交替单胞菌科科和居水菌属属丰度,这2组细菌基因组较大,适合环境变动较大和具有较多大型褐藻、甲壳等复杂高分子糖类环境里生长[24-25],说明养水机池塘大型藻类较少、环境相对稳定,而对照池塘大型藻类较高、水质参数波动较大,这与实际情况相符[16],可见,池塘细菌丰度差异反应了池塘环境条件。
除上述具有显著差异的菌科和菌属以外,养水机池塘前优势属与对照池塘差异也较大,养水机池塘以藻类分泌物为营养的优势菌丰度较高,如NS3a marine group[26-27]和极地杆菌属[28],而以大型藻类分泌物为营养属细菌[29]丰度较低,比对照组低了3.7~6.5倍,除此以外,属的细菌也比对照组低了4.2~5.5倍,这都与养水机池塘浮游藻类丰度高,尤其是硅藻高,而大型藻类丰度低是一致的,而优势亚硫酸杆菌属细菌在养水机和对照池塘丰度差异极小,这可能与该属能利用的机质物较复杂有关[30]。
3.4 养水机对池塘水菌群多样性的影响
养水机池塘水细菌-菌群多样性和均一性最高,而对照微孔曝气池塘仅在5月份细菌多样性和均一性高于对照自然纳潮池塘,其余时间均最低,细菌多样性和均一性高,对稳定水质、不易受外界环境干扰具有重要作用[31-33],说明养水机池塘水质状况良好[34]、且稳定,这有利于刺参的养殖。
3.5 细菌菌群丰度与环境因子的关系
根据细菌系统发生将细菌分成不同的类群,在高层次类群中,如门,其成员生态位复杂,某门丰度很难与某一环境因子有直接的关联,但也有些门丰度与某些环境有密切的关联,而被用来作为指示生物,如拟杆菌门的丰度可以用来指示土壤的利用情况[35],因此,人们希望利用某类群丰度变化预警某一环境变化,以便能及早矫正不良环境,但是,因为环境条件的复杂性和细菌生态位的多样性,至今尚无某门与某环境因子在各种环境条件下的统一关系,如有些报道变形菌门喜欢生活在低溶氧、有机物丰富的水域[7-8],但也有研究表明,变形菌门与水溶氧呈正相关[20],Ji等[36]报道变形菌门可以生活在各种溶氧条件下,本文并没有观测到变形菌门Proteobacteria丰度与溶氧的关系,而是与池塘盐度呈正相关;拟杆菌门Bacteroidetes主要用来降解生物圈中复杂有机物,尤其喜欢降解海洋中的多糖和碳氢化合物[35],其丰度与pH值呈负相关[35,37-38],与PO43--P含量呈正相关[38-39],本文显示拟杆菌门与TP呈负相关,与NH4+-N、NO2--N呈正相关,可见在不同生态环境里,影响优势门的外界环境条件不一,但影响拟杆菌门丰度的环境因子均与营养盐N和P有关,有些文献报道拟杆菌门对外界环境条件敏感[35],可以作为环境的指示生物,本文也证实了这点,其丰度如何与水质关联,尚需大量的试验。本文测定厚壁菌门杆菌纲Bacilli与O2具有正相关,这与该门的生理特点相符,希望本文对变形菌门、拟杆菌门、厚壁菌门与水质的关系,为今后三门的生态研究有所帮助。
3.6 养水机对池塘水细菌菌群功能的影响
目前,有关刺参养殖池塘细菌功能的文献较少[39],且采用的方法与本文不同,难以进行比较。本试验表明,水质调控方式影响了刺参池塘细菌功能菌的丰度,但通过FAPROTAX和PICRUS level1检测的功能菌丰度差异不显著,这可能与各池塘在冬季几乎不运转,导致3、5月差异较小所致,但到11月份各水质调控方式下各池塘功能菌有较明显的差异,特别是养水机池塘有利于抑制大型植物病害菌的生长,这有利于避免大型藻类过度生长,有利于刺参生长和避免过多有机物的积累提供了生物基础。比自然纳潮池塘和微孔曝气池塘分别提高了32、50和159、216倍;硝酸盐还原菌丰度明显降低。
4 结 论
1)不同水质调控方式对分类层级高的优势类群组成影响较小,对分类层级低的优势类群影响较大。
2)NS3a_marine_group、极地杆菌属两属菌可作为刺参池塘水质较好的指示菌。
3)养水机提高了池塘水菌群-多样性、厚壁菌门丰度和植物致病菌丰度,这导致了养水机池塘水质稳定、有机质少,植物生长缓慢,有利于刺参池塘水质和刺参生长。
[1] 贾鹏丽,冯海艳,李淼. 东北黑土区不同土地利用方式下农田土壤微生物多样性[J]. 农业工程学报,2020,36(20):171-178.
Jia Pengli, Feng Haiyan, Li Miao, et al. Soil microbial diversity of black soil under different land use patterns in northeast China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(20): 171-178. (in Chinese with English abstract)
[2] 胡愈炘,张静,黄杰,等. 长江流域河流和湖库的浮游细菌群落差异[J]. 环境科学,2022,43(3):1414-1423.
Hu Yuxin, Zhang Jing, Huang Jie, et al. Characteristics of bacterioplankton community between river and lake/reservoir in the yangtze river basin[J]. Environmental Science, 2022, 43(3): 1414-1423. (in Chinese with English abstract)
[3] 黄志涛,宋协法,李勋,等. 基于高通量测序的石斑鱼循环水养殖生物滤池微生物群落分析[J]. 农业工程学报,2016,32(增刊1):242-247.
Huang Zhitao, Song Xiefa, Li Xun, et al. Analysis of microbial diversity of submerged biofilters in recirculating aquaculture system (RAS) for grouper () based on high-throughput DNA sequencing[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(Supp.1): 242-247. (in Chinese with English abstract)
[4] Xu H C, Wang L, Bao X Y, et al. Microbial communities in sea cucumber () culture pond and the effects of environmental factors[J]. Aquaculture Research, 2019: 1-12.
[5] Arroyo P, Sáenz de Miera L E, Ansola G. Influence of environmental variables on the structure and composition of soil bacterial communities in natural and constructed wetlands[J]. Science of the Total Environment, 2015, 506-507: 380-390.
[6] Lew S, Glińska-Lewczuk K, Burandt P, et al. Impact of environmental factors on bacterial communities in floodplain lakes differed by hydrological connectivity[J]. Limnologica- Ecology and Management of Inland Waters, 2016, 58: 20-29.
[7] 王飞鹏,黄亚玲,张瑞瑞,等.不同曝气方式对人工湿地细菌多样性、代谢活性及功能的影响[J]. 环境科学,2022,43(4):2007-20017
Wang Feipeng, Huang Yaling, Zhang Ruirui, et al. Effects of different aeration treatments on bacterial diversity, metabolic activity, and function in constructed wetlands[J]. Environmental Science, 2022, 43(4): 2007-2017. (in Chinese with English abstract)
[8] 杨霄.分层型水库水细菌群落演变机制与扬水曝气强化作用研究[D]. 西安:西安建筑科技大学,2016.
Yang Xiao. Study on the Evolvement Mechanism of Aquatic Bacteria Community and its Enhanced Effect by Water-Liftling Aerator in Stratified Resovirs[D]. Xi'an: Xi'an University of Architecture and Technology, 2016. (in Chinese with English abstract)
[9] 刘俊,张世文,宋桂芳,等. 复垦土壤细菌群落结构及其与土壤肥力的关系[J]. 农业工程学报,2021,37(21):124-133.
Liu Jun, Zhang Shiwen, Song Guifang, et al. Bacterial community structure of reclaimed soil and its relationship with soil fertility[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(21): 124-133. (in Chinese with English abstract)
[10] 王祖峰. 仿刺参养殖池塘三种水质控制技术效果的比较[D]. 大连:大连海洋大学,2016.
Wang Zufeng. A Comparative Study of Three Water Quality Controlling Technologies Effected in Apostichopus Japonicus[D]. Dalian: Dalian Ocean University, 2016. (in Chinese with English abstract)
[11] 孙广伟,周玮,党子乔,等. 3种水质调控方式下刺参池塘初级生产力的周年变化[J]. 水产学报,2020,44(4):632-641.
Sun Guangwei, Zhou Wei, Dang Ziqiao, et al. Annual change of primary productivity inponds by three water quality regulations[J]. Journal of Fisheries of China, 2020, 44(4): 632-641. (in Chinese with English abstract)
[12] Zhao Z, Jiang J, Pan Y, et al. Temporal dynamics of bacterial communities in the water and sediments of sea cucumber () culture ponds[J]. Aquaculture, 2020, 528: 1-12.
[13] Gao F, Li F, Tan J, et al. Bacterial community composition in the gut content and ambient sediment of sea cucumberrevealed by 16S rRNA gene Pyro sequencing[J]. Plos One, 2014, 9(6): 1-10.
[14] Lv X, Yu P, Mao W, et al. Vertical variations in bacterial community composition and environmental factors in the culture pond sediment of sea cucumber[J]. Journal of Coastal Research, 2018, 84: 69-76.
[15] 林青,张东升,魏亚南,等. 3种水质调控方式对刺参池塘浮游植物种群结构的影响[J]. 大连海洋大学学报,2019,34(4):566-572.
Lin Qing, Zhang Dongsheng, Wei Yanan, et al. Effects of three water quality regulation methods on phytoplankton population structure in a sea cucumber culture pond[J]. Journal of Dalian Ocean University, 2019, 34(4): 566-572. (in Chinese with English abstract)
[16] 张东升,王祖峰,周玮. 养水机对刺参池塘理化参数和细菌丰度的影响[J]. 南方水产科学,2021,17(6):85-92.
Zhang Dongsheng, Wang Zufeng, Zhou Wei. Effects of Jet Water Mixer on physicochemical parameters and bacterial abundance in pond[J]. South China Fisheries Science, 2021, 17(6): 85-92. (in Chinese with English abstract)
[17] 国家海洋局. 海洋调查规范第4部分:海水化学要素调查:GB/T 12763.4-2007 [S]. 北京:中国标准出版社,2008.
[18] 国家海洋局.渔业水质标准-悬浮物的测定-重量法:GB11607-89 [S]. 北京:中国标准出版社,1989.
[19] 环境保护部.水质叶绿素a的测定-分光光度法: HJ-897-2017 [S]. 北京:中国环境出版集团有限公司,2018.
[20] Wang L, Wei C, Chang Y, et al. Response of bacterial community in sea cucumberintestine, surrounding water and sediment subjected to high-temperature stress-Science Direct[J]. Aquaculture, 2021, 535: 736353.
[21] Gao L, He C, Bao X, et al. Comparative study of water environment variation in the industrial aquaculture system of sea cucumber[J]. Aquaculture Research, 2017, 48(4): 1787-1798.
[22] Ryther C M, Ortmann A C, Wohlgeschaffen G, et al. Temperate coastal microbial communities rapidly respond to low concentrations of partially weathered diesel[J]. Microbial Ecology, 2021, 1-11.
[23] Kataoka T, Ocki A, Nomura D. Production of dibromomethane and changes in the bacterial community in bromoform-enriched seawater[J]. Microbes Environ, 2019, 34(2):215-218
[24] Qin Q L, Xie B B, Yu Y, et al. Comparative genomics of the marine bacterial genusreveals the high degree of genomic diversity and genomic characteristic for cold adaptation[J]. Environmental Microbiology, 2014, 16(6): 1642-1653.
[25] Mario López-Pérez, Rodriguez-Valera F. 5 the Family Alteromonadaceae[M]. Berlin: Springer Berlin Heidelberg, 2014.
[26] Kirchman D L. The ecology of cytophaga-flavobacteria in aquatic environments[J]. FEMS Microbiology Ecology, 2002, 39(2): 91-100.
[27] Koo H, Mojib N, Huang JP, et al. Bacterial community shift in the coastal Gulf of Mexico salt-marsh sediment microcosm in vitro following exposure to the Mississippi Canyon Block 252 oil (MC252)[J]. Biotech, 2015, (5): 379-392.
[28] Klindworth A, Mann A, Huang S, et al. Diversity and activity of marine bacterioplankton during a diatom bloom in the North Sea assessed by total RNA and pyrotag sequencing[J]. Marine Genomics, 2014, 18: 185-192.
[29] Li Z, Qu Z, Zhang X, et al.gen. nov. sp. nov. isolated from coastal water during a massive green algae bloom[J]. International Journal of Systematic & Evolutionary Microbiology, 2012, 62(5): 1042-1047.
[30] Rosenberg E, DeLong E F, Lory S, et al. The Prokaryotes–Alphaproteobacteria and Betaproteobacteria-The Family Rhodobacteraceae[M]. USA: Springer Verlag, 2014: 440-512.
[31] Yachi S, Loreau M. Biodiversity and ecosystem productivity in a fluctuating environment: the insurance hypothesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96( 4): 1463-1468.
[32] Loreau M, Naeem S, Inchausti P, et al.Biodiversity and ecosystem functioning: current knowledge and future challenges[J]. Science, 2001, 294(5543): 804-808.
[33] 郭超,张东升,林青,等. 3种水质调控方式下春季参池环境及刺参肠道的细菌群落结构[J]. 大连海洋大学学报,2019,34(3):338-344.
Guo Chao, Zhang Dongsheng, Lin Qing, et al. Bacterial flora structures in intestinal tract and pond environment of sea cucumber under three water quality regulation methods in spring[J]. Journal of Dalian Ocean University, 2019, 34(3): 338-344. (in Chinese with English abstract)
[34] Ji B, Liang J, Ma Y et al. Bacterial community and eutrophic index analysis of the East Lake[J]. Environmental Pollution, 2019, 252: 682-688
[35] Wolińska A, Kuźniar A, Zielenkiewicz U, et al. Bacteroidetes as a sensitive biological indicator of agricultural soil usage revealed by a culture-independent approach[J]. Applied Soil Ecology, 2017, 119: 128-137.
[36] Ji B, Yang K, Zhu L, et al. Aerobic denitrification:a review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651
[37] Lauber C L, Hamady M, Knight R, et al. Pyrosequencing- based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75: 5111-5120.
[38] Ganzert L, Bajerski F, Wagner D. Bacterial community composition and diversity of five different permafrost-affected soils of Northeast Greenland[J]. FEMS Microbiology Ecology, 2014, 89: 426-441.
[39] Figueiredo D, Ferreira RV, Cerqueira M, et al. Impact of water quality on bacterioplankton assemblage along Certima River Basin (central western Portugal) assessed by PCR-DGGE and multiyariate analysis[J]. Environmental Monitoring and Assessment, 2012, 184(1): 471-485.
Effects of three water treatments on the structure of bacterial flora of sea cucumber breeding pond water in spring and autumn
Zhang Dongsheng1,2, Zhou Wei1※
(1.,,116023,; 2.&,,116023,)
Sea cucumber is an important species cultivated in seawater ponds in Liaoning and Shandong provinces of China in the past 30 years. However, the current conventional techniques for improving pond water quality, such as water exchange by spring tides (WEST) and submerged aerator (SA), are not very ideal. The ponds can still form thermohaloclines in February and June, and a large number of macroalgae will be produced in summer and autumn. Jet Water Mixer (JWM) is a new water quality control device for sea cucumber pond. In order to explore the effect and mechanism of water quality improvement of sea cucumber breeding pond by JWM, we measured the annual changes of water quality and the changes of bacterial flora and function in spring and autumn by 16SrRNA high-throughput sequencing technology under the three water quality control methods. Nine adjacent ponds of the same size and shape were selected for the experiment. Three ponds with JWM were used as the experimental group, and the other six ponds were used as the control group, among which 3 ponds were used as SA control group and 3 ponds were used as WEST control group. The results showed that the contents of NH4+-N, NO2--N and NO3--N in the pond water with JWM were decreased, and the contents of O2, PO43--P, TN, TP, chlorophyll and suspended matter were increased, But except that the content of chlorophyll in the pond water with JWM was significantly higher than that in the control pond, there was no significant difference in other water quality indexes. The effect of water quality regulation on the composition of dominant bacterial groups in pond water showed that the higher the classification level, the smaller the effect, while the lower the classification level, the greater the effect. The composition of the top 10 dominant phyla and the top 3 dominant classes in the pond water with JWM were basically the same as that in the control ponds. The first and second dominant phyla are Proteobacteria and Bacteroidetes. The first three dominant classes were Alphaproteobacteria, Gammaproteobacteria, and Flavobacteria, but the composition of the dominant genus varied greatly in different ponds. Lefse analysis showed that JWM significantly increased the abundance of Firmicutes-Bacilli-Lactobacillales in the pond water (LDA SCORE > 4), and t-test showed that WEST significantly increased the abundance of Alteromonadaceae and SA significantly increased the abundance ofin the pond water. FAPRTAX analysis showed that the main functional bacteria in each pond were chemoheterotrophy, aerobic chemoheterotrophy, sulfur oxidation, sulfur respiration, nitrate reduction, fermentation and plant pathogens. There was no significant difference in the annual mean abundance of the same functional bacteria among the ponds, but at the late stage of the experiment, there were large difference in the abundance of some functional bacteria between ponds. JWM increased the abundance of fermentation and plant pathogen bacteria and decreased the abundance of nitrate reduction bacteria. SA increased the abundance of nitrate reduction bacteria and decreased the abundance of plant pathogenic bacteria. The-diversity of microbiota was the highest in the water of pond with JWM, and the lowest in that of pond with SA. The main environmental factors affecting the structure of bacterial flora were the contents of TP, NH4+-N and NO2--N in pond water. In conclusion, JWM significantly increased the abundance of Lactobacillales and plant pathogenic bacteria, and increased the-diversity of bacterial flora in pond water. The former inhibited the growth of macroalgae, while the latter was beneficial to water quality stability.
aquaculture; flora composition; water quality regulation; Jet Water Mixer; functional bacteria; FAPRTAX; sea cucumber pond
10.11975/j.issn.1002-6819.2022.19.022
S96; Q939.1
A
1002-6819(2022)-19-0202-10
张东升,周玮. 三种水质调控方式对春秋季刺参池塘水细菌菌群结构的影响[J]. 农业工程学报,2022,38(19):202-211.doi:10.11975/j.issn.1002-6819.2022.19.022 http://www.tcsae.org
Zhang Dongsheng, Zhou Wei. Effects of three water treatments on the structure of bacterial flora of sea cucumber breeding pond water in spring and autumn[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(19): 202-211. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.19.022 http://www.tcsae.org
2022-06-15
2022-09-15
辽宁省科学计划项目(2018104009);辽宁省“兴辽英才”项目(XLYC1008029);大连市2020年度科技特派团项目;大连市重点领域创新团队支持计划项目(2019RT11);大连市第二批领军人才项目联合资助。
张东升,教授,研究方向为水域微生态。Email:zhangds0415@126.com
周玮,教授,研究方向为水产健康养殖技术。Email:zhouwei@dlou.edu.cn

