番茄果皮颜色的基因功能标记开发及色差仪参数相关分析
蔡锦玲 姚文 陈品品 蓝波妙 林涛
(泉州市农业科学研究所 福建泉州 362200)
野生番茄经过几百年的驯化已成为受世人喜爱的经济蔬菜之一[1]。番茄果实颜色是重要的外观品质性状之一,果实越红其营养品质越好,在鲜食或加工方面更受市场的欢迎[2]。果实颜色由果皮和果肉颜色共同作用,其中果肉颜色受多基因控制,而果皮颜色的分子遗传机制相对简单,但目前针对番茄果皮颜色开发分子标记和精准测量及分类方法的报道仍然较少,不利于果皮颜色分子选择育种工作的开展。开发新的基因功能标记并使用色差仪快速精准地测量果皮颜色,为番茄果皮颜色的分子标记辅助选择育种提供技术支持,对加快番茄果实色泽的选育进程具有重要意义。
番茄果实颜色丰富,有红色、粉色、黄色、绿色、紫色和橙色等[3]。果肉颜色受多个基因的控制,在类胡萝卜素和花青素代谢途径中,因r、nor、Gr、Cnr、Nr、hp、t、Del、Aft、atv、Abg等的突变或渗入使得番茄果实呈现出多种颜色[4-6]。番茄果皮颜色相对简单和易于分组,一般可分为有色和无色透明果皮2种,有色果皮对无色果皮呈显性作用,受基因SIMYB12控制[7-8],在果实发育过程中,因SIMYB12基因无法表达而不能在果皮中积累类黄酮,从而使成熟果实的果皮为无色透明,但果皮无色透明的番茄风味和口感更好。当SIMYB12基因正常表达时,成熟果实的果皮表现为有色,更耐储藏和运输。
果皮颜色的鉴定主要有直观鉴定法或仪器测定法。直观鉴定法,是经典且使用方便、基础简单的测色方法,仅适用易于分类颜色的分级工作,但植物种皮颜色变异范围极为广泛,多呈连续性分布,直观鉴定法易受人为因素的影响,容易忽略一些中间的过渡色[9],不利于颜色的精确测量、分类和量化分析,仪器测定法是指通过运用仪器(通常是色差仪)将颜色转为精准的数值,使颜色数值化、具体化和可视化,操作简单、耗时短,能够对颜色实现更精准的测量和分类[10]。目前色差仪在许多作物的果皮颜色或者果色测量上均有应用,如在樱桃番茄[11]、黄瓜[12]和辣椒[13-14]等的应用。
由于生活品质的提高,市场上对无色透明果皮红色果肉的粉果番茄需求不断增加,而目前应用于番茄果皮颜色的功能标记及精准测量的研究相对较少。祝光涛[15]研究发现,在粉果番茄SIMYB12基因起始密码子上游4 kbp处存在大小为603 bp的序列缺失,会影响基因的结构和功能,对果皮颜色造成一定的影响。因此,本研究就该位点设计与番茄果皮颜色相对应的分子功能标记,并利用30份不同类型的番茄种质资源进行验证;对色差仪的Lab和Ch测量值与果皮颜色相关性进行分析,快速准确地区分不同果色番茄的果皮颜色,探索不同果皮颜色的分类阈值。虽然SIMYB12基因不同单倍型对果皮颜色的影响已有报道[15-16],但通过设计分子功能标记对不同的大果番茄和樱桃番茄种质资源进行鉴定和利用尚未见报道。本研究基于SIMYB12基因上对果皮颜色有影响的缺失位点,开发可用于琼脂糖电泳并且重复性好的分子功能标记,并利用色差仪实现快速准确的果皮颜色分类,为番茄果皮颜色的分子辅助选择育种和表型鉴定奠定基础。
1 材料与方法
1.1 材料
1.1.1 试材 选择泉州市农业科学研究所收集的30份番茄种质资源为供试材料,包括樱桃番茄28份(其中黄色樱桃番茄3份、紫色樱桃番茄2份、红色樱桃番茄23份)和红色大果番茄2份,命名从编号P1~P30,果型和果实颜色如图1所示。

图1 三十份番茄种质资源的果型和颜色
1.1.2 试剂和仪器 分子实验试剂耗材均购自北京索莱宝科技有限公司;分子功能标记引物由生工生物工程(上海)股份有限公司合成;INFINITE 200 PRO酶标仪为Tecan公司生产;水平电泳仪、Universal Hood PCR仪、GelDoc凝胶成像系统为BIO-RAD公司生产;色差仪为汉潽公司生产的HP-C220精密色差仪。
1.2 方法
1.2.1 DNA提取及浓度测试 参照Saghai- Maroof等[17]方法,采用CTAB法提取番茄幼叶基因组总DNA。DNA的浓度使用酶标仪进行测试。根据测定结果,添加TE使得各试验材料的DNA浓度在50~100 ng/μL。
1.2.2 果皮颜色SIMYB12基因分子功能标记设计 祝光涛[15]基于番茄参考基因组SL2.40版本的研究结果显示,番茄果皮颜色基因SIMYB12在1号染色体的SL2.40ch01: 70 935 936-70 938 394 bp上,在其上游4 kbp的位置上存在着603 bp的缺失。目前番茄参考基因组已更新到SL4.0版本,依据SIMYB12基因的最新注释信息,从NCBI(https://www.ncbi.nlm.nih.gov/)网站下载番茄的最新组装基因组,通过序列比对确定该基因和缺失片段的位置,并提取基因及其上下游10 kbp的序列区域(SL4.0ch01: 71 312 725-71 326 073 bp),用Oligo 7软件(http://www.oligo.net/downloads.html)于缺失603 bp的两侧适当位置进行引物设计,设计扩增产物的大小满足于在琼脂糖凝胶上进行电泳检测;接着将设计完成的引物在NCBI上与番茄的全基因组进行Primer-Blast比对,确定引物的特异性,筛选合格的引物交由生工生物工程(上海)股份有限公司合成。
1.2.3 PCR扩增及电泳检测 PCR反应体系(15 μL):模板DNA 1 μL,10×buffer 1.5 μL,dNTPs 0.6 μL,前后引物各0.6 μL,Taq DNA聚合酶0.3 μL,ddH2O 10.4 μL。反应在艾本德Universal Hood PCR仪上进行。
PCR反应程序:94℃预变性5 min;94℃变性30 s,58.6℃退火30 s,72℃延伸90 s,35个循环;最后72℃延伸10 min。反应结束后4℃保存。为了确定不同引物最适合的退火温度,不同引物PCR退火温度均依据梯度结果进行调整,梯度温度范围为43~59℃。
琼脂糖凝胶电泳:DNA扩增产物用1.5%的琼脂糖凝胶添加1%的gel red核酸染料进行电泳,置于伯乐GelDoc凝胶成像系统下观察并拍照。统计各样本的扩增条带,大片段带型记为1,小片段带型记为3,杂合带型记为2,缺失数据记为0。
1.2.4 果皮颜色色差仪测量 随机选择充分成熟番茄果实,沿果面赤道一周均匀取3个点,用色差仪测得L、a、b、C和h的数值后取平均值。每份材料测定3个果实,每个果实重复测定3次。色差仪的5个测量值具有不同的涵义:L代表黑白通道,0表示黑色,100表示白色。a代表红绿通道,a>0表示颜色偏红,a<0表示颜色偏绿。b代表黄蓝通道,b>0表示颜色偏黄,b<0表示颜色偏蓝。C值反映色彩饱和度或纯粹度,色度越大,颜色越鲜艳;h值为色调角,反映红绿蓝3个基本色及其之间的过渡颜色,0°表示纯红色,120°表示纯绿色,240°表示纯蓝色。
1.2.5 数据统计分析 数据的整理、分析和图形绘制采用开源工具R(4.0.2,https://www.r-project.org/)完成。
2 结果与分析
2.1 供试样品DNA质量检测
使用酶标仪对提取的番茄种质DNA进行快速检测,结果(表1)表明,样品浓度OD260nm/OD280nm范围在1.81~1.99,比值小于1.9的样品10份,比值大于1.9的样品20份,平均值为1.92,可见供试的30份番茄种质DNA提取质量均满足后续常规PCR扩增。
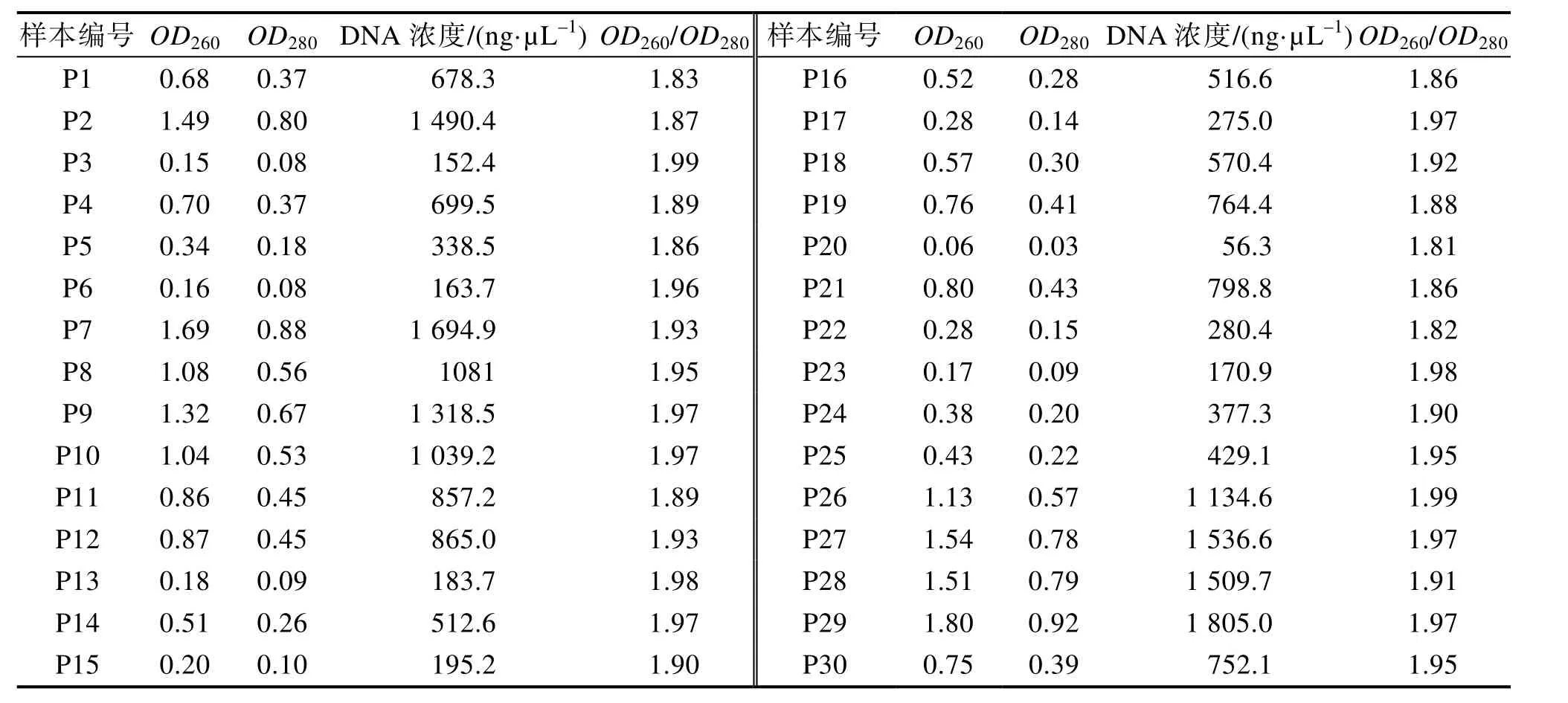
表1 三十份供试番茄种质资源DNA的质量
2.2 功能标记的设计及验证
从NCBI网站下载最新的番茄基因组DNA序列,通过序列比对定位缺失的603 bp位置(图2)。利用Oligo 7设计引物,基于基因SIMYB12上游缺失序列的区域设计的产物扩增片段大小在200~2 000 bp,该标记适合在琼脂糖凝胶上进行电泳检测,并且经Oligo 7软件检验可知,其无发夹、引物二聚体等次级结构,所以设计的引物理论可行。

图2 缺失位置及A-10功能标记的序列信息
本研究基于SIMYB12基因共设计了16对引物(表2):3对引物(A-2、A-3和A-7)的扩增产物未包括缺失的序列,扩增产物的片段大小无差异,不可用于区分缺失的位点;有5对引物(A-8、A-9、A-11、A-12和A-13)位于缺失内,可单显性扩增出缺失序列,为显性标记引物,除A-13扩增片段大、效果较差,其他均能准确地判断出果皮是否有色,但无色透明果皮和缺失数据无法区分;有8对(A-1、A-4、A-5、A-6、A-10、A-14、A-15和A-16)跨越缺失区域的引物,其中4对引物(A-5、A-6、A-15和A-16)扩增产物偏大、效果较差,另外4对引物(A-1、A-4、A-10和A-14)可以共显性标记出缺失和非缺失2种基因型。由于缺失区域的GC含量偏低(A-10产物的GC含量为23%),导致PCR扩增困难,常规的反应体系和退火温度在该区域经常无法扩增。利用P1(千禧,无色果皮)、P9(夏日阳光,纯合有色果皮)、P5(F1杂合,有色果皮)3个材料作为功能标记测试的供试材料,通过不同的退火温度测试4对共显性标记,A-10的扩增效果最好,最适合的退火温度为58.6℃,最终选取A-10作为SIMYB12基因的分子功能标记(图3)。
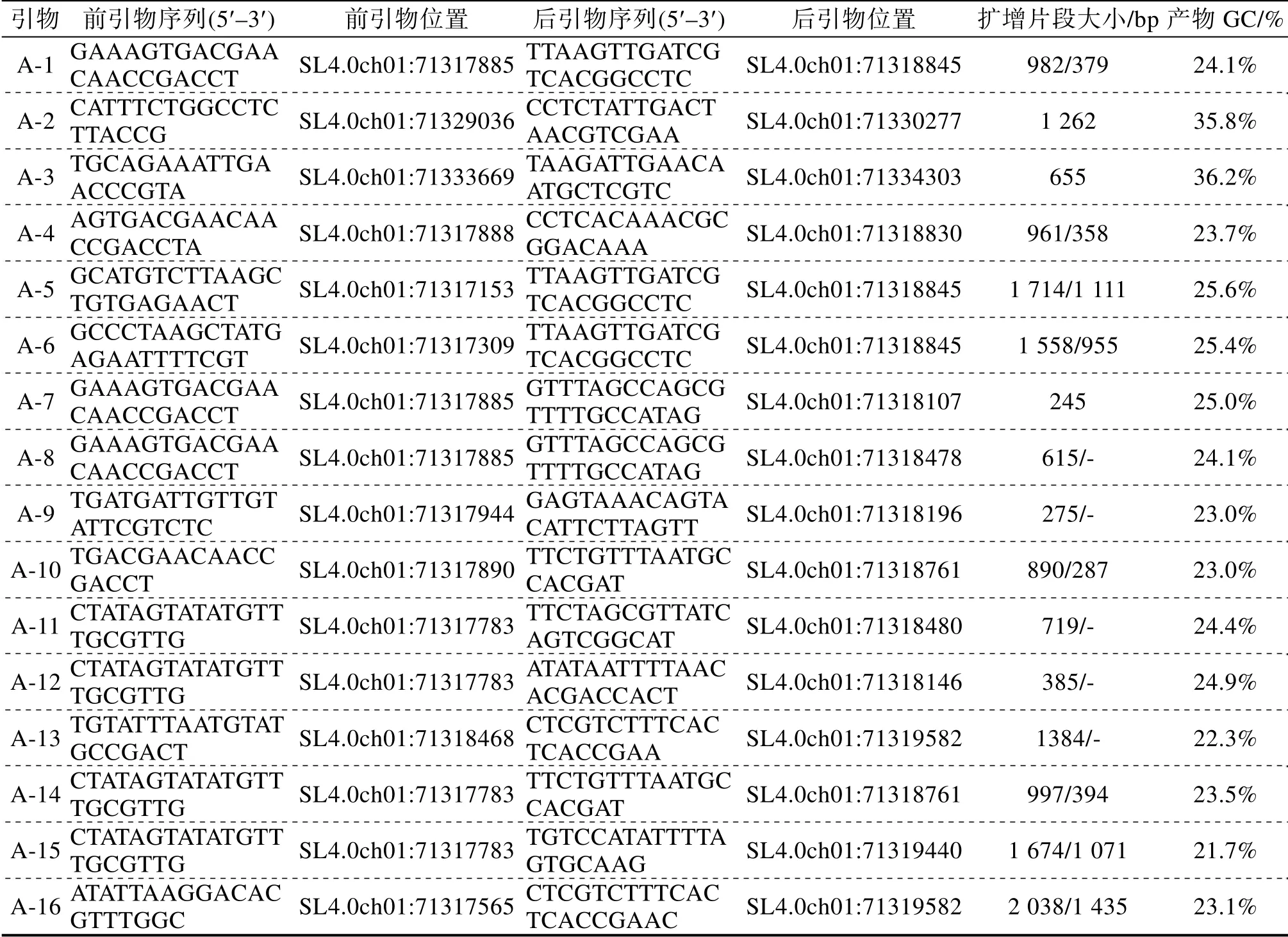
表2 分子功能标记的编号及序列信息

图3 引物A-10不同退火温度电泳结果
2.3 番茄种质资源的分子鉴定
利用A-10分子功能标记对30份种质资源进行基因型鉴定(图4)。结果表明,30份番茄种质资源中有18份(P1-P4、P10、P13、P16、P18、P19、P21-25、P27-P30)扩增出约287 bp的特异性条带,为纯合隐性的缺失基因型,分子鉴定其果皮为无色透明果皮;3份材料(P9、P17和P20)扩增出约890 bp的条带,为纯合显性基因型,分子鉴定其果皮为有色果皮;还有9份(P5~P8,P11~P12,P14~P15,P26)同时扩增出287和890 bp的条带,说明控制果皮颜色的基因位点处于杂合的状态,为杂合基因型,分子鉴定为有色果皮。
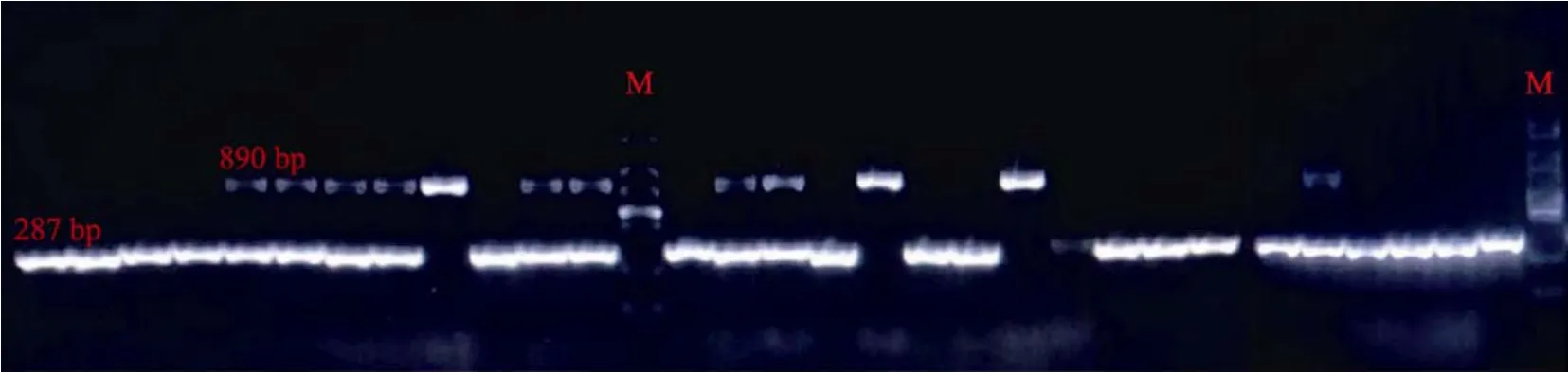
图4 供试番茄材料A-10分子功能标记电泳检测
2.4 果皮颜色测定及分析
利用色差仪采集30份番茄种质资源果实颜色的数据,获得L、a、b、C和h测量值。Lab和LCh代表2个颜色空间,可以相互转化。通过对果皮颜色在这两个颜色空间进行分析,最终使用三维坐标对Lab进行分析(图5-A),将b≥45的果分类为有色果皮,b<45的果归类为透明果皮;Ch值采用二维坐标分析(图5-B),将色彩饱和度C≥60的分类为有色果皮,2种数据分析方法归类结果一致。通过色差仪可以快速测出不同果皮颜色的测量值,并且使用Ch测量值即可区分大部分果皮的颜色。
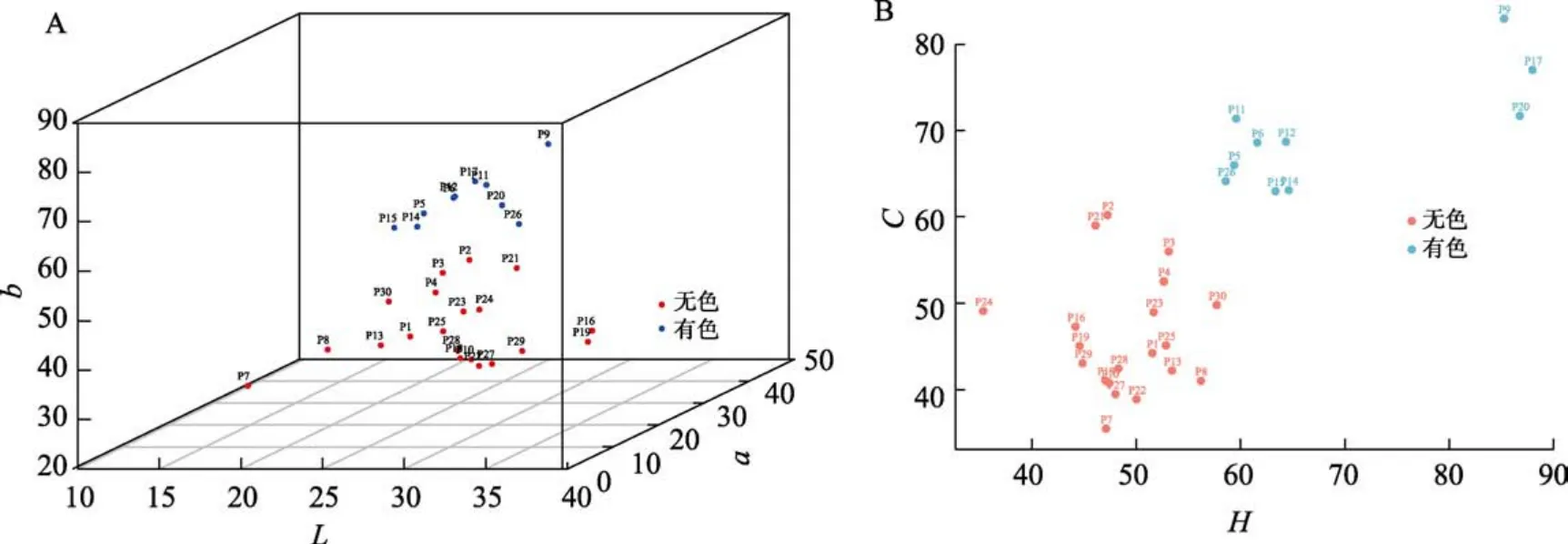
图5 三十份种质资源的果皮颜色分析
2.5 功能标记与目测法和仪器测试法的相关性分析
供试的材料中(表3),通过目测鉴定法,共有无色透明果皮18份,有色果皮12份;依据分子功能标记的鉴定,隐性纯合的无色透明果皮材料18份,有色果皮12份,其中显性纯合材料3份,杂合材料9份;依据Ch测量值,色差仪鉴定法鉴定的透明无色果皮20份,有色果皮10份。分子功能标记的基因型与目测法的果皮颜色完全相符(相符率:100 %),分子功能标记的基因型与Ch鉴定法鉴定的果皮颜色相符的有28份(相符率93.3%),不相符的2份(6.67%),不相符的材料为P7和P8。P7和P8为紫色番茄,在SIMYB12基因的缺失位点上为杂合型,果皮为有色果皮,但由于花青素含量高,呈现紫黑色,故色差仪测得其颜色饱和度C值及黄绿色b值较低。

表3 三十份番茄种质资源分子鉴定法与目测鉴定法和仪器鉴定法的比较分析
3 讨论与结论
在SIMYB12基因上游区域存在着影响功能的603 bp缺失序列[15-16],是设计InDel分子功能标记的理想区域。王仁汉等[18]参照祝光涛[15]设计的InDel分子标记,对32份普通番茄材料进行验证,有2份无法扩增,并且对16份樱桃番茄进行检测,其准确率为62.5%。笔者在使用该InDel标记时,也容易出现无法扩增的情况。经过序列分析,PCR反应无法扩增是该缺失区域的GC含量偏低所导致。因此,本研究的主要目的是在该位点重新设计新的分子功能标记,并优化其PCR反应体系,以期提高其检出率和准确性。该缺失区域的GC含量偏低,约为23%,PCR产物扩增较难,本研究设计的A-10分子功能标记,最初利用15 μL常规的反应体系也经常出现材料无法扩增的情形,后通过增加dNTPs的浓度到0.6μL,并尝试调整不同的退火温度。在使用退火温度53℃时,虽然其结果的正确率提高到66.7%,但由于退火温度较低,容易出现较多的副带,产生假阳性的杂合带型。最后通过调整退火温度为58.6℃,使A-10分子功能标记检测准确性提高到100%,解决缺失区域扩增困难的问题。
紫色番茄P7和P8由于受到花青素代谢途径合成基因的影响,花青素在其果皮上的积累,因此果实颜色呈现出紫色[19]。除了紫色番茄果皮颜色的分子检测与色差仪采集数据存在不一致的情况外,其它颜色的番茄检测结果均相符。本试验供试的2份紫色番茄材料的果皮为有色果皮,但色差仪的Lab或者Ch测量值均在无色透明果皮的标定范围内,是花青素使果实呈现紫色[20],紫色为红色色相,导致色差仪显示其b值偏向红色;测量值小于45,或C值小于60,判断为无色。在紫色番茄果皮颜色的测量中,色差仪的有色和无色果皮的阈值范围,可使用有色果皮与无色果皮的紫色番茄材料作进一步的测定和分类。但因目前本课题组收集的紫色番茄种质资源仅有有色果皮的材料,故不能完成这部分对比试验。因此,对于紫色番茄的果皮颜色测定分类仅能通过传统的目测鉴定法来完成。
传统的番茄果皮颜色一般通过目测法简单进行区分和归类,但是果皮颜色变异范围极为广泛,多呈连续性分布,直观鉴定法易受人为因素的影响,不利于颜色的精确测量和分类,容易忽略一些中间的过渡;而仪器测定法中使用的色差仪自带光源,不易受外界环境条件变化影响,能准确测量有细微差别的2种颜色,而且具有操作便利、无损的特点。通过比较目测法和色差仪鉴定法测定结果与基因型的相符度可知,除了紫色番茄存在基因型与仪器测定法不一致外,其余的供试番茄材料中目测法和仪器测定法测定结果与基因型的检测结果均一致,表明仪器测定法可用于非紫色番茄的测定,且能够更精准地测定不同果皮的颜色并进行归类。由于SIMYB12基因存在着多个突变的位点,不同的单倍型对果皮颜色的影响不尽相同,本研究仅在603 bp缺失位点开发的功能标记A-10虽不能完全代表不同的果皮颜色,但可用于大部分种质资源的鉴定。因此,在针对番茄果皮颜色的分子标记辅助育种方面,本研究结果具有一定的参考价值。

