髓芯减压联合胶原基骨修复材料和血管内皮生长因子对兔股骨头坏死血管修复和微循环的影响
吕亚军 任立中 李军 张海静 张志坤
河北医科大学第一医院骨二科(石家庄 050031)
股骨头坏死(osteonecrosis of femoral head,ON⁃FH)具有较高的致残率,影响患者的生活水平[1-2]。ONFH可减弱血管再生和新骨形成,并增强死骨吸收[3-4]。髓芯减压是一种广泛认可的治疗方法,可降低骨内压力,延缓ONFH的进程[5]。然而,乙醇滥用、激素滥用、骨坏死损伤的位置和范围等因素可影响髓芯减压治疗效果[5]。髓芯减压所形成的空腔需要植骨来完成。天然骨是髓芯减压后植骨的主要材料,但是天然骨伴有供区损伤、植骨量不足、不能制备特殊形状等缺点,限制其临床应用。胶原基骨修复材料与天然骨的成分几乎一致,该材料是利用仿生原理由低结晶度纳米级羟基磷灰石与胶原自组装而成[6]。其他文献表明,胶原基骨修复材料具有诱导骨髓间充质干细胞向成骨细胞分化的能力及无免疫原性、可降解、易塑形等特性,可加速骨修复过程[6]。血管再生在骨形成和修复中至关重要[7],血管再生有利于骨痂形成和骨改造塑形。在骨缺血性坏死的修复过程中,可利用各种细胞因子来促进修复过程中的血管再生及新骨形成。血管内皮生长因子(VEGF)是一种促进血管生成的最重要的细胞因子[7-8]。VEGF可直接吸引内皮细胞和破骨细胞,促进成骨细胞的分化,从而促进骨形成和修复[9-11]。故本实验以兔为研究对象,采用股骨头注入无水乙醇方法造ONFH模型,创新性地结合髓芯减压、胶原基骨修复材料、VEGF探讨其对兔ONFH模型血管修复和微循环的影响。
1 材料与方法
1.1 动物30只6月龄无特定病原体级家兔购自河北医科大学实验动物中心,雌雄不限,合格证号为SCXN(冀)2013⁃1⁃003;体质量:(2.21 ± 0.29)kg。这些家兔饲养在12∶12 h的光明⁃黑暗周期中,室温设定为25℃,相对湿度设定为60%。不限制进食和饮水。本研究已获得医院伦理委员会通过,许可号为20141004。
1.2 动物模型建立及磁共振成像扫描筛查参考文献方法建立ONFH兔模型[12]。采用20 g/L的戊巴比妥钠(30 mg/kg)耳缘静脉麻醉家兔,成功后将家兔俯卧位固定,剪除兔毛,双髋部采用1%的活力碘进行消毒。在大转子外侧将筋膜和皮肤剪开,并将转子间的肌肉进行钝性分离,X线引导下穿刺至股骨头中心,之后采用3.0、2.5、2.0 mm直径的克氏针依次扩髓,之后形成骨髓孔道后(图1A),通过骨穿针套将1 mL的无水乙醇按照0.1 mL/min的速度注射至股骨头中心(图1B)。用医用骨蜡对皮质骨孔洞进行封闭,之后将肌肉、筋膜和皮肤进行逐层缝合。造模后将家兔在空调房(28℃)中观察1 d后放回笼养。6周后进行磁共振成像(MRI)扫描。MRI显示T1WI呈不规则低信号,T2WI呈不规则高信号,提示造模成功[13]。

图1 兔股骨头钻孔Fig.1 Drilling the femoral head of the rabbit
1.3 动物分组和治疗将30只家兔随机分为健康对照组(A组)、模型组(B组)、髓芯减压+自体松质骨组(C组)、髓芯减压+胶原基骨修复材料组(D组)和髓芯减压+胶原基骨修复材料+VEGF组(E组),每组6只,按照相应的治疗方法对家兔进行分组治疗。所有家兔取俯卧位,采用40 mg/kg的硫喷妥钠进行腹腔注射麻醉,于髋关节后侧进行切口,从阔筋膜张肌与臀大肌之间进入,将外旋肌群切断,同时将关节囊暴露,外旋股骨,将股骨头显露出来,髋关节不脱位,圆韧带不切断,将周围组织保护起来,对股骨头采用液氮棉团连续冷冻3 min即可。A组和B组不进行治疗;C组进行髓芯减压+自体松质骨植入治疗,在自然复温以后从股骨颈内后侧向股骨头内进行钻孔,深度约为4 mm,植入自体松质骨,关闭伤口;D组在髓芯减压基础上植入胶原基骨修复材料(天津市赛宁生物工程技有限公司,国械注准20143461867),关闭伤口;E组在髓芯减压基础上植入吸附有VEGF(上海沪震实业有限公司)的胶原基骨修复材料(约含500 ng VEGF),关闭伤口。术后臀大肌注射硫酸庆大霉素注射液,2 mL/次,1次/d,连续治疗3 d。所有家兔均治疗8周。
1.4 血液流变学测定治疗8周后,所有家兔禁食12 h后采集清晨耳缘静脉血3 mL,迅速置入肝素抗凝管。采用LBY⁃N6B型全自动血液流变仪测定全血黏度(高切 150 s⁃1和低切 10 s⁃1)、血浆黏度和红细胞压积。
1.5 血脂测定收集3 mL耳缘静脉血,不加抗凝剂,待血清析出后,采用日立7170A自动生化分析仪检测血清总胆固醇(TC)和甘油三酯(TG)。
1.6 组织病理学染色取股骨头用0.9%氯化钠冲洗,脱钙,切成5 mm厚的石蜡切片。进行苏木精-伊红(HE)染色(碧云天生物技术研究所),显微镜下观察切片。
1.7 qRT⁃PCR治疗8周后,处死家兔并取出股骨头,用预冷的DEPC水冲洗,用组织研磨机将股骨头在液氮中粉碎,用Trizol试剂(美国Thermo Fisher)提取股骨头匀浆总RNA。用氯仿分层总RNA,然后用异丙醇沉淀。沉淀的总RNA用75%乙醇洗涤,并在RNase⁃free水(美国Thermo Fisher)中溶解。使用SuperScripⅣ逆转录酶(美国Thermo Fisher)合成相应的cDNA,然后在伯乐CFX Con⁃nect荧光定量PCR仪下用PowerUp SYBR Green Master Mix(美国Thermo Fisher)进行扩增。所用的引物如表1所示,反应程序为:95℃预变性10 min,95℃变性15 s,60℃退火60 s,40个循环。以GAP⁃DH 作为内参基因,用 2⁃ΔΔCt法计算 mRNA 相对表达量。von Hippel⁃Lindau(VHL)、缺氧诱导因子α(HIF⁃1α)、VEGF、碱性成纤维细胞生长因子(bF⁃GF)和GAPDH引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.8 统计学方法采用SPSS 22.0和GraphPad Prism 8.0软件对数据进行分析。数据用平均值±标准差表示,采用单因素方差分析进行多组比较,两两比较采用LSD检验。P<0.05表示差异有统计学意义。
2 结果
2.1 各组家兔的一般情况观察本研究过程中无家兔死亡。A组家兔精神萎靡不振,行动迟缓,皮毛无光泽,皮下脂肪减少,弹跳能力降低。B、C和D组家兔精神状态和活动灵敏度均优于A组,皮毛呈现光泽,其中D组家兔的一般情况优于其他组。
2.2 各组家兔的血液流变学水平与A组比较,B组的全血黏度(高切 150 s⁃1和低切 10 s⁃1)、血浆黏度和红细胞压积均显著升高(P<0.05)。与B组比较,C、D和E组的全血黏度(高切150 s⁃1和低切10 s⁃1)、血浆黏度和红细胞压积均显著降低(P<0.05)。与C和D组比较,E组的全血黏度(高切150 s⁃1和低切 10 s⁃1)、血浆黏度和红细胞压积均显著降低(P<0.05)。见表2和图2。
表2 各组家兔的血液流变学水平Tab.2 Hemorheology levels of rabbits in each group±s
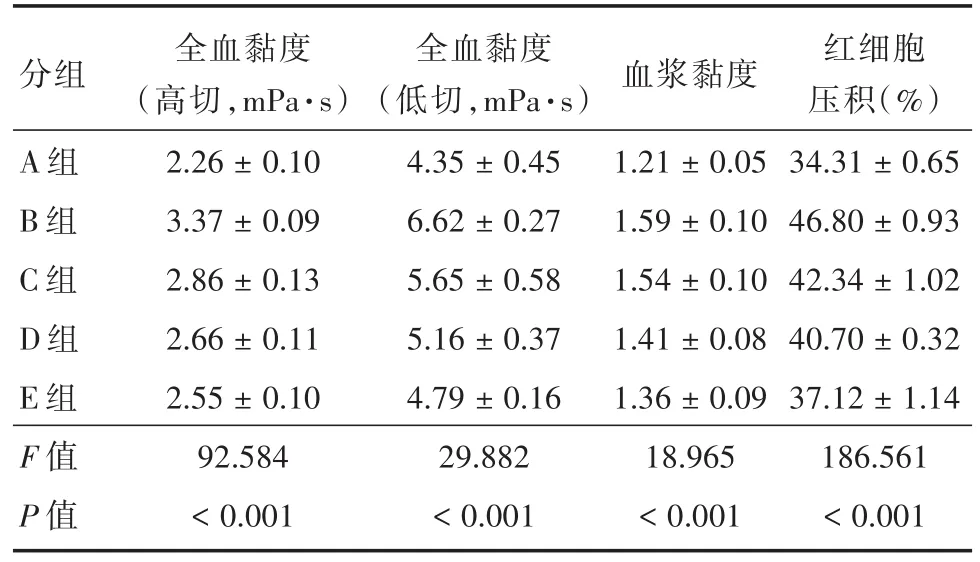
表2 各组家兔的血液流变学水平Tab.2 Hemorheology levels of rabbits in each group±s
分组A组B组C组D组E组F值P值全血黏度(高切,mPa·s)2.26±0.10 3.37±0.09 2.86±0.13 2.66±0.11 2.55±0.10 92.584<0.001全血黏度(低切,mPa·s)4.35±0.45 6.62±0.27 5.65±0.58 5.16±0.37 4.79±0.16 29.882<0.001血浆黏度1.21±0.05 1.59±0.10 1.54±0.10 1.41±0.08 1.36±0.09 18.965<0.001红细胞压积(%)34.31±0.65 46.80±0.93 42.34±1.02 40.70±0.32 37.12±1.14 186.561<0.001
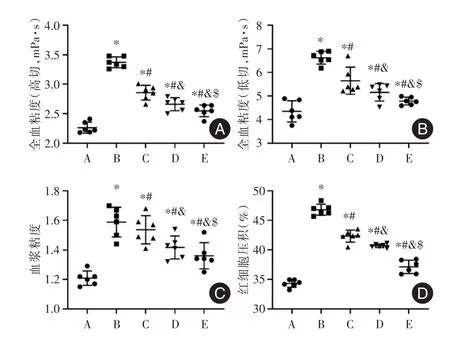
图2 各组家兔的血液流变学指标分布情况Fig.2 Distribution of hemorheology indexes of rabbits in each group
2.3 各组家兔的血脂指标水平与A组比较,B组的血清TC和TG均显著升高(P<0.05)。与B组比较,C、D和E组的血清TC和TG均显著降低(P<0.05)。与C和D组比较,E组的血清TC和TG均显著降低(P<0.05)。见表3和图3。
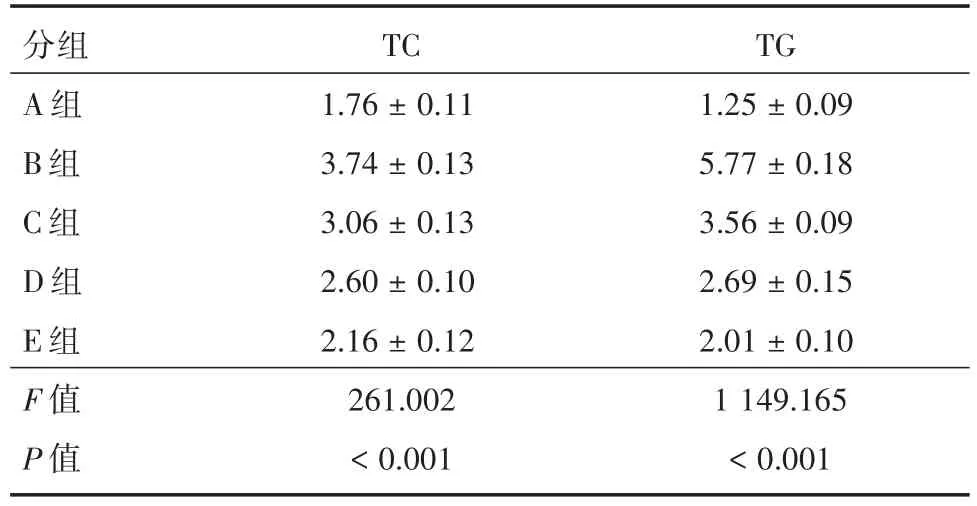
表3 各组家兔的血清TC和TG水平Tab.3 Serum TC and TG levels of each group of rabbits x±s,mmol/L

图3 各组家兔的血清TC和TG水平分布情况Fig.3 Distribution of serum TC and TG levels of rabbits in each group
2.4 各组家兔的股骨头组织病理学变化治疗8周后,与B组相比,C、D和E组骨髓结构紊乱程度均减轻,骨小梁形成增多,且骨小梁错乱情况减轻,骨髓中微血管形成明显增多,且坏死区基本被修复。此外,E组股骨头组织明显优于其他组。见图4。

图4 股骨头组织HE染色(×400)Fig.4 HE staining of femoral head tissue(× 400)
2.5 各组家兔的股骨头组织中VHL、HIF⁃1α、VEGF和bFGF的转录与A组比较,B组股骨头组织中VHL、HIF⁃1α、VEGF和bFGF mRNA水平均显著升高(P<0.05)。与B组比较,C、D和E组股骨头组织中VHL mRNA水平显著降低,而HIF⁃1α、VEGF和bFGF均显著升高(P<0.05)。与C和D组比较,E组股骨头组织中VHL mRNA水平显著降低,而HIF⁃1α、VEGF和bFGF均显著升高(P< 0.05)。见表4和图5。

表4 各组家兔的股骨头组织中VHL、HIF⁃1α、VEGF和bFGF的mRNA相对表达量Tab.4 Relative mRNA expressions of VHL,HIF⁃1α,VEGF and bFGF in femoral head tissue of rabbits in each group x±s
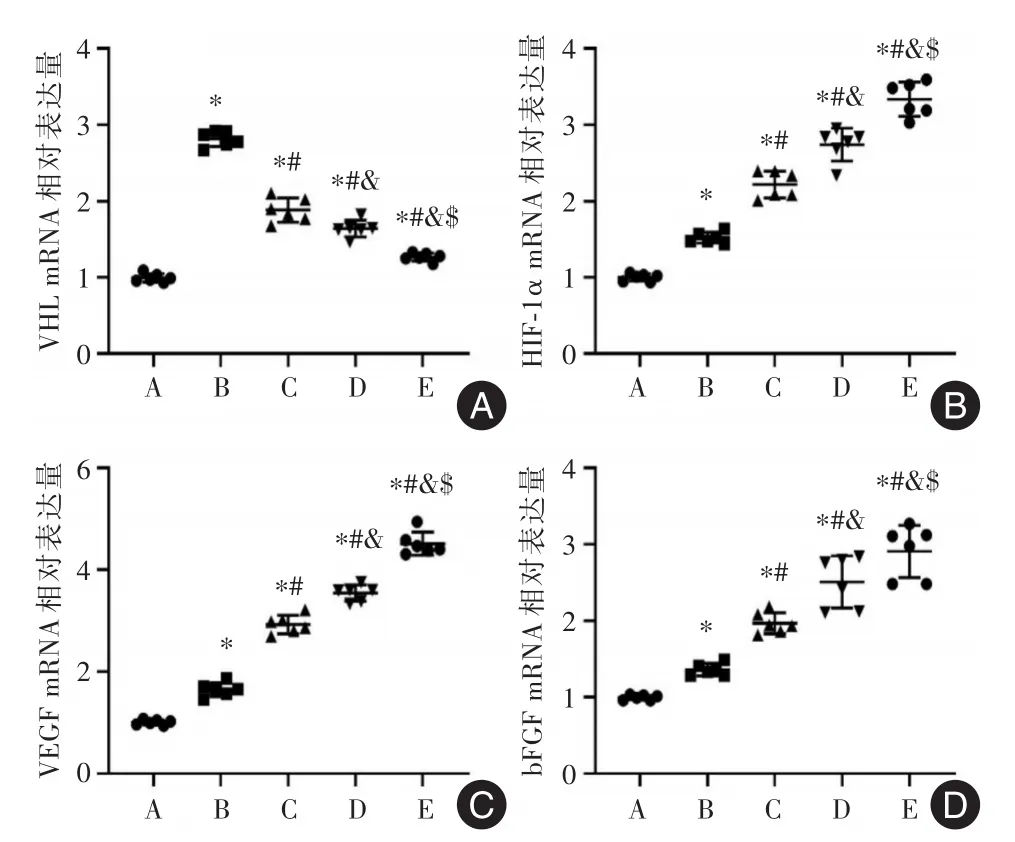
图5 各组家兔的股骨头组织中VHL、HIF⁃1α、VEGF和bFGF的mRNA分布情况Fig.5 mRNA distribution of VHL,HIF⁃1α,VEGF and bFGF in femoral head tissue of rabbits in each group
3 讨论
微循环是微动脉与微静脉之间毛细血管中的血液循环,大量研究显示,ONFH过程中出现微循环障碍[14]。血浆黏度是血液流变学特性,血浆黏度直接决定血液流速及血栓形成。全血黏度、血浆黏度和红细胞压积升高可导致微循环障碍,并造成局部组织缺血缺氧,这也是ONFH形成的主要病理过程。本研究显示,髓芯减压+胶原基骨修复材料+VEGF显著降低了ONFH家兔的全血黏度、血浆黏度和红细胞压积,从而减轻了微循环障碍。微循环障碍不仅与血管生成有关,而且与脂质代谢有关。脂质代谢紊乱可导致脂肪栓塞和骨细胞脂肪变性,引起微循环障碍,进而导致ONFH。本研究显示,髓芯减压+胶原基骨修复材料+VEGF显著降低了ONFH家兔的血清TC和TG,从而改善了脂质代谢。功能正常的血管系统在骨骼再生过程中至关重要,血管系统障碍可引起骨组织发生坏死并抑制骨形成,因此,血管生成在加速骨折愈合中起重要作用[15]。VEGF已被证明是成骨和血管生成过程的重要组成部分,其可刺激骨损伤部位血管再生[16-18],并且,VEGF具有促进内皮细胞增殖和迁移、调节成骨生长因子刺激成骨等多种功能[19]。低氧可能启动细胞内的代偿反应和低氧反应基因的转录,这种反应依赖于HIF⁃1α[20]。HIF⁃1α 是一种普遍表达的转录因子,在缺氧条件下,HIF⁃1α积累、转移到细胞核中并调节其靶基因(包括VEGF)的转录[21]。报告显示,缺乏HIF⁃1α的小鼠的小梁骨体积减小,HIF⁃1α通路的激活是骨形成和血管生成的关键机制,HIF⁃1α会在缺氧条件下增加成骨细胞中VEGF的表达[22]。此外,HIF⁃1诱导内皮细胞分泌VEGF,从而增强了血管生成和成骨并防止骨丢失[23]。VHL在HIF⁃1α/VEGF信号的调控中起着至关重要的作用,VHL已被证明可抑制HIF⁃1α 的表达[24]。在常氧条件下,HIF⁃1α与 VHL结合,并通过泛素化降解VHL[25]。以前的研究表明,VHL的丢失与骨细胞中HIF⁃1α信号的激活相一致,在骨发育、动态平衡和再生中发挥着重要作用[26]。VHL 的丢失通过增强 HIF⁃1α 的表达显著促进血管生成[27]。本研究显示,髓芯减压+胶原基骨修复材料+VEGF显著降低了ONFH家兔股骨头组织中VHL的mRNA水平,而升高了HIF⁃1α和VEGF mRNA水平(P<0.05)。这些结果说明,髓芯减压+胶原基骨修复材料+VEGF可能通过VHL/HIF⁃1α/VEGF信号来调节血管生成。此外,本研究也发现,髓芯减压+胶原基骨修复材料+VEGF显著增加了ONFH家兔股骨头组织中bFGF的mRNA水平,从而促进了血管生成和骨形成(P<0.05)。bFGF在血管及成骨方面具有重要作用,其不仅可以通过诱导毛细血管内皮细胞迁移和增殖来促进血管生成,而且可以促进成骨细胞增殖,加速骨形成。
本研究结果显示,髓芯减压、胶原基骨修复材料和VEGF均有效促进了骨小梁形成和血管生成,促进了ONFH区域的修复。此外,髓芯减压+胶原基骨修复材料+VEGF治疗效果显著优于髓芯减压+自体松质骨组和髓芯减压+胶原基骨修复材料组。分析其原因,主要包括以下方面:(1)髓芯减压通过降低骨内压、改善血供、刺激血供丰富的大转子部的血管沿减压隧道长入股骨头内,从而促进坏死股骨头的修复[5]。(2)胶原基骨修复材料中的胶原是构成细胞外基质的骨架,可为细胞生长、增殖提供适宜的环境。另外,胶原基骨修复材料具有贯通性良好的孔隙率和多尺度孔径,可充分保证血液在其中的流动以及细胞的迁徙与附着,并且能够提高自体诱导的效果和材料在骨重建中的再利用。(3)VEGF能特异地作用于血管内皮细胞,促进其增殖和血管生成,血管长入骨痂可促进形成新骨,对骨痂进行改造塑形[7]。此外,VEGF能直接刺激成骨细胞碱性磷酸酶活性,并促进成骨细胞的迁移与分化。因此,这三种手段的联合治疗充分发挥了各材料的优势,从而最大限度地促进了ONFH区域的修复。
综上所述,本研究表明髓芯减压+胶原基骨修复材料+VEGF可有效促进ONFH家兔损伤区域的成骨和血管修复,并且可减轻微循环障碍,其机制与改善脂质代谢、调节VHL/HIF⁃1α/VEGF信号及bFGF表达有关。该治疗方法可能是治疗ONFH的新型高效疗法,具有较高的临床研究价值。

