基于生物学信息探讨KIF26B在上皮性卵巢癌中的表达及临床意义
蒲雨康 黄玉琴 李伟 李明群
湖北医药学院附属襄阳市第一人民医院妇产科(湖北襄阳 441100)
卵巢癌(ovariancancer,OC)是全球第三大常见的妇科恶性肿瘤,其中上皮性卵巢癌(epithelial ovariancancer,EOC)约占卵巢恶性肿瘤 80%~90%,临床中早期难以发现,就诊时超过70%的患者已到晚期,病死率极高[1]。截止2020年,全球有31万余EOC确诊病例,死于EOC的患者超过20万[2]。在我国,EOC的发病率在过去10年间增长了30%[3]。尽管手术、放化疗等医疗手段在EOC的治疗上取得了一定进展,但由于EOC容易出现复发、转移和严重耐药等问题导致患者的5年生存率仅为20%~30%[4]。近年来,众多证据表明,肿瘤微环境中免疫浸润细胞改变会对肿瘤的发展、转移和耐药起到重要影响。此外研究发现间充质肿瘤比非间充质肿瘤更难达到完全减瘤,EOC治疗过程中出现的耐药现象也与之相关。肿瘤微环境和间充质的研究以及化疗出现耐药时联合免疫治疗目前已成为EOC的研究热点[5-6]。确定EOC肿瘤微环境中免疫细胞的构成及其影响因素,是EOC免疫治疗领域迫切需要解决的问题。
驱动蛋白家族(kinesin family,KIF)成员基因是近些年肿瘤基因治疗研究的热点。本文通过大数据对EOC样本进行分析发现KIF26B呈高表达并与细胞基质连接、上调TGFB1靶基因、间充质细胞分化、血管内皮生长因子(VEGF)、黏着斑、肿瘤信号通路等相关。此外与肿瘤微环境免疫浸润相关。免疫浸润分析提示KIF26B高表达组较低表达组具有高构成比的初始B细胞、未活化CD4记忆T细胞和低构成比的记忆性B细胞、滤泡辅助性T细胞、活化NK细胞、活化树突状细胞。KIF26B表达与巨噬细胞M0、树突状细胞、CD4+T、CD8+T细胞呈正相关,与B细胞呈负相关。既往研究发现KIF26B基因及同家族其他基因在乳腺癌、胃癌、结直肠癌、骨肉瘤等中过度表达与较大的肿瘤发生、较高的转移风险、较差的预后和耐药发生相关。对于KIF26B在EOC中的研究目前鲜见报道。与此同时,关于KIF26B与其相对应的肿瘤微环境及免疫浸润情况目前尚未明确。
因此,本文基于公共数据库检测KIF26B在EOC组织和癌旁组织中的表达情况,并通过免疫组化进行验证。探讨KIF26B在EOC发生发展过程中可能参与的通路及临床相关性,同时探讨KIF26B在EOC进展中与肿瘤微环境及免疫浸润之间的关系,为EOC机制研究、预后评估及治疗提供新的方向。
1 资料与方法
1.1 资料从肿瘤基因组图谱(The Cancer Ge⁃nome Atlas,TCGA)数据库中下载EOC患者的转录组数据及临床信息文件并对转录组数据进行标准化处理。提取KIF26B表达信息。临床信息包括年龄、FIGO分期、病理分级、手术治疗、肿瘤残余(RD0,<1 mm;RD1,1~10 mm;RD2,11~20 mm;RD3,>20 mm)、预后等。剔除临床信息和生存资料不完整的样本,最终将临床数据620例,EOC样本数据315例纳入研究。
1.2 KIF26B表达及其与临床特征、生存情况的关系使用GEPIA数据库(https://www.proteinatlas.org/)分析KIF26B在泛癌的表达情况。HPA数据库(https://www.proteinatlas.org/)分析 KIF26B蛋白在卵巢组织和EOC中的表达情况;以KIF26Bm⁃RNA表达的中位数作为临界值,将EOC样本划分为高、低表达两组,分析KIF26B与EOC患者临床病理特征的关系;利用R软件的“survival”包绘制EOC组织中KIF26B高、低表达组患者的生存曲线。P值显著性用Log⁃rank检验分析。
1.3 KIF26B和临床性状与EOC的预后相关性分析使用单因素Cox和多因素的Cox回归对KIF26B和EOC相关的临床特征值如年龄、FIGO分期、病理分级、肿瘤残余灶等进行分析,计算95%置信区间(CI)的危险比(hazard ratio,HR)和Log⁃rank 值,筛选出P<0.05变量作为独立预后的指标。
1.4 基因集富集分析(GSEA)使用GSEA(gene set enrichment analysis)软件(http://www.broadinstitute.org/gsea),在MSigDB数据库中,选择GO和KEGG基因集对KIF26B高表达组基因相关生物学功能和信号通路进行分析。置换检验次数1 000次,以标准化富集评分(NES)≥1.0和FDR校正P<0.25被认为具有统计学意义。
1.5 KIF26B与TME的关系使用CIBERSORT(https://cibersort.stanford.edu)算法比较EOC中KIF26B高、低表达组22种免疫细胞构成比。根据P<0.05筛选预测合格的样本。随后使用R语言工具分析EOC样本中KIF26B表达与免疫细胞的相关性。在所有EOC样本中以每种浸润免疫细胞构成比的中位值为界,将样本划分为低构成比组(Low)和高构成比组(High),运用R软件(3.6.3)中的“survival”包绘制生存曲线,以P<0.05认为有统计学意义。
1.6 免疫组化验证KIF26B在EOC中的表达选取我院2020年1月至2021年12月初次诊断并接受手术的20例EOC患者的石蜡样本作为研究对象,其中浆液性卵巢癌和黏液性卵巢癌各10例,患者平均年龄50.5岁。按FIGO分期标准将Ⅰ期和Ⅱ期归入早期,共5例(其中Ⅰ期2例,Ⅱ期3例),Ⅲ期和Ⅳ期归入晚期,共15例(其中Ⅲ期11例,Ⅳ期4例);病理分级中高分化9例,低分化及未分化11例。对照组良性上皮性卵巢肿瘤5例,其中浆液性为3例,黏液性为2例,平均年龄42岁。正常卵巢组织5例,经病理证实无异常,平均年龄为53.2岁。所有患者术前均未接受过化疗、放疗、激素及免疫治疗。患者均签署知情同意,实验经湖北医药学院附属襄阳市第一人民医院医学伦理委员会批准(XYYYE20220101号)。
将石蜡组织标本制备成5 μm石蜡切片,60℃烘箱烤片1 h。脱蜡后经3%内源性过氧化物酶阻断剂灭活,0.01 mol/L磷酸缓冲盐溶液(PBS)冲洗,热修复抗原,PBS冲洗封闭后滴加一抗KIF26B抗体(1∶300),37℃孵育2 h后再次PBS冲洗。二氨基联苯胺(DAB)显色,苏木素复染,脱水,固定。检测结果由2名经验丰富的病理科主任医师判读。采用半定量积分法:对每张切片的阳性细胞率和阳性细胞着色强度进行分级计分,然后根据两项之和确定其阳性强度。按阳性细胞率,以计数10个高倍视野细胞为准:阳性细胞≤5%为0分,6%~30%为1分,31% ~50%为2分,>50%为3分;按染色强度评分:无色为0分,弱染色为1分,中等染色为2分,强染色为3分。两者相加≤1分为阴性(-),2~3分为弱阳性(+),4~5分阳性(++),>5分为强阳性(+++)。
1.7 统计学方法采用R软件(R3.6.4)和软件SPSS 22.0进行数据分析,采用Kaplan⁃Meier法进行绘制生存曲线(OS和DFS),组间预后比较采用对数秩检验。KIF26B与临床病理参数组间比较采用χ2检验。使用单因素和多因素Cox回归分析方法对生存资料的预后进行评估。以P<0.05为差异有统计学意义。
2 结果
2.1 KIF26B表达与临床病理特征及预后的关系公共数据库中KIF26B在多数泛癌以及EOC组织中的mRNA表达显著高于癌旁组织(P<0.05,图1A、B)。免疫组化提示KIF26B蛋白在EOC组织中高表达(图1C、D)。
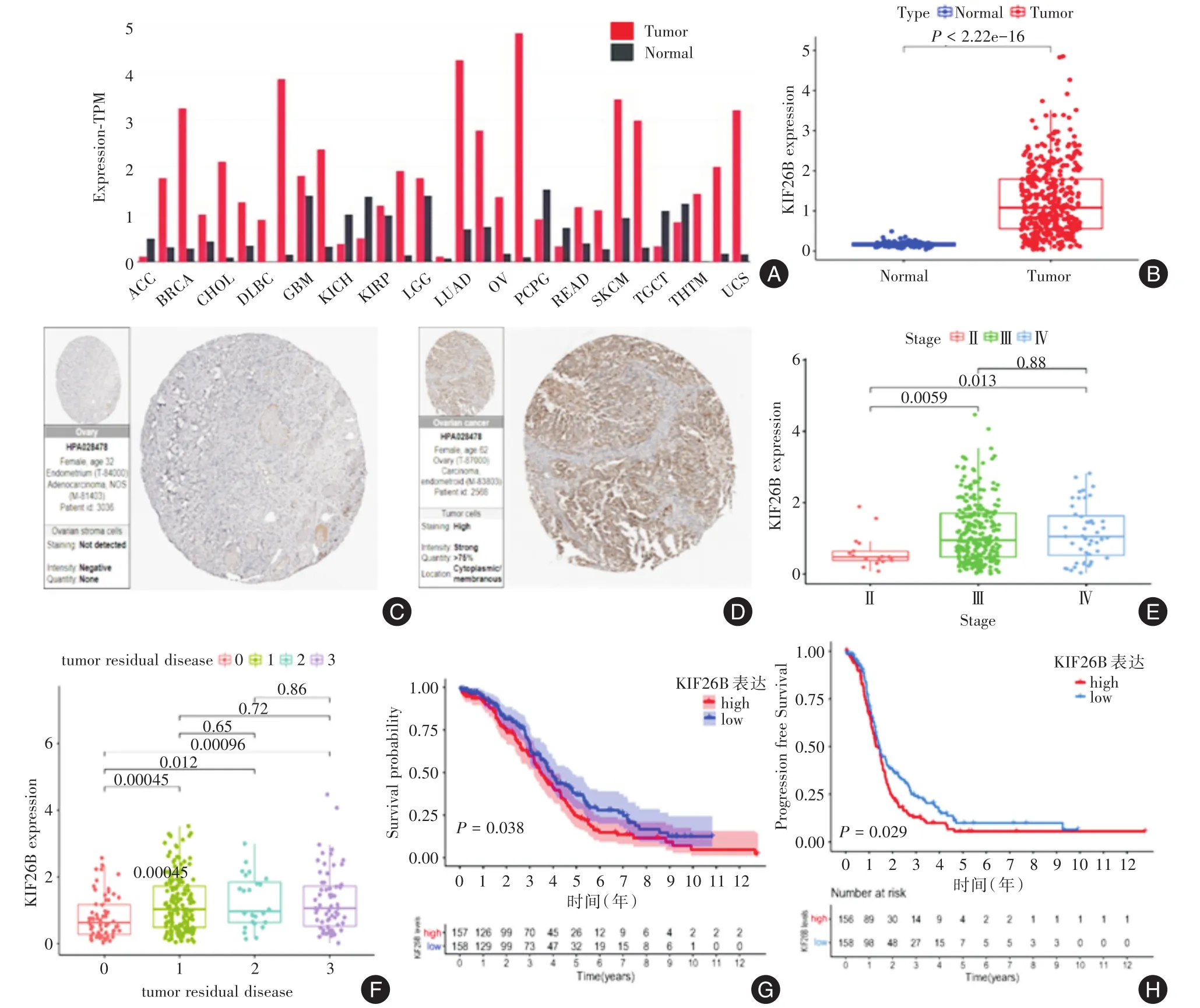
图1 KIF26B表达与EOC临床病理特征及预后的关系Fig.1 Relationship between KIF26B expression and clinicopathological characteristics and prognosis in epithelial ovarian carcinoma
将TCGA数据库中经过筛选的315例EOC样本,以KIF26B表达中位数作为临界值将样本分为KIF26B高表达组(n=158)和低表达组(n=157),通过χ2检验发现KIF26B表达与ECO患者的FIGO分期、肿瘤残余灶(χ2=12.1、11.8,P< 0.05)相关而与EOC患者年龄、病理分级、手术治疗不相关(P>0.05,表1)。其中KIF26B在FIGO分期Ⅲ期和Ⅳ期中的表达明显高于FIGO分期Ⅰ、Ⅱ期(P<0.05,图1E)。在肿瘤残余灶(RD)的亚组中,RD1、2、3组分别与对照组RD0相比KIF26B表达差异有统计学意义(P< 0.05,图1F)。Kaplan⁃Meier曲线示KIF26B高表达组EOC患者的预后较差(P<0.05,图1G、H)。
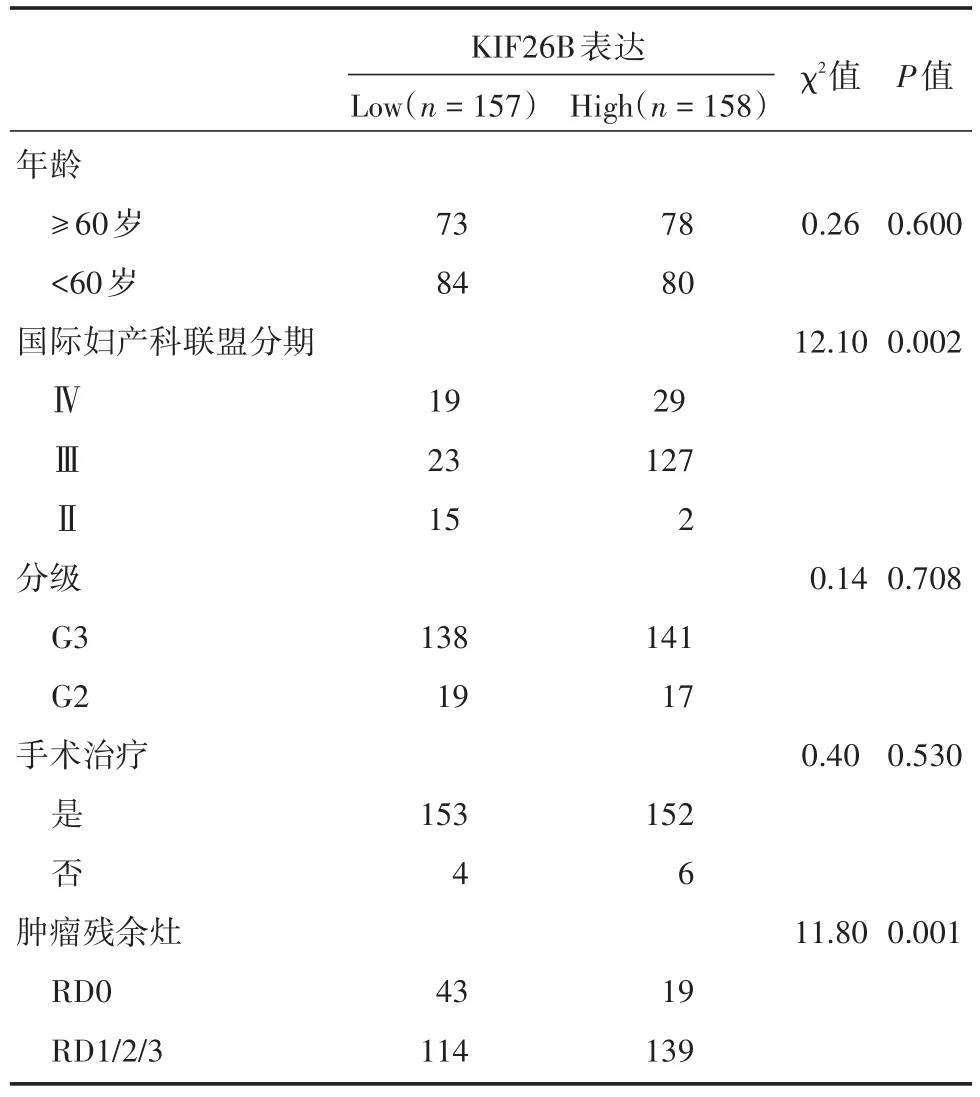
表1 EOC组织中KIF26B的表达与临床病理特征的关系Tab.1 Relationship between KIF26B expression and clinicopathological features in epithelial ovarian cancer例
2.2 KIF26B和临床病理特征在EOC中的预后分别使用单、多因素Cox模型对EOC患者进行风险回归分析(表2)。单因素Cox回归分析发现KIF26B高表达、年龄、手术、肿瘤残余灶为影响EOC预后的风险因素(P<0.01)。多因素Cox回归分析对上述协变量进一步矫正显示KIF26B高表达(HR=1.26,95%CI:1.06 ~ 1.49,P< 0.05)、年龄(HR=1.02,95%CI:1.01 ~ 1.04,P< 0.05)、手术(HR=0.16,95%CI:0.07 ~ 0.35,P< 0.01)、肿瘤残余灶(HR=1.20,95%CI:1.04 ~ 1.39,P< 0.05)可作为影响EOC患者预后的独立风险因素。
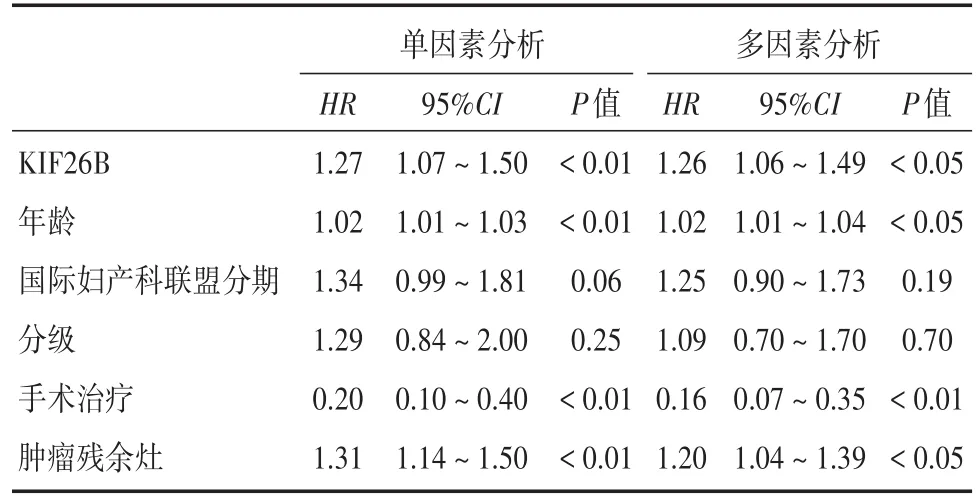
表2 KIF26B和临床特征值在EOC中的预后情况Tab.2 Prognosis of KIF26B and clinical characteristic values in epithelial ovarian cancer
2.3 GSEA分析从信号通路层面探讨KIF26B基因在EOC发生发展过程中可能的作用机制,GSEA富集分析结果示,KIF26B高表达组与细胞基质连接信号通路、上调TGFB1靶向信号通路、间充质细胞分化信号通路、血管内皮生长因子(VEGF)信号通路、黏着斑信号通路、肿瘤信号通路相关(图2)。
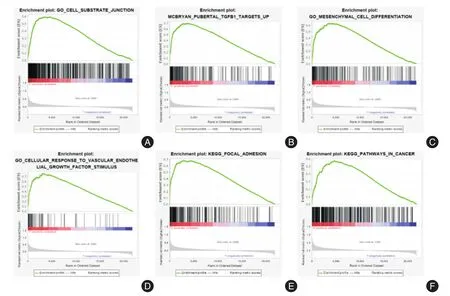
图2 KIF26B高表达组基因的GSEA分析Fig.2 GSEA analysis of KIF26B high expression group genes
2.4 KIF26B与EOC免疫细胞浸润的关系通过TCGA数据库分析KIF26B表达与EOC肿瘤微环境中淋巴浸润的关系。发现KIF26B在有淋巴浸润的分组中表达量明显高于无淋巴浸润的分组(P=0.015,图3B)。用CIBERSORT工具评估样本中22种浸润性免疫细胞的构成比并与KIF26B基因表达进行匹配。结果提示与KIF26B低表达组相比KIF26B高表达组具有高构成比的初始B细胞(P<0.002)、未活化CD4记忆T细胞(P<0.002)和低构成比的记忆性B细胞(P<0.01)、滤泡辅助性T细胞(P<0.03)、活化NK细胞(P<0.08)、活化树突状细胞(P<0.01,图3A)。KIF26B表达与免疫细胞相关性分析结果显示KIF26B表达与巨噬细胞、树突状细胞、中性粒细胞、CD4+T细胞、CD8+T细胞(r=0.348、0.268、0.266、0.215、0.195,P< 0.01)呈正相关;而与B细胞(r=-0.12,P<0.05)呈负相关。

图3 KIF26B表达与TME的关系Fig.3 Relationship between KIF26B expression and tumor microenvironment
2.5 KIF26B相关免疫细胞浸润水平与EOC患者预后的关系在EOC组织样本中,以每种浸润免疫细胞的中位值为界,将所有样本划分为低构成比组与高构成比组,K⁃M曲线示高构成比活化肥大细胞的患者生存率显著低于低构成比组(P=0.033,图3E)。而高构成比巨噬细胞M1、记忆性B细胞、滤泡辅助性T细胞、活化CD4记忆T细胞的患者生存率则高于低构成比组(P< 0.05,图3B⁃D、F、G)。
2.6 KIF26B在EOC组织中表达的IHC验证IHC实验结果显示,5例正常卵巢组织中有1例(+);在良性卵巢肿瘤组织中2例分别为(+)和(++);在20例上皮性卵巢癌组织中有3例(-),4例(+),6例(++),7例(+++),其中有17例细胞胞膜及胞浆呈不同程度的弱阳性、阳性及强阳性表达,阳性表达率85%(图4)。

图4 KIF26B表达的IHC验证Fig.4 IHC validation of KIF26B expression
3 讨论
EOC是严重威胁女性健康及生命安全的致命因素。在我国每年约有3.09万卵巢癌相关死亡病例,且发病率逐年增加[7]。肿瘤复发和化疗耐药是导致EOC患者5年生存率较低的主要原因。近年来有学者提出联合免疫治疗可以改善患者预后。因此寻找敏感性更高的预后标志物和了解影响肿瘤免疫微环境的因素并寻找免疫治疗靶点从而提升患者的生存率是目前研究面临的挑战。TCGA数据库在全球范围内共收集了30多种癌症的基因测序数据和100 000多例患者的临床数据[8],通过生信分析得出的数据结果,为实验研究提供了循证医学证据,可以更快地进行实验验证及临床转化。
驱动蛋白超家族(KIFs)是一类与微管结合且与ATP酶活性相关的运动蛋白,与癌症的发展密切相关[9]。KIF26B属于KIFs的一员,位于染色体上1q44,由2 108个氨基酸编码组成,分子量大小约223.8 kDa。KIF26B参与了小鼠胚胎发育过程中面部,体节和四肢的发育。KIF26B对肾脏发育间充质细胞的粘附和极化至关重要[10];目前已经证明KIF26B的过表达增加细胞黏附力其机制为促进了N⁃钙黏蛋白细胞与MHCⅡ类分子间的相互作用。在乳腺癌中KIF26B可通过FGF2/ERK信号通路促进乳腺癌细胞增殖和迁移[11-12]。喉腺癌中KIF26B高表达和肿瘤分期呈正相关[13]。CHEN等[14]发现沉默KIF26B可通过AKT/GSK⁃3β介导的Wnt/β⁃catenin途径失活,从而削弱非小细胞肺癌的恶性行为。KIF26B可通过PI3K⁃AKT途径促进肝细胞癌的发生[15]。KIF26B 还被认为是 Wnt5a⁃Ror途径下游靶点,它的功能在于调控细胞骨架的有关发育,如细胞的迁移、极化、黏附等[16]。KIF26B作为癌基因已经在多种肿瘤中被研究发现其与肿瘤的增殖、转移、预后不良相关。本研究发现KIF26B基因在EOC组织中过度表达,并与EOC患者的FIGO分期、肿瘤残余大小相关,提示KIF26B参与了EOC的恶性进展,同时通过预后分析发现其是影响EOC患者预后的独立危险因素。基于此,提示KIF26B可能成为EOC的预后标志物。通路富集有助于预测KIF26B在EOC发生发展中的分子机制,本文通过GSEA分析发现KIF26B高表达与细胞基质连接、上调TGFB1、黏着斑(FAK)、VEGF信号通路、间充质细胞分化等信号通路相关。
间充质细胞(MSCs)是目前肿瘤研究的热点,同时也参与构成肿瘤微环境(TME)[17-18]。目前普遍认为MSCs在TME中可能通过以下机制发挥作用:(1)在肿瘤组织中转化为肿瘤相关成纤维细胞(CAFs),引发血管形成异常和胶原纤维积累过多,为肿瘤发生和发展创造了条件[19]。(2)通过分泌细胞因子(IL⁃1α、IL⁃6、TGF⁃β 等)以及与各类免疫细胞(T细胞、B细胞、树突状细胞等)间的相互作用,介导TME中广泛的免疫抑制过程[20]。(3)MSCs分泌的外泌体可能通过EMT途径增加肿瘤的侵袭性。在MSCs与卵巢癌细胞相关研究中,SO等[21]发现,MSCs通过分泌IL⁃6介导卵巢癌细胞上皮间质转化,获得间充质特性,进而使MMP⁃2和MMP⁃9分泌增加,最终提高了卵巢癌细胞的侵袭和转移能力。CASTELLS等[22]发现 MSCs可通过 PI3K⁃Akt、BMP4/HH信号通路抑制卵巢癌细胞凋亡,从而增强了卵巢癌对卡铂和紫杉醇的化疗耐药性。通过本文富集及上述研究结果并结合KIF26B的间充质特性,推测MSCs介导EOC的转移和化疗耐药发生以及重构肿瘤微环境介导EOC的恶性进展可能与KIF26B密切相关。
VEGF与实体肿瘤的复发转移密切相关[23]。ZHANG等[24]发现KIF26B可能通过VEGF通路促进胃癌增殖与转移。本文通路富集发现KIF26B可通过VEGF介导EOC的恶性进展,与之前研究相符。近年来VEGF抑制剂贝伐单抗已有临床试验证明其在EOC放化疗及铂敏感复发患者中的确切疗效。结合临床药物研究,对于复发性EOC的患者,以KIF26B的基因靶向治疗可能是新方向。
TME主要由免疫浸润细胞及癌相关基质细胞组成,是肿瘤细胞生长的内环境[25-26]。其中肿瘤浸润淋巴细胞(TILs)被认为与肿瘤的发生、发展高度相关,肿瘤内各个浸润免疫细胞亚群量的改变同样会影响患者的预后[27]。然而,对于KIF26B在肿瘤免疫微环境中作用以及是否可作为免疫治疗的靶点仍然未知。本文发现KIF26B表达变化影响EOC TME中初始B细胞、未活化CD4记忆T细胞、记忆性B细胞、滤泡辅助性T细胞、活化NK细胞、活化树突状细胞的浸润水平。同时与巨噬细胞M0、树突状细胞、中性粒细胞、CD4+T细胞、CD8+T细胞呈正相关,而与B细胞呈负相关。免疫预后分析表明高构成比的活化肥大细胞预示着EOC患者较差的生存时间,而高构成比的T细胞、记忆性B细胞、Tfh、活化CD4记忆T细胞则提示着较好的生存预后。因此,本文发现KIF26B可能与TME和免疫浸润细胞密切相关,并可通过重构TME促进EOC的发生发展从而影响患者的预后,这一发现可为临床精准免疫治疗提供帮助。
本文为KIF26B在EOC中的作用提供了全面的认识,但仍具有一定的局限性:测序数据即使被矫正后再行分析,但仍存在一定的干扰,本文仅通过免疫组织化学方法进行了初步验证,具体还需要一步试验对结论加以验证并扩大样本及长期追踪随访探讨其表达及临床相关性;下一步的研究方向是通过基础实验明确KIF26B调控MSCs在EOC导致复发及耐药的具体机制,以及研究KIF26B与重构后的EOC免疫微环境中免疫细胞相关基因和免疫检查位点之间的相关性,验证其是否可作为有效的免疫治疗靶点。
综上所述,本研究使用多种生物信息学方法,评估基因表达、存活率、临床病理特征相关性和通路富集,最终结果显示了KIF26B的临床价值,KIF26B基因在EOC组织中高表达可能通过黏着斑(FAK)、VEGF信号通路、间充质细胞分化等信号通路参与EOC的恶性进展。同时是判断患者预后的独立危险因素。通过IHC对其表达量得到初步验证。KIF26B表达与肿瘤微环境和免疫浸润细胞密切相关,KIF26B可通过重塑TME促进肿瘤细胞免疫浸润,并影响癌患者预后。KIF26B在EOC的发生发展和免疫浸润调节方面发挥了重要作用,有可能成为EOC癌潜在的治疗靶点和预后标记物。

