年轻Sca⁃1骨髓干细胞对年老小鼠心外膜细胞衰老的调控作用及机制研究
董珺 吕饶 高芳 于佳迪 李柳蓁 湛楚蓝李月亮 刘慰华 黎佼
1广州医科大学附属第二医院(广州 510260);2山东省滨州市人民医院(山东滨州 256600);3广州医科大学附属第六医院(广东清远 511518)
衰老损害了细胞的功能,包括端粒长度缩短、端粒酶活性下降、线粒体活性下降、自噬功能下降等[1-4]。细胞的衰老,同样影响了细胞移植治疗效果[5-8]。心外膜细胞被证实,可以通过促进上皮间质转化、旁分泌生长因子等途径,改善心肌梗死后小鼠心脏功能[9-10]。本课题组前期研究证实,年轻Sca⁃1骨髓干细胞,可通过旁分泌生长因子促进心外膜细胞上皮间质转化[11]。而衰老对心外膜细胞功能的影响,以及年轻Sca⁃1骨髓干细胞对年老小鼠心外膜细胞衰老的调控作用鲜见报道。为此,2019年6月至2022年6月,本课题组研究了年轻Sca⁃1骨髓干细胞对年老小鼠心外膜细胞衰老的调控作用及其分子机制。
1 材料与方法
1.1 材料
1.1.1 不同年龄段小鼠选取选取C57BL/6小鼠作为实验动物(月龄2~3个月作为年轻小鼠,月龄22~23个作为年老小鼠)。购自广东省医学实验动物中心[SCXK(粤)2018⁃0002]。并通过伦理委员会审查(审查编号:广医二院B2021⁃021)。
1.1.2 主要试剂及仪器细胞分选试剂(Stem Cell Technology,Cat#:18756);P16免疫荧光染色抗体(Abcam,Cat#:ab54210);GDNF ELISA检测试剂盒(Abcam,Cat#:ab171178);Transwell室(Corning);荧光定量PCR仪(ABI)。
1.2 方法
1.2.1 Sca⁃1细胞的提取及鉴定分别收集年轻和年老小鼠股骨中骨髓细胞,通过试剂盒分选Sca⁃1及Sca⁃1⁃细胞,并鉴定细胞比例[10-11]。年轻小鼠来源Sca⁃1细胞作为年轻组(Y Sca⁃1),年老小鼠来源Sca⁃1细胞作为年老组(O Sca⁃1)。
1.2.2 心外膜细胞培养收集年轻和年老小鼠心脏,0.25%胰酶消化20 min。离心后,收集心外膜细胞于DMEM中。培养1 h后,移除不贴壁细胞。3 d后换液,通过WT1染色鉴定细胞[11-12]。年轻小鼠来源心外膜细胞作为年轻组(Y),年老小鼠来源心外膜细胞作为年老组(O)。
1.2.3 细胞衰老检测P16免疫荧光染色检测细胞衰老。细胞(2×105/cm2)经不同处理后,2%多聚甲醛固定细胞,P16一抗(1∶100)4℃染色过夜,二抗室温染色2 h,荧光显微镜下检测染色阳性细胞。
1.2.4 qRT⁃PCR检测收取心外膜细胞总RNA,比较不同处理组中基因表达(P27、Sirt 1、Gdnf)。基因引物见表1。
表1 qRT⁃PCR引物序列Tab.1 The sequences of qRT⁃PCR primer
1.2.5 Western blot检测收取心外膜细胞蛋白,比较不同处理组中蛋白表达(P27、Sirt 1)。
1.2.6 细胞共培养Sca⁃1细胞与年老心外膜细胞(O)通过Transwell小室共培养。无血清,低氧培养(0.1% O2)72 h后,检测细胞衰老及相关基因与蛋白的表达。
1.2.7 细胞旁分泌生长因子鉴定Y/O组Sca⁃1细胞,无血清,低氧培养(0.1% O2)72 h后,收集细胞及上清。通过qRT⁃PCR检测细胞中Gdnf的表达。通过ELISA检测试剂盒,检测细胞及上清中GDNF的表达。
1.3 统计学方法应用SPSS 19.0统计软件,数据以均数±标准差表示,两组间采用独立样本t检验,多组间采用单因素方差分析进行统计学分析。P<0.05为差异有统计学意义
2 结果
2.1 不同年龄组心外膜细胞的衰老表达对比收集Y及O心外膜细胞(图1A)。发现在缺氧条件下(0.1%O2),与Y组相比,O组衰老细胞(P16染色阳性)比例上升4倍(图1B、表2);衰老相关基因P27表达上升2.26倍(图1C),抗衰老相关基因Sirt 1下降69%(图1C、表2);衰老相关蛋白P27表达上升2.07倍(图1D),抗衰老相关蛋白Sirt 1下降79%(图1D、表2,均P<0.05)。
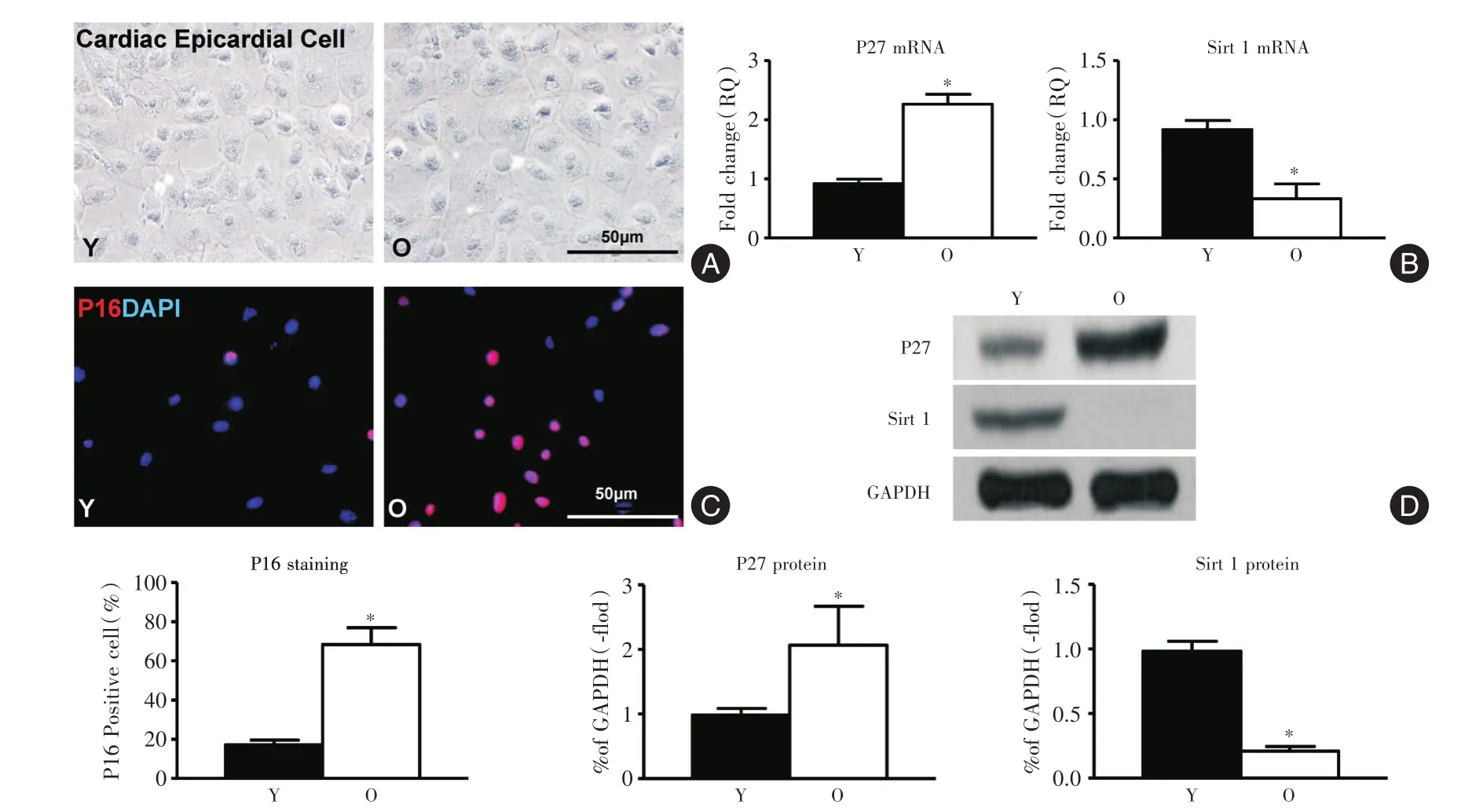
图1 心外膜细胞随年龄增加而衰老表达增加Fig.1 The senescence expression of epicardial cell was increased with ageing
表2 不同年龄组心外膜细胞衰老表达Tab.2 The senescence expression in different age epicardial cell ±s

表2 不同年龄组心外膜细胞衰老表达Tab.2 The senescence expression in different age epicardial cell ±s
项目P16荧光染色阳性细胞比例P27 mRNA Sirt 1 mRNA P27蛋白Sirt 1蛋白Y组17.100±2.451 1.000±0.076 1.000±0.064 1.000±0.102 1.000±0.062 O组68.400±8.577 2.265±0.163 0.331±0.126 2.067±0.603 0.310±0.027 P值<0.001<0.001 0.002 0.037<0.001
2.2 年轻Sca⁃1骨髓干细胞对年老心外膜细胞衰老表达的调控作用与O Sca⁃1细胞共培养组相比,Y Sca⁃1细胞共培养组,衰老细胞(P16染色阳性)比例下降64%(图2A、表3);衰老相关基因P27表达下降54%(图2B),抗衰老相关基因Sirt 1上升2.1倍(图2B、表3);衰老相关蛋白P27表达下降57.9%(图2C),抗衰老相关蛋白Sirt 1上升1.72倍(图2C、表3,均P<0.05)。
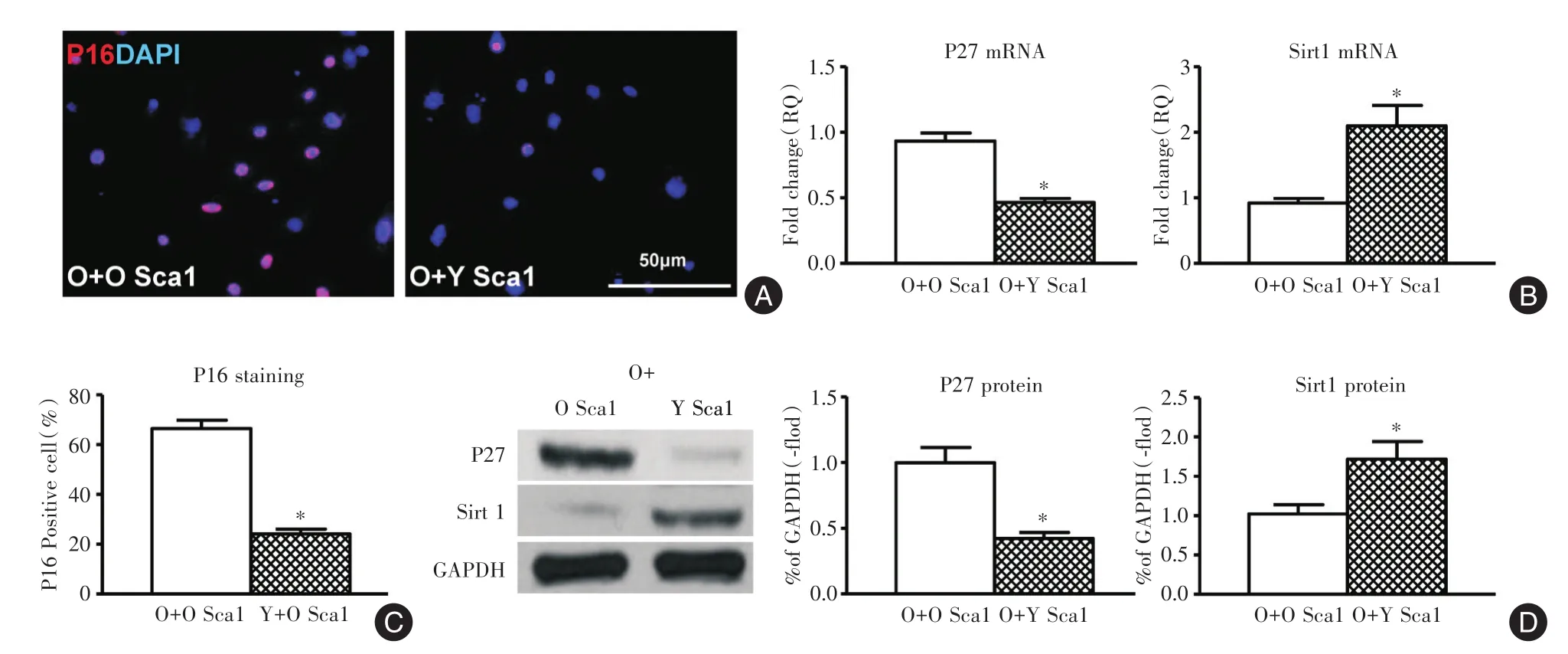
图2 年轻Sca⁃1骨髓干细胞可减少年老心外膜细胞衰老Fig.2 Young Sca1 bone marrow stem cell decreased old epicardial cell senescence
表3 年轻/年老Sca⁃1骨髓干细胞对年老心外膜细胞衰老的调控作用Tab.3 The effect of young and old Sca⁃1 bone marrow stem cell on old epicardial cell senescence ±s
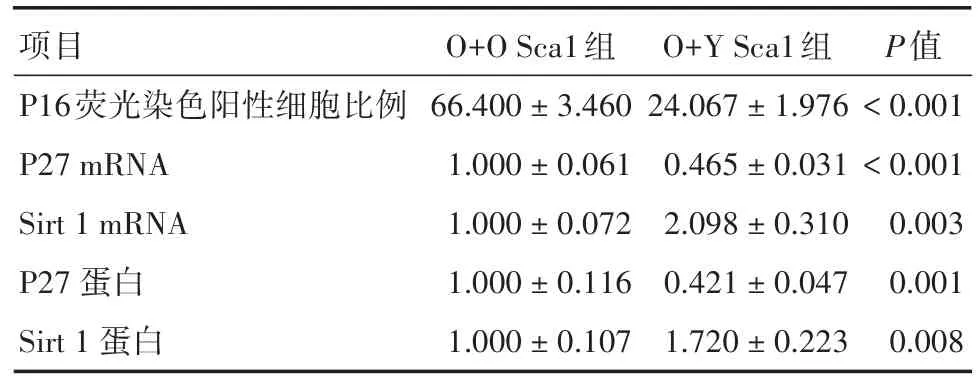
表3 年轻/年老Sca⁃1骨髓干细胞对年老心外膜细胞衰老的调控作用Tab.3 The effect of young and old Sca⁃1 bone marrow stem cell on old epicardial cell senescence ±s
项目P16荧光染色阳性细胞比例P27 mRNA Sirt 1 mRNA P27蛋白Sirt 1蛋白O+O Sca1组66.400±3.460 1.000±0.061 1.000±0.072 1.000±0.116 1.000±0.107 O+Y Sca1组24.067±1.976 0.465±0.031 2.098±0.310 0.421±0.047 1.720±0.223 P值<0.001<0.001 0.003 0.001 0.008
2.3 年龄对Sca⁃1骨髓干细胞旁分泌生长因子的影响与O Sca⁃1细胞相比,Y Sca⁃1细胞中,Gdnf基因表达上升3.01倍,GDNF蛋白的表达上升2.74倍。与O Sca⁃1细胞上清相比,Y Sca⁃1细胞上清中GDNF的表达上升2.25倍(图3、表4,均P<0.05)。
表4 年龄对Sca⁃1骨髓干细胞旁分泌生长因子的影响Tab.4 The effect of ageing on Sca1 bone marrow stem cell paracrine function ±s

表4 年龄对Sca⁃1骨髓干细胞旁分泌生长因子的影响Tab.4 The effect of ageing on Sca1 bone marrow stem cell paracrine function ±s
项目Gdnf mRNA细胞 GDNF(pg/mg)细胞上清GDNF(pg/mg)O Sca1组1.000±0.141 567.857±34.693 118.357±11.840 Y Sca1组3.01±0.723 1 556.399±111.830 266.219±27.902 P值0.010<0.001 0.001
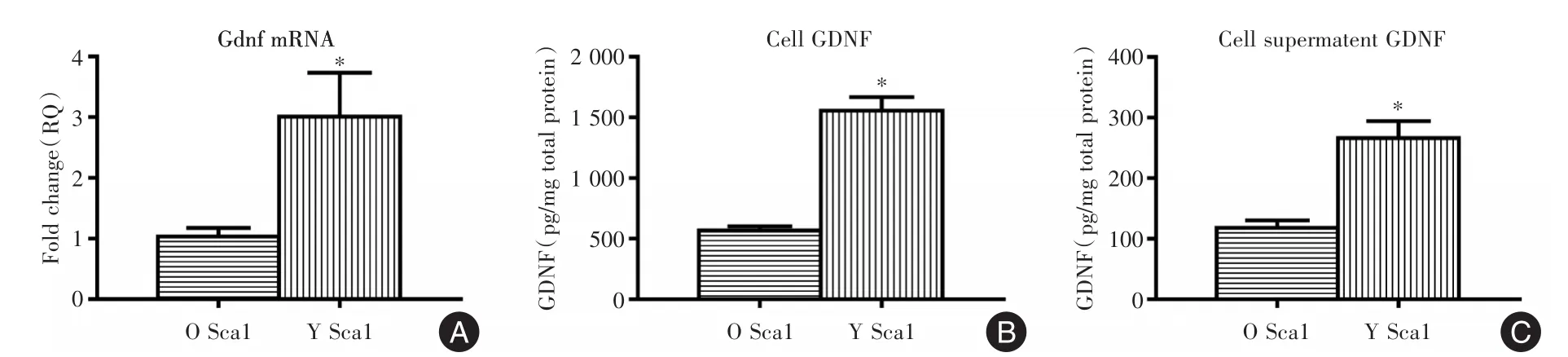
图3 年龄对Sca⁃1骨髓干细胞旁分泌生长因子的影响Fig.3 The effect of ageing on Sca1 bone marrow stem cell paracrine function
2.4 年轻Sca⁃1骨髓干细胞减少年老心外膜细胞衰老的机制研究中和年轻Sca⁃1细胞旁分泌的GDNF(R&D,15 μg/mL)。与 Y Sca⁃1细胞共培养对照组相比,中和GDNF组,衰老细胞(P16染色阳性)比例上升4.79倍(图4A、表5);衰老相关基因P27表达上升2.05倍,抗衰老相关基因Sirt 1表达下降62%(图4B、表5)。衰老相关蛋白P27表达上升1.9倍,抗衰老相关蛋白Sirt 1表达下降52%(图4C、表5),均P<0.05。
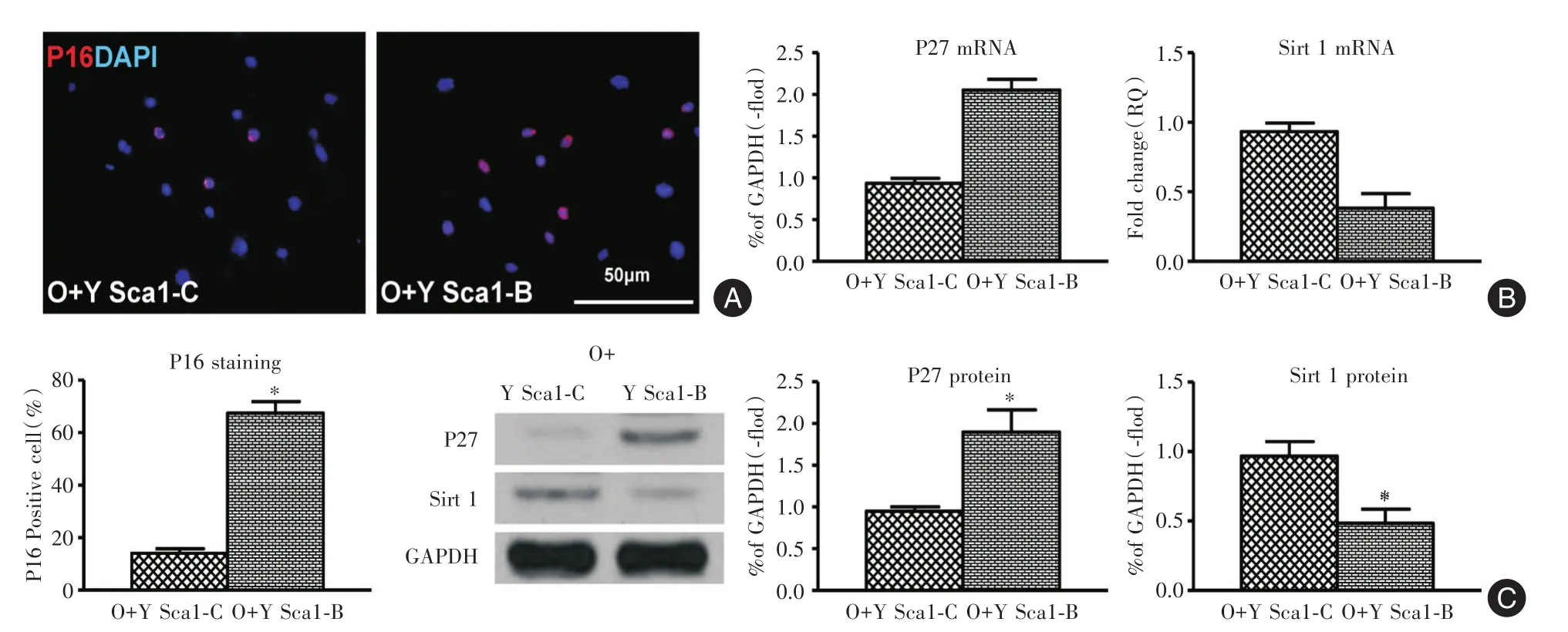
图4 年轻Sca⁃1骨髓干细胞通过旁分泌GDNF减少年老心外膜细胞衰老Fig.4 Young Sca1 bone marrow stem cell decreased old epicardial cell senescence through GDNF
表5 年轻Sca⁃1骨髓干细胞减少年老心外膜细胞衰老的机制研究Tab.5 The molecular mechanisms study of young Sca1 bone marrow stem cell decreased old epicardial cell senescence x±s
3 讨论
近年研究发现,Sca⁃1干细胞可调控心脏损伤修复[13-16]。在小鼠中敲除 Sca⁃1 基因,引起小鼠心肌收缩缺陷,并影响心脏祖细胞的增殖能力[17]。相反的,过表达Sca⁃1,可减少主动脉缩窄引起的小鼠心肌肥大和心脏纤维化,改善小鼠心脏功能[18]。心外膜细胞在心脏发育以及心脏损伤修复中的作用,在近年也得到进一步的关注[19]。有研究发现年龄也影响了Sca⁃1干细胞的功能。对不同年龄段来源的Sca⁃1干细胞的对比研究发现,细胞的衰老随年龄增加而表达增加,例如:端粒酶活性下降[20]。但是年龄对心外膜细胞功能的影响,以及不同年龄段来源的Sca⁃1干细胞对心外膜细胞的调控作用尚未明确。通过本研究证实随年龄增加,小鼠心外膜细胞衰老表达增加。年轻Sca⁃1骨髓干细胞可明显减少年老小鼠心外膜细胞衰老。
神经胶质细胞源性的神经营养因子(GDNF)在前期研究中,被发现在多种细胞再生中发挥调控作用[21-25]。例如在小鼠唾液腺干细胞的研究中发现,GDNF可促进干细胞存活及增殖,缓解放射损伤[22]。本研究证实与O Sca⁃1细胞相比,Y Sca⁃1细胞可分泌更多的GDNF。年轻小鼠Sca⁃1骨髓干细胞可通过旁分泌GDNF减少年老心外膜细胞衰老。
本研究探讨了年轻Sca⁃1骨髓干细胞对年老小鼠心脏细胞功能的调控作用及分子机制,为衰老相关疾病的细胞治疗提供了更多的证据支持。

