CRISPR/Cas9 基因编辑技术在C2C12 细胞中的研究进展
龚治安,崔静轩,张伟伟,2,邵淑丽,2,李铁,2
(齐齐哈尔大学 1.生命科学与农林学院,2.抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
近几年,基因组编辑工具的开发加速了敲除(KO)动物和敲除细胞系创建的进展.包括锌指核酸酶(zinc finger nuclease,ZFN)、转录激活因子样效应核酸酶(transcription activator-like effector nuclease,TALEN)和成簇规则间隔的短回文重复序列(Clustered Regularly Interspaced Short Palinmic Repeats,CRISPR)/Cas9系统[1].CRISPR 及其相关蛋白(Cas)是一种RNA 引导的核酸酶,由微生物适应性免疫系统通过再利用进行基因组编辑发展而来[2].CRISPR-Cas 技术可以促进真核细胞内的高效基因组工程[3],并且Cas9 蛋白的精确靶向是通过在其单向导RNA 内指定20 个核苷酸(nt)的靶向序列来实现的[4].将CRISPR-Cas9 基因组编辑工具应用于基因以及育种等方面,已成为科学家关注的焦点.
1977 年,Yaffe[5]等首次建立了C2C12 肌原细胞系,其可在2%马血清培养条件下被诱导分化,最终形成成熟的多核肌管,并表达肌球蛋白(myosin)和肌生成素(myogein,MyoG)等成熟骨骼肌的各种标志蛋白[6].C2C12 细胞系分化速度比较快,可以形成能紧缩的微管,进而产生特异性的肌肉蛋白.C2C12 成肌细胞系的建立则为研究骨骼肌的生长发育提供了一个很好的体外模型,通过研究不同处理对细胞增殖和分化的影响,可初步揭示其在肌肉生长发育中的作用,为其它相关研究提供可靠的依据.因此,C2C12 细胞可作为研究基因调节肌肉发育的生物学功能和分子机制的良好工具.CRISPR/Cas9 基因编辑技术可对C2C12细胞中的基因进行敲除或敲入,是研究该细胞成肌分化中分子机制的主要技术手段.本文以C2C12 细胞为研究对象,对CRISPR 技术的相关应用、研究方法、结果以及对相关研究的影响等进行综述,以期为进一步开展该领域的科学研究提供理论指导.
1 CRISPR/Cas9 编辑系统作用机制
CRISPR 于1987 年首次在大肠杆菌中发现[7],后来在许多其它细菌中被发现[8]406.几年来,短重复序列的作用仍不清楚,直到2005 年,几个研究小组描述了这些序列与噬菌体DNA 的相似性,提出了这些序列是细菌适应性免疫系统一部分的假设[9-11].这些研究后来扩展到实验证明CRISPR 及其相关蛋白(Cas)与靶向外源病毒DNA 的适应性免疫相关联[12].机制上,2 种不同的RNA——CRISPR 靶向(crRNA)和反式激活RNA(tracrRNA)能够激活并引导Cas 蛋白结合病毒DNA 序列,随后被剪切[13-14].这些CRISPR 系统的一个亚组(即Ⅱ型系统)依赖于单个Cas 蛋白靶向确定的DNA 序列,因此作为基因组编辑的工具特别有吸引力.将crRNAs 与tracrRNAs 结合成单个向导RNA(sgRNA)进一步简化了该系统[15]816.2013 年首次利用化脓性链球菌(Streptococcus pyogenes,SpCas9)的Ⅱ型Cas 蛋白在哺乳动物细胞中进行RNA 引导的DNA切割,为利用CRISPR/Cas9 作为广泛适用的基因组编辑工具奠定了基础[16-17].在切割靶DNA 之前,Cas9 核酸酶在sgRNA 结合时发生构象变化,并指向其靶位点.结合特异性由3 个核苷酸前间隔区相邻基序(PAM,由NGG 或NAG 序列组成)前的20 个核苷酸序列决定[15,18-19].DNA 解旋后,与PAM 结合并形成DNA-sgRNA杂交体,2 个核酸酶结构域在靶序列中引入双链断裂(DSB)[14,19](见图1a).核酸酶活性的强度很大程度上是由Cas9 的结合效率决定的.对sgRNA 支架进行系统修饰,鉴定出一种优化的支架结构,与Cas9 靶DNA 的更高结合效率相关[20].除了Cas9,其它使用替代PAM 位点(Cpf1)[21]或靶RNA(Cas13a/b)[22-23]的CRISPR II 型核酸酶已经被开发成基因组工程工具.
2 CRISPR/Cas9 系统的功能性应用研究
CRISPR/Cas9 系统在改变基因表达情况方面,利用核酸酶缺陷型SpCas9 修饰(dCas9)与其它效应结构域融合建立了多元化的体系[24](见图1b).CRISPR 干扰(CRISPRi)和激活(CRISPRa)利用融合的转录调节因子,当dCas9 被定向到靶基因的转录起始位点时,抑制或诱导基因转录[8]406.在抑制基因转录方面,大多数情况下,CRISPR 干扰系统依赖于带有KRAB 阻遏结构域的dCas9 融合来下调基因转录[25]445.值得关注的是,dCas9-KRAB 还可以通过改变靶位点的甲基化状态来修饰增强子区域,从而抑制基因转录[26].激活基因表达的研究中,首先发现了与dCas9 融合的单个VP64 激活剂结构域,从而激活转录[25,27].后续通过对该系统进行改进,将VP64 改变为一个三方激活剂VP64-p65-Rta(VPR)[28]或通过招募多个转录激活剂到dCas9,进而更加有效地激活基因的表达.除此之外,通过在dCas9 上添加长表位尾(称为SunTag)[29]或通过修饰sgRNA 支架包括适配子来生成激活剂结构域的额外结合位点(称为SAM)[30],同样也可以实现激活基因转录的效果.表观遗传学研究方面,同样也开发了dCas9 融合蛋白进行区域特异性表观遗传修饰.dCas9-DNMT3A或dCas9-DNMT3A-DNMT3L融合蛋白是目前有效的CRISPRa 系统,该系统可以选择性地增加靶向基因组区域CpG 基序的DNA 甲基化,从而抑制基因转录[31-33].

图1 CRISPR/Cas9 功能
3 CRISPR/Cas9 基因编辑系统在C2C12 细胞中的应用
3.1 C2C12 细胞中基因定点敲除或敲入
CRISPR/Cas9 系统在C2C12 细胞首次被应用于构建朊病毒蛋白(PrP)敲除克隆体系[34].MOYER[35]等采用CRISPR/Cas9 体系降低C2C12 成肌细胞中Mss51的表达,该基因是肌肉生长抑制素和TGF-β1信号传导的关键靶标,Mss51不调节肌母细胞增殖或分化,但是可作为肌肉生长抑制素和TGF-β1等生长因子对代谢过程的影响因素,包括脂肪酸氧化、糖酵解、氧化磷酸化.HUANG[36]等使用CRISPR-Cas9 生成了Ccndbp1-null 小鼠,Ccndbp1表达在C2C12 肌发生过程中上调.Ccndbp1过表达促进了肌发生,而Ccndbp1的敲低抑制了肌源性分化.2017 年,张凯丽[37]利用CRISPR/Cas9 技术首次实现了对小鼠成肌细胞Hnrnpk基因的敲除,并建立了利用CRISPR/Cas9 技术进行基因定点修饰的技术平台,为后续的基因定点修饰研究提供了一定的依据.YI[38]等利用CRISPR/Cas9 技术将C2C12 细胞中Setd2基因沉默,结果显示,肌管形成标志物Myogenin(MyoG)、肌球蛋白重链(MHC)在分化过程中下调,同时细胞增殖速率降低,细胞增殖缺陷、表型受损.崔亚凤[39-40]等利用CRISPR/dCas9 技术分别激活和抑制Egrl基因的表达,结果显示,Egr1能够促进小鼠成肌细胞C2C12 的分化.鲍美玉[41]在探究Runx1基因对C2C12 细胞增殖和分化的影响时发现,过表达Runx1基因后,C2C12 细胞分化被促进,增殖也被促进,而利用CRISPR/Cas9 敲除Runx1基因后,C2C12 细胞分化和增殖情况则与过表达相反.LI[42]等通过构建一个过表达PFN2a的C2C12 小鼠成肌细胞系发现,PFN2a抑制增殖并促进细胞凋亡,从而下调C2C12 肌源性发育.泛素特异性蛋白酶2(USP2)被认为参与成肌细胞向肌管的分化进程,CRISPR/Cas9 生成的Usp2(KO)C2C12 细胞表现出增殖抑制、三磷酸腺苷(ATP)含量的积累和耗氧量减少[43].此外,Usp2(KO)细胞以及USP2选择性抑制剂处理的C2C12细胞均提高了线粒体中活性氧(ROS),这提示该基因可调节线粒体的膜电位和形态,保证成肌细胞ATP的供应,进而参与增殖和分化过程.HUANG[44]等通过CRISPR/Cas9 系统构建了Mdfi过表达(Mdfi-OE)C2C12细胞系.实验表明,Mdfi通过上调Myod,Myog,Myosin的表达来促进C2C12 细胞分化,并积极调节快速到慢速抽搐的肌肉纤维转化[45].通过CRISPR/Cas9 介导的依赖性硫酸肝素(HS)缺失极大地损害了C2C12细胞的成肌细胞分化[46].在探究DPY19L3在C2C12 小鼠成肌细胞的肌源分化中的作用时,CRISPR/Cas9 系统进行了DPY19L3基因消耗.结果表明,DPY19L3的缺失使细胞不能被诱导分化[47].
3.2 C2C12 细胞中基因表达调控
CRISPR/Cas9 技术也广泛应用于C2C12 细胞成肌分化过程.李浩可[48-49]等利用CRISPR/Cas9 系统构建了LRTM1基因稳定敲除的C2C12 细胞株,MAPK/ERK通路异常激活促进了细胞的增殖,抑制了细胞的成肌分化.WANG[50]等使用CRISPR/Cas9 技术激活或抑制SPARCL1基因,结果发现,该基因激活BMP/TGF-β通路,促进C2C12 细胞的分化[51].丁聪[52]、王璐璐[53]、张闻宇[54]在探究ARID4B、FBF1、维生素A1 在C2C12细胞中的机制时都采用了CRISPR/Cas9 技术,结果发现,ARID4B是牛磺酸(Tau)促进C2C12 细胞增殖、蛋白质合成以及mTOR的mRNA 表达的关键介导分子.FBF1参与小鼠C2C12 细胞分化的过程,并且与Fas相互作用,Fas也可受FBF1的调控.外源添加维生素A1 很可能通过DHRS3催化形成维甲酸(RA)的途径促进C2C12 成肌细胞的分化.SRIRAM[55]等发现与C2C12 细胞相比,CRISPR/Cas9 介导的C3G敲低产生的C2C12 细胞的稳定克隆,不能正常分化,表现出Akt活性和S9-GSK3β磷酸化降低.转录因子CREB1是NRMT1转录的主要调节因子,CRISPR/Cas9 系统敲除C2C12 小鼠成肌细胞中NRMT1的表达后发现,C2C12 细胞中Pax7表达下降,影响细胞进程[56].转录因子ZBED6和Igf2内含子之间存在相互作用,然而当CRISPR/Cas9 介导基因敲除C2C12 成肌细胞中的miR-483 后,IGF2表达下调和细胞增殖率均降低[57].
在C2C12 细胞的肌生成抑制素(myostatin,MSTN)的研究中,CRISPR/Cas9 系统发挥了重要的作用.首先是HUANG[58]等使用CRISPR/Cas9 系统敲除小鼠C2C12 细胞系中的MSTN,并对mRNA 和miRNA 转录组进行测序.结果表明,MSTN的完全丢失上调了7 个miRNA,靶向有TGFB1,FOS,RB1等28 个下调基因,这些基因与肿瘤发生和细胞增殖密切相关,并且组成相互作用网络[58-59].双荧光素酶报告系统验证小鼠中的MSTN是mmu-miR-1/206 的靶位点.GE[60]等利用CRISPR/Cas9 基因编辑构建MSTN3′UTR 发生突变的C2C12 细胞模型.结果显示,该突变阻断了MSTN的翻译水平,并且通过抑制mmu-mir-206,可以挽救突变C2C12 细胞中MSTN蛋白的低表达.在缺血再灌注(IR)损伤的研究中,DRYSCH[61]等利用CRISPR/Cas9 基因编辑将myostatin(MSTN)缺失引入C2C12 细胞系.结果发现,C2C12-Mstn细胞在缺氧复氧(HR)作用下,MAPK/ERK激酶3/6(MEK3/6)随p38mapk活化减弱,该实验证实了肌肉生长抑制素对HR 中的保护作用.
3.3 C2C12 细胞中基因定点编辑
在C2C12 细胞基因改造方面,张宝[62]构建肌肉特异性表达的打靶小鼠Rosa26 位点的CRISPR/Cas9 载体,并利用CRISPR/Cas9 系统将Donor-CMV-Cas9-DsRed 与Donor-MCK-Cas9-DsRed 同源重组进入小鼠C2C12 细胞的Rosa26 位点.同样,王晓萌[63]等利用CRISPR/Cas9 系统以及肌肉特异性启动子SP,通过打靶小鼠C2C12 细胞中Rosa26 位点,成功构建了肌肉特异性表达的Cas9 载体PX459-Rosa26-SP 和肌肉特异同源打靶示踪载体Donor-Cas9-SP-DsRed.STEIL[64]等在C2C12 细胞中模拟CALM1基因的1 个或2 个等位基因中蛋氨酸氧化为蛋氨酸亚砜,利用CRISPR/Cas9 系统引入了一个氨基酸替换M109Q.结果显示,1 个或 2 个等位基因发生CALM1M109Q 突变的细胞无法退出细胞周期,未能表达晚期肌源性因子.GÓMEZ-DOMÍNGUEZ[65]等在小鼠C2C12 成肌细胞中,利用CRISPR/Cas9 技术在位于LMNA外显子4上构建了40 多个突变体,结果在突变体中检测到显著的肌源性分化缺陷.
这些研究实验均获得了具有纯合突变的单细胞克隆和有效的基因敲除或过表达载体,并构建了相应基因的细胞系,并验证了许多参与C2C12 细胞成肌分化的转录因子(见图2),为后续通过不同方法制备基因突变小鼠个体提供了材料以及理论依据.
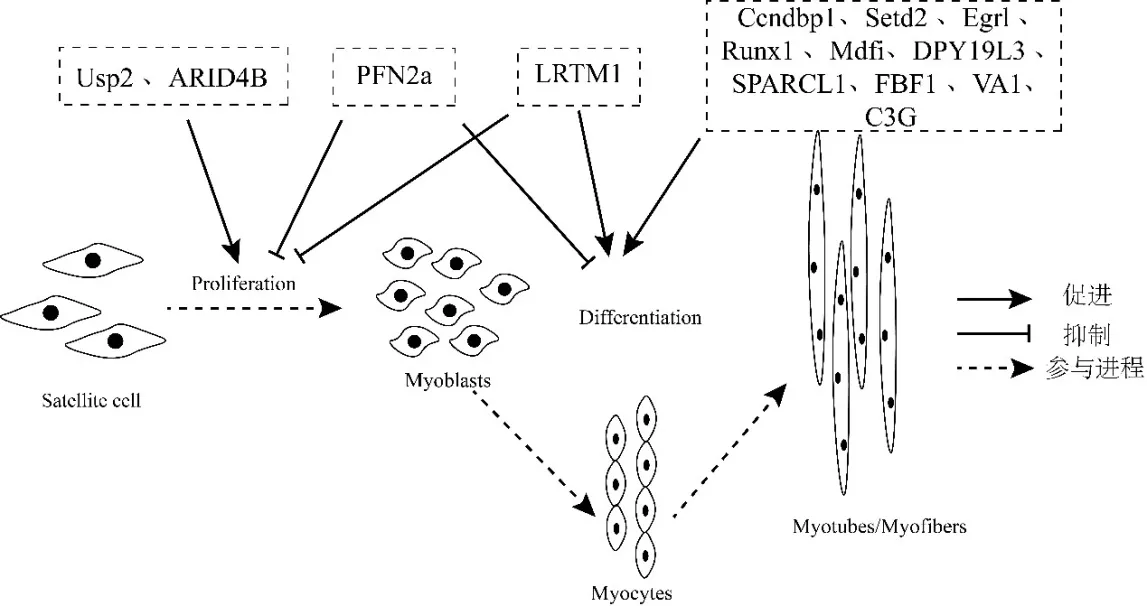
图2 利用CRISPR/Cas9 技术验证参与C2C12 成肌分化的调控基因
4 结语
CRISPR/Cas9 基因编辑技术通过不断完善已经发展为一项稳定的基因编辑手段.本文阐述的研究结果表明,CRISPR/Cas9 系统被广泛应用于小鼠C2C12 细胞基因编辑的多个方面,并验证了大量参与C2C12 细胞成肌分化的转录因子.但从技术层面考虑CRISPR/Cas9 基因编辑技术还存在严重的脱靶问题,这应当是在后期研究过程中重点完善的部分.在C2C12 细胞的实验结果也为构建特异性基因突变小鼠以及肌细胞增殖分化的研究提供更多的理论参考.CRISPR/Cas9 就技术而言已经达到成熟阶段,而且基于Cas9 的单碱基基因编辑技术也已经出现,这样基因编辑精确性在理论层面被提升到了极高的水平,其应用前景极其可观.基于CRISPR 强大的基因编辑功能,在临床研究中筛选疾病关键基因、癌症免疫疗法以及遗传疾病治疗等方向都具有巨大潜力.除了Cas9 系统之外,Cas12/13 技术也逐渐成熟,但目前仅能在实验室中应用,大规模商业化应用较困难.目前可以预见的是,CRISPR/Cas9 系统会更加深入和广泛地被应用于各种细胞以及动物的基因编辑研究方面,这将加快农业育种、医学研究和临床疾病治疗等方面的研究取得突破性进展.同时,同家族的Cas12/13 技术成熟也将成为未来基因编辑技术发展中的重要篇章.

